超声波辅助提取紫玉兰叶多酚工艺及其抗氧化活性研究
2022-10-24陈建福
陈建福
(漳州职业技术学院 应用化工学院,福建 漳州 363000)
紫玉兰(MagnolialiliifloraDesr.)又名辛夷、木兰,为中国特有的乔木类园林植物,在我国的福建、湖北、云南、广东、广西等省(自治区)均有种植[1].紫玉兰花朵呈紫色,花朵晒干后就是一味药材“辛夷”,是我国古籍中记载的一种传统中药,可用于风寒鼻塞、头痛等症[2],此外,紫玉兰还含有多酚、萜类、木质素、色素、精油等多种天然有效成分[3-4],广泛应用于食品、医药和化妆品等领域中.多酚是植物体内重要的代谢物,植物的根、叶、皮以及生殖器官中大都含有多酚,多酚具有多种有益于人体的功效,如降低患肿瘤的风险、有效抑制自由基氧化反应、抑制炎症发作、抵抗病毒侵袭等[5],植物多酚提取已成为天然产物化学研究的热点[6].目前,植物多酚的提取主要有传统提取方式如索氏萃取、热水浸提及回流提取等,以及现代提取方式如超临界、超声辅助、微波辅助等[7].与传统提取方式能耗大、耗时长、提取率低等相比,超声辅助提取是利用超声波的空穴、机械、振动等效应,击穿和破坏细胞壁,使植物组织形成裂缝并在内部产热,以实现多酚的有效提取并保持多酚生物活性的一种提取方法[8].
目前已有一些植物叶多酚超声辅助提取的报道[9],但还没有针对紫玉兰叶中多酚提取的研究.目前,紫玉兰叶大都任其自由落叶且被作为垃圾清理,造成资源的浪费,若能对叶片中的活性成分进行合理开发,便可以大大提高紫玉兰的经济价值和应用价值.本文以紫玉兰叶为原料,先通过考察4个单因素对紫玉兰叶多酚提取率的影响,再由单因素试验结果进行4因素3水平的响应面优化设计,最终得出紫玉兰叶多酚的最佳提取条件,并对紫玉兰叶的抗氧化活性进行探讨,为紫玉兰叶多酚的提取与应用提供参考.
1 实验部分
1.1 材料与试剂
紫玉兰叶,采收于漳州市马鞍山,选择鲜嫩、大小均匀的紫玉兰叶,用水冲洗干净,烘干后用多功能粉碎机将紫玉兰叶碎裂成粉末状,过60目的筛网后,置于密封袋中备用.钨酸钠、钼酸钠、硫酸锂、没食子酸等均为市售分析纯.
1.2 试验方法
1.2.1 紫玉兰叶多酚标准曲线 多酚含量采用福林-酚法测定[10].取7个10 mL比色管,分别加入0.5 mL福林-酚试剂,继续分别加入系列体积0.1 mg/mL的没食子酸标准溶液,摇匀,静置1 min,用移液器移取1.5 mL 20%碳酸钠溶液加入比色管中,定容至10 mL并摇匀后于75 ℃水下恒温10 min,取出在765 nm波长下比色,根据测定数据作出标准曲线,得回归方程:y=0.100 5x+0.042 7,R2=0.999 3.
1.2.2 紫玉兰叶多酚的提取及含量的测定 将一定质量m(g)的紫玉兰叶粉末倒入100 mL圆底烧瓶中,加入一定体积分数的乙醇溶液及适量沸石,超声波清洗器(KQ-100TDE型,昆山市超声仪器有限公司)提前设置一定温度和时间,待到达目标温度后,将圆底烧瓶放入超声波清洗器中进行浸提一定时间.待超声结束后将圆底烧瓶取下,静置冷却,浓缩,定容至体积V(mL),按1.2.1方法进行取样,用紫外可见分光光度计(UV-200型,上海美普达仪器有限公司)测试提取液中多酚质量浓度c(mg/L)并计算多酚提取率Y(mg/g).
1.2.3 单因素试验 称取紫玉兰叶粉末1 g,加入25 mL体积分数为70%的乙醇溶液,预先将超声波清洗器温度分别设置为55、60、65、70、75 ℃,达到目标温度后进行超声处理30 min,得紫玉兰叶多酚粗提液,做3次重复,分别计算提取率.
称取紫玉兰叶粉末1 g,加入25 mL体积分数为70%的乙醇溶液,预先将温度设置为65 ℃的超声波清洗器中,分别超声10、20、30、40、50 min,得紫玉兰叶多酚粗提液,做3次重复,分别计算提取率.
称取紫玉兰叶粉末1 g,分别加入25 mL体积分数为50%、60%、70%、80%、90%的乙醇溶液,预先将温度设置为65 ℃的超声波清洗器中,超声处理30 min,得紫玉兰叶多酚粗提液,做3次重复,分别计算提取率.
称取紫玉兰叶粉末1 g,分别加入15、20、25、30、35 mL 70%的乙醇溶液,预先将温度设置为65 ℃的超声波清洗器中,超声处理30 min,得紫玉兰叶多酚粗提液,做3次重复,分别计算提取率.
1.2.4 响应面优化试验 通过分析上述单一因素的试验结果,确定影响紫玉兰叶多酚提取率4因素的最佳取值影响范围,以紫玉兰叶多酚提取率为试验设计的响应值,进行4因素3水平的响应面优化设计,对提取条件进一步优化.最后进行3组验证性试验,确定最佳工艺条件.
1.2.5 紫玉兰叶多酚的抗氧化活性测定
1) DPPH•的清除能力.在一系列比色管中分别加入不同质量浓度的紫玉兰叶多酚溶液2 mL,继续加入0.2 mmol/L的DPPH溶液(或无水乙醇)2 mL,混合并避光反应30 min,分别在517 nm处测得吸光度Ai(或Aj);以2 mL蒸馏水替代紫玉兰叶多酚与DPPH溶液混合,测得吸光度A0,同时以维生素C替代紫玉兰多酚为对照进行测定,DPPH•的清除率(R,%)由下式计算:
2) •OH的清除率能力.在一系列比色管中分别加入不同质量浓度的紫玉兰叶多酚溶液2 mL,继续加入9 mmol/L水杨酸-乙醇溶液2 mL、9 mmol/L FeSO4溶液1 mL和0.01% H2O2溶液1 mL(或蒸馏水),混合均匀后避光反应60 min,定容,后在510 nm处测定吸光度Ai(或Aj);以2 mL蒸馏水替代紫玉兰叶多酚,测得吸光度A0,同时以维生素C替代紫玉兰叶多酚为对照进行测定,•OH的清除率(Q,%)由下式计算:
2 结果与分析
2.1 单因素试验结果
2.1.1 超声温度对提取率的影响 如图1所示,不同的超声温度对紫玉兰叶多酚提取率的影响较大.当超声温度在65 ℃时达到最大值,这是因为溶剂和紫玉兰叶颗粒分子的平均动能会随着体系温度的升高而增加,增强了多酚类物质分子的扩散作用,有利于多酚物质的提取[11].但超声温度过高会破坏多酚物质中结构稳定性较差的物质,对多酚提取不利.因此最佳的超声温度为65 ℃.
2.1.2 超声时间对提取率的影响 如图2所示,不同的超声时间对紫玉兰叶多酚提取率的影响较大.当超声时间在30 min时达到最大值,这是因为一定的超声处理时间,可以促进紫玉兰叶多酚物质逐渐被浸提出来,并溶解于溶剂中,达到一定时间时,多酚基本完全浸出,所以紫玉兰叶多酚的提取率明显增加.然而,若超声处理时间过长,提取液中的多酚物质与氧气经过长时间的接触,会与氧气发生反应而减少[12].因此最佳超声时间为30 min.

图1 超声温度对提取率的影响 图2 超声时间对提取率的影响Fig.1 Effect of ultrasonic temperature on the extraction yield Fig.2 Effect of ultrasonic time on the extraction yield
2.1.3 乙醇体积分数对提取率的影响 如图3所示,不同的乙醇体积分数对紫玉兰叶多酚提取率的影响较大.当乙醇体积分数为70%时达到最大值,这是因为乙醇体积分数升高,会使得乙醇水溶液的极性减弱,更容易破坏植物体内的氢键和疏水作用力,使得多酚提取率增加[13],但当乙醇体积分数超过70%时,紫玉兰叶中大量会与多酚物质发生竞争溶出的杂质被提取出来,导致多酚溶出减少,提取率下降.因此最佳的乙醇体积分数为70%.
2.1.4 液料比对提取率的影响 如图4所示,不同的液料比对紫玉兰叶多酚提取率的影响较大.液料比在25 mL/g时达到最大值,这是因为液料比大有利于多酚物质和溶剂充分接触,溶出的多酚物质增多,但液料比过大,会导致浓缩等操作过程中多酚物质的损失[14].因此最佳的液料比为25 mL/g.
2.2 紫玉兰叶多酚提取的响应面优化试验
2.2.1 响应面因素及水平 根据超声温度、超声时间、乙醇体积分数和液料比4个单因素的试验结果,确定影响紫玉兰叶多酚提取率的因素取值范围如表1所示.以紫玉兰叶中多酚的提取率为响应值,设计Box-Behnken试验,共确定29个试验,其中5个中心点试验和24个析因试验,结果见表2,方差分析结果见表3.
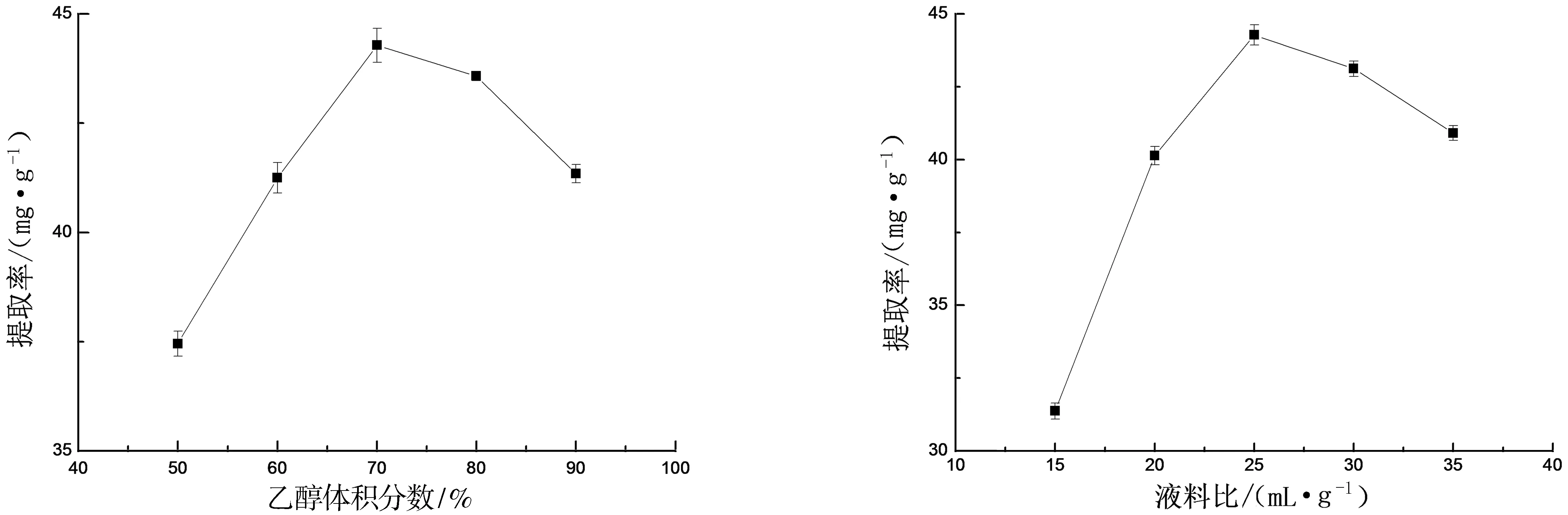
图3 乙醇体积分数对提取率的影响 图4 液料比对提取率的影响 Fig.3 Effect of ethanol concentration on the extraction yield Fig.4 Effect of liquid-to-material ratio on the extraction yield
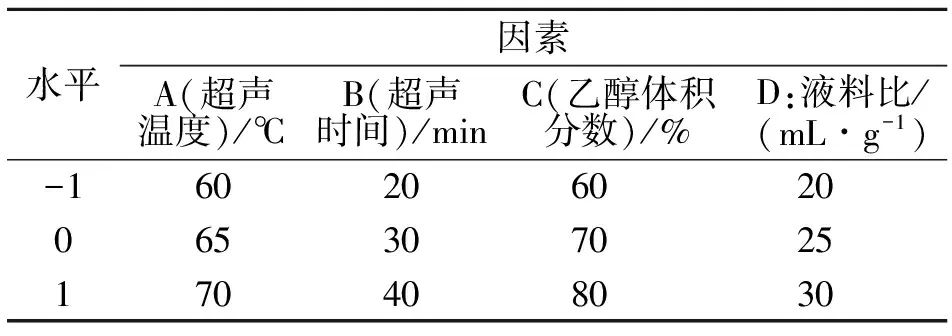
表1 Box-Behnken试验设计Tab.1 Design of Box-Behnken experiment
对表2中的数据进行拟合,得到超声波辅助提取紫玉兰叶多酚提取率Y与各考察变量的二次多项回归模型方程:
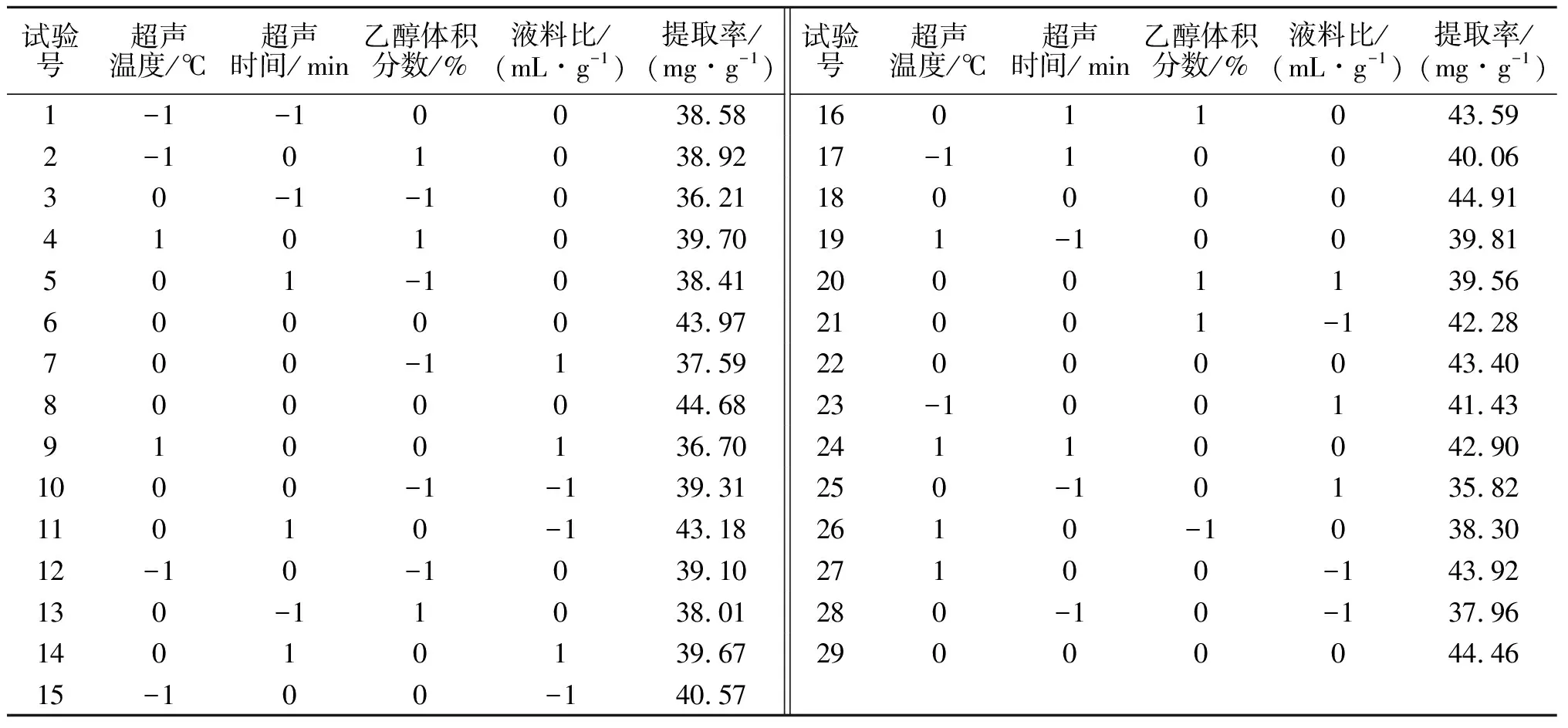
表2 响应面试验设计及测定Tab.2 Design and results of response surface methodology
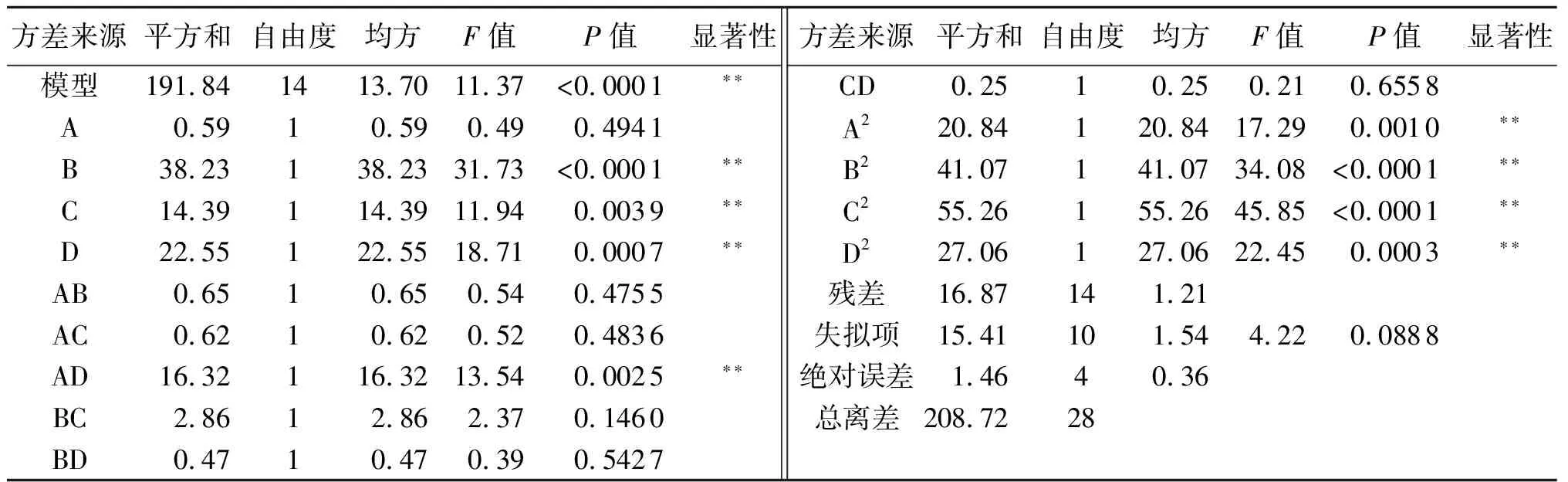
表3 方差分析Tab.3 Results of analysis of variance
Y=44.28+0.22A+1.79B+1.10C-1.37D+0.40AB+0.40AC-2.02AD+
0.85BC-0.34BD-0.25CD-1.79A2-2.52B2-2.92C2-2.04D2.
由表3可知,失拟项P=0.088 8>0.05,说明失拟项差异不显著.回归模型的F=11.37,P=0.000 1<0.01,表明模型显著性极高.同时,该方程相关系数R2=0.919 2,说明此回归模型可用来分析91.92%的紫玉兰叶中多酚提取率的变化,且拟合状况良好,可以用来对紫玉兰叶中多酚提取率进行分析、预测.通过显著性检验可知,一次项B、C、D,二次项A2、B2、C2、D2,交互项AD的P值都小于0.01,说明这几项对紫玉兰叶多酚提取率影响极显著,其余各项对紫玉兰叶多酚提取率影响不显著,因此,试验因素并不是通过简单的线性关系影响紫玉兰叶中多酚的提取率.F值越大,该因素对多酚提取的影响越显著,因此通过表3中F值大小比较,可判断出影响紫玉兰叶多酚提取的顺序为:超声时间(B)>液料比(D)>乙醇体积分数(C)>超声温度(A).
2.2.2 响应曲面图分析 由图5所示,当超声温度一定时,紫玉兰叶多酚提取率先升高后降低;同理,当超声时间一定时,超声温度的影响趋势亦是如此,提取率先升高后降低,从响应面的陡峭和等高线的形状中,可知二者的交互作用不显著.

(a) 超声温度与超声时间的响应面图 (b) 超声温度与超声时间的等高线图图5 超声温度与超声时间的交互作用Fig.5 Interaction between ultrasonic temperature and time
由图6所示,当超声温度为一定时,紫玉兰叶多酚提取率先升高后降低;同理,当乙醇体积分数一定时,超声温度的影响趋势亦是如此,提取率先升高后降低,从响应面的陡峭和等高线的形状中,可知二者的交互作用不显著.

(a) 超声温度与乙醇体积分数的响应面图 (b) 超声温度与乙醇体积分数的等高线图图6 超声温度与乙醇体积分数的交互作用Fig.6 Interaction between ultrasonic temperature and ethanol concentration
由图7所示,当超声温度为一定时,紫玉兰叶多酚提取率先升高后降低;同理,当液料比一定时,超声温度的影响趋势亦是如此,提取率先升高后降低,从响应面的陡峭和等高线的形状中,可知二者的交互作用极显著.
由图8所示,当超声时间为一定时,紫玉兰叶多酚提取率先升高后降低;同理,当乙醇体积分数一定时,超声时间的影响趋势亦是如此,提取率先升高后降低,从响应面的陡峭和等高线的形状中,可知二者的交互作用不显著.
由图9所示,当超声时间为一定时,紫玉兰叶多酚提取率先升高后降低;同理,当液料比一定时,超声时间的影响趋势亦是如此,提取率先升高后降低,从响应面的陡峭和等高线的形状中,可知二者的交互作用不显著.
由图10所示,当乙醇体积分数为一定值时,紫玉兰叶多酚提取率先升高后降低;同理,当液料比一定时,乙醇体积分数的影响趋势亦是如此,提取率先升高后降低,从响应面的陡峭和等高线的形状中,可知二者的交互作用不显著.

(a) 超声温度与液料比的响应面图 (b) 超声温度与液料比的等高线图图7 超声温度与液料比的交互作用Fig.7 Interaction between ultrasonic temperature and liquid-to-material ratio

(a) 超声时间与乙醇体积分数的响应面图 (b) 超声时间与乙醇体积分数的等高线图图8 超声时间与乙醇体积分数的交互作用Fig.8 Interaction between ultrasound time and ethanol concentration

(a) 超声时间与液料比的响应面图 (b) 超声温度与液料比的等高线图图9 超声时间与液料比的交互作用Fig.9 Interaction between ultrasonic time and liquid-to-material ratio

(a) 乙醇体积分数与液料比的响应面图 (b) 乙醇体积分数与液料比的等高线图图10 乙醇体积分数与液料比的交互作用Fig.10 Interaction between ethanol concentration and liquid-to-material ratio
2.3 最佳工艺条件的确定与验证
根据Design-Expert 8.0.6b软件计算得到最佳的参数为超声温度67.62 ℃、超声时间34.96 min、乙醇体积分数73.23%和液料比21.72 mL/g,其理论上的紫玉兰叶多酚提取率为45.41 mg/g.考虑到实验室实际条件,将条件取整为超声温度68 ℃、超声时间35 min、乙醇体积分数73%、液料比22 mL/g.进行3组验证性试验,计算平均值得出紫玉兰叶多酚提取率为44.76 mg/g,与理论上的提取率相对误差只有1.43%,证明了该模型可应用于紫玉兰叶多酚的提取.
2.4 紫玉兰叶多酚的抗氧化活性分析
2.4.1 多酚对DPPH•的作用效果 通过考察紫玉兰叶多酚对DPPH•的作用效果来确定其抗氧化能力,如图11所示.从图11中可知,紫玉兰叶多酚对DPPH•的作用效果随着紫玉兰叶多酚质量浓度的增加而增大,而当质量浓度大于120 mg/L时,对DPPH•的清除率增加不再明显.紫玉兰叶多酚对DPPH•清除率的半抑制浓度(IC50)为57.65 mg/L,当紫玉兰叶多酚质量浓度为100 mg/L时,对DPPH•的清除率达到77.25%,为维生素C清除率的94.28%,说明紫玉兰叶多酚能较好地对DPPH•进行清除,具有一定的抗氧化活性.
2.4.2 多酚对•OH的清除作用 通过考察紫玉兰叶多酚对•OH的作用效果来确定其抗氧化能力,如图12所示.从图12中可知,紫玉兰叶多酚对•OH的作用效果随着紫玉兰叶多酚质量浓度的增加而增大,而当质量浓度大于300 mg/L时,对•OH的清除率增加不再明显.紫玉兰叶多酚对•OH清除率的IC50为114.26 mg/L,当紫玉兰叶多酚质量浓度为250 mg/L时,对•OH的清除率达到80.53%,为维生素C清除率的93.28%,说明紫玉兰叶多酚能较好地对•OH进行清除,具有一定的抗氧化活性.

图11 多酚对DPPH•的清除作用 图12 多酚对•OH的清除作用Fig.11 Scavenging effect of polyphenols on DPPH• Fig.12 Scavenging effect of polyphenols on •OH
3 结论
以紫玉兰叶为原料,考察了4个单因素对紫玉兰叶多酚提取率的影响,再由单因素试验结果进行4因素3水平的响应面优化设计,最终得出紫玉兰叶多酚的最佳提取条件为:超声温度为68 ℃、超声时间为35 min、乙醇体积分数为73%、液料比为22 mL/g.在此工艺下得到的紫玉兰叶多酚提取率为44.76 mg/g,与理论上的提取率45.41 mg/g之间的相对误差只有1.43%,说明了该回归模型合理,能较可靠地预测紫玉兰叶多酚的提取率.紫玉兰叶多酚对DPPH•和•OH均具有一定的清除能力,其IC50分别为57.65 mg/L和114.26 mg/L,该研究为紫玉兰叶多酚及其资源的开发与利用提供了方向.
