茶渣碱提取物中的蛋白质性质分析
2022-10-24黄贞胜
魏 汉,刘 派,黄贞胜,张 晨*
(1 福州大学生物科学与工程学院 福州 350108 2 福建省食品生物技术创新工程技术研究中心 福州 350108 3 福建大昌生物科技实业有限公司 福州 350108)
随着社会节奏的加快,人们对快消茶饮料的需求也越来越旺盛,茶叶的消费模式从家庭式消费逐渐向大型茶饮料企业的采买转变[1]。仅两家福建省速溶茶加工企业,每年茶叶消费量就达15 万t,需要处理的茶渣量近10 万t。这些茶渣大多直接用于堆肥或焚烧,而茶渣中含有20%~30%的蛋白质[2],易产生富营养污染或形成NO2等有害气体[3]。深入研究茶渣蛋白质的应用价值,可减少副产物的污染,实现现代食品工业的绿色可持续发展。
蛋白质产品在食品工业中的应用主要体现在其具有溶解性、起泡性、乳化性等理化性质,以及抑菌性、抗氧化性等生理活性。茶蛋白质主要包括核酮糖-1,5-二磷酸羧化酶、膜蛋白、多酚氧化酶等[4],由于其有较好的理化性质与生理活性[5-6],可作为食品蛋白质原料。本课题组前期研究表明:采用碱法获得的茶渣蛋白质性价比最高,提取率高达95%,且每吨蛋白质生产成本较低[2]。然而,茶渣蛋白质在碱性条件下可能会与多酚、糖类物质发生反应,生成褐色复合物,改变其物质组成。分析碱法获得的茶渣蛋白质的组成、分子质量分布和理化性质,可揭示其理化性质变化及生理活性形成的原因。
为提高茶渣蛋白质的起泡性、乳化性或抗氧化性,可采用酶(如胃蛋白酶或碳水化合物复合酶) 对碱法获得的茶渣蛋白质提取物的组成和结构进行修饰。胃蛋白酶主要通过断裂茶渣蛋白质上芳香族氨基酸或酸性氨基酸的氨基所组成的肽键,将茶渣蛋白质分解为多肽或氨基酸,从而可能释放与多肽或氨基酸相连的糖类物质或多酚,增加茶渣蛋白质的起泡性与乳化性[7]。碳水化合物复合酶,如ViscozymeRL,可通过断裂糖苷键,将茶渣蛋白质中的糖类物质分解为游离态的小分子寡糖或单糖,同时可能释放部分与寡糖或单糖结合的多酚,促进蛋白质的分离,提高茶渣蛋白质的抗氧化性[8]。
本文以绿茶渣为原料,通过碱提获得茶渣蛋白质提取物,测定其组分、分子质量分布及各组分中主要成分,以及在不同pH 值下的溶解性、分散稳定性、起泡性、乳化性。分析茶渣蛋白质提取物的理化性质、抑菌性以及与多酚含量的相关性。采用碳水化合物复合酶和胃蛋白酶水解茶渣蛋白质提取物,以改进其产品的起泡性、乳化性和抗氧化性,为茶渣蛋白质的开发与应用提供理论依据。
1 材料与方法
1.1 材料与试剂
茶渣,由福建大闽食品有限公司提供。绿茶叶经85 ℃的热水抽提45 min 后,过滤获得的茶渣于60 ℃烘干制成绿茶渣样品。
Viscozyme®L,美国Sigma 公司;胃蛋白酶、茶多酚,上海源叶生物科技有限公司;其它分析纯试剂均为国产分析纯。
1.2 仪器与设备
CF16RXII 高速离心机,日本HITACHI 公司;LXJ-IIB 低速离心机,上海安亭科学仪器厂;TE601-L 分析天平,德国赛多利斯公司;HH-6 恒温水浴锅,金坛市新航仪器厂;TNG-T98 真空干燥仪,太仓市华美生化仪器厂;BR415 紫外可见分光光度计,上海一恒科学仪器有限公司;WKB-100-4 恒温振荡器,上海净信实业发展有限公司;MS-H280-Pro 加热磁力搅拌器,中国大龙公司;OMNI Zeta 电位和粒径分析仪,美国Brookhaven仪器公司;HR-6B 均质机,上海沪析实业有限公司;6890 N 气相色谱,美国Agilent 科技有限公司。
1.3 样品处理
1.3.1 茶渣蛋白质的提取 参考Zhang 等[2]的方法,将10 g 茶渣与200 mL 氢氧化钠溶液(0.4 mol/L)混合,于加热磁力搅拌器(95 ℃,4 h)搅拌反应。反应结束后离心(13 952×g,10 min),分离获得上清液和沉淀。使用100 mL 去离子水清洗沉淀,充分混合10 min 后离心(13 952×g,10 min),分离获得沉淀和上清液。重复清洗沉淀3 次,离心获得上清液,并将所有的上清液混合。使用盐酸溶液(1 mol/L)调上清液至pH 3.5,静置10 min 后,离心(13 952×g,10 min)获得蛋白质沉淀。加入20 mL去离子水于蛋白质沉淀中不断搅拌,然后缓慢加入氢氧化钠溶液(0.1 mol/L)将酸沉后的蛋白质复溶至溶液pH 值为7,冷冻干燥后得到茶渣蛋白质干燥样品。
1.3.2 茶渣蛋白质的水解 水解条件分别如下:
1) 胃蛋白酶水解 以磷酸调PBS 缓冲液(0.05 mol/L,pH 7.0)至pH 3.5,使用其配置质量浓度为10 mg/mL 的茶渣蛋白质溶液,并加入20 U 胃蛋白酶。
2) 碳水化合物复合酶水解 以磷酸调PBS缓冲液(0.05 mol/L,pH 7.0)至pH 4.0,使用其配制质量浓度为10 mg/mL 的茶渣蛋白质溶液,并加入10 U 的碳水化合物复合酶(Viscozyme®L)。
分别取两种混合液于恒温振荡仪 (1 000 r/min,35 ℃,20 h)上水解。水解结束后,水浴灭活(100 ℃,10 min)。反应后将样品冷却至室温,使用氢氧化钠溶液(0.1 mol/L)调各酶解液至pH 7,并将蛋白质溶液浓度稀释至5 mg/mL。冷冻干燥后得到茶渣蛋白质干燥样品。
1.3.3 透析去除游离多酚 配制质量浓度为10 mg/mL 的茶渣蛋白质溶液,将该茶渣蛋白质溶液放入3 ku 透析袋中,在密闭条件下透析24 h(中间换水3 次),透析结束将袋内溶液冷冻干燥。
1.4 组分测定
1.4.1 蛋白质测定 采用考马斯亮蓝法[9]于波长595 nm 处测定样品吸光度,并以牛血清白蛋白溶液(100 μg/mL)作为标准样品计算样品的蛋白质含量。
1.4.2 多酚测定 采用酒石酸亚铁法[10]于波长540 nm 处测定样品吸光度,并以茶多酚溶液(1 mg/mL)作为标准样品计算样品的蛋白质含量。
1.4.3 灰分测定 采用《食品中灰分的测定方法》GB 5009.4-2016[11],以W(灰分)/W(蛋白质干重)计算蛋白质灰分含量。
1.4.4 糖测定 参考刘路[12]的方法,称取30.0 mg茶渣蛋白质提取物于干净的具塞试管中,加入2.0 mL 三氟乙酸溶液(2 mol/L),密封振荡均匀后水解(120 ℃,5 h)。反应结束后,利用氮吹仪吹干(水浴温度:70 ℃),重复3~4 次。样品用色谱级三氯甲烷溶解,经0.22 μm 有机微孔滤膜,注入色谱进样瓶,进行气相色谱分析。
气相色谱操作条件的设置参照Yu 等[13]的研究。检测器:氢火焰离子化检测器;色谱柱:RTX-1701 石英毛细管,0.25 μm×30.0 m;程序升温:180~220 ℃(5 ℃/min),220 ℃(5 min),220~280 ℃(10 ℃/min);载气:氮气;进样量:1.0 μL。
1.5 理化指标测定
1.5.1 茶渣蛋白质不同pH 值下的溶解性 参考田元勇等[14]的方法,配置pH 值为7.0 的PBS 缓冲液(0.05 mol/L),分别用磷酸调至不同pH 值(2.0,3.0,4.0,5.0,6.0,7.0)。称取10 mg 茶渣蛋白质,分别加入不同pH 值的缓冲液2 mL,混匀后离心(13 952×g,10 min),取上清测定蛋白含量。以V(上清液总体积)×C(上清液蛋白含量)/V(总溶液体积)计算蛋白质溶解度。
1.5.2 Zeta 电位测定 通过Zeta 电位仪的测定分析茶渣蛋白质的分散稳定性: 配置质量浓度为1 mg/mL 的茶渣蛋白质溶液于Zeta 电位测定仪中测定电位。
1.5.3 粒径 配置pH 值为7.0 的PBS 缓冲液(0.05 mol/L),并以磷酸调PBS 缓冲液至pH 5.0。分别使用pH 5.0 和pH 7.0 的PBS 缓冲液配置质量浓度为10 mg/mL 的茶渣蛋白质溶液,通过粒径分析仪测定样品的粒度分布和平均流体动力学直径。
1.5.4 起泡性及乳化性 参考李永富[15]的方法。
1) 起泡性 取2 mL 茶渣蛋白质溶液(10 mg/mL)于均质机(10 000 r/min,2 min)搅打后,测定泡沫总体积。以V(起泡体积)/W(蛋白质)计算蛋白质起泡能力。
2) 乳化性 取2 mL 茶渣蛋白质溶液(10 mg/mL)与2 mL 大豆油混合,于均质机(10 000 r/min,2 min)搅打后,离心(3 240×g,10 min),测定乳化层的体积。以V(乳化层体积)/W(蛋白质)计算蛋白质乳化能力。
1.5.5 抑菌性 参考程慧青[16]的方法,选用在7℃以下时生长优势明显的嗜冷菌及在常温时生长优势明显的假单胞菌测定茶渣蛋白质的抑菌性。
1) 抑菌圈试验 菌液的制备:分别挑嗜单胞菌菌落和嗜冷菌菌落接种至100 mL 液体培养基(蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH 7.8),摇床培养(假单胞菌25 ℃,嗜冷菌5 ℃,200 r/min)过夜。
取20 mL 培养基(蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,琼脂粉20 g/L,pH 7.8)于已灭菌平板,水平静置凝固,接种0.1 mL 菌液均匀涂布。使用打孔器在培养基上打孔后,取0.1 mL 茶渣蛋白质溶液(10 mg/mL)注入孔中,放入培养箱中培养(假单胞菌25 ℃,嗜冷菌5 ℃,200 r/min,12 h)。以1.0 mL 蒸馏水代替样品作为空白对照。
2) 比浊法测定抑菌率 菌液的制备:分别取100 mL 假单胞菌及嗜冷菌培养基(牛肉膏3 g/L,蛋白胨10 g/L,NaCl 10 g/L,琼脂粉20 g/L,pH 7.8),于培养箱培养(假单胞菌25 ℃,嗜冷菌5 ℃,220 r/min,7 h)。培养结束后,取1 mL 培养液稀释至OD600为0.5,再将1 mL 稀释液用无菌水稀释至10 mL。
取0.1 mL 茶渣蛋白质溶液(10 mg/mL),加入1 mL 菌液,放入培养箱中培养(假单胞菌25 ℃,嗜冷菌5 ℃,200 r/min,7 h),于波长600 nm 处测定混合液吸光度。以1.0 mL 蒸馏水代替样品作为空白对照。
1.5.6 抗氧化性 参考黄梦姣[17]的方法,选用DPPH·清除能力、ABTS·+清除能力和铁离子还原力测定茶渣蛋白质抗氧化性。
1) 1,1-二苯基-2-三硝基苯肼自由基(DPPH·) 清除能力 取不同体积(100,200,300,400,500 μL)样品溶液(1 mg/mL)与无水乙醇配制成总体积为500 μL 的溶液,再向溶液中加入1 mL DPPH·乙醇溶液(0.1 mmol/L)并混合均匀,避光静置20 min 后,于517 nm 处测定其吸光值(Ai);在相同条件下,取不同浓度的样品溶液与无水乙醇配制成总体积为1.5 mL 的溶液作为空白,测定其吸光值 (Aj);以0.5 mL 乙醇与1 mL DPPH·乙醇溶液(0.1 mmol/L)混合作为对照,测定其吸光值 (Ac)。以不同体积(200,400,600,800 μL,1 mL) 丁基羟基茴香醚 (Butylated hydroxy anisol,BHA)溶液(0.05 mg/mL)代替样品作为阳性对照。
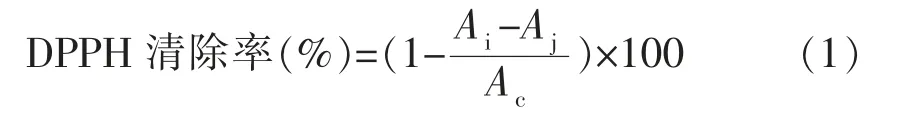
式中:Ai——测定样的吸光值;Aj——标准样的吸光值;Ac——对照样的吸光值。
2) 2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸自由基(ABTS·+)清除能力 ABTS·+自由基工作液:取ABTS 二铵盐储备液(7.4 mmol/L)与等体积无水乙醇混合,避光室温静置12 h,以PBS 缓冲液(pH 7.4)将混合液稀释至吸光度为0.70±0.02。取不同体积(40,80,120,160,200 μL)的样品溶液(1 mg/mL)与无水乙醇配制成总体积为200 μL 的溶液,再向溶液中加入800 μL ABTS·+自由基溶液并混合均匀,静置10 min 后,于734 nm 处测定其吸光值(Ai),以0.2 mL 乙醇与0.8 mL DPPH·乙醇溶液(0.1 mmol/L)混合作为空白,于734 nm 处测定其吸光值 (Ac)。以不同体积(200,400,600,800 μL,1 mL)BHA 溶液(0.1 mg/mL)代替样品作为阳性对照。

式中:Ai——测定样的吸光值;Ac——空白样的吸光值。
3) 铁离子还原力(FRAP 抗氧化能力) 取不同体积 (0.5,1.0,1.5,2.0,2.5 mL) 的样品溶液(1 mg/mL),加入2.5 mL PBS 缓冲液(0.2 mol/L,pH 6.6)和2.5 mL 铁氰化钾溶液(10 mg/mL),混合均匀后水浴(50 0,20 min)。取出快速冷却后,再加入2.5 mL 三氯乙酸溶液(0.1 mL/mL),离心(3 600×g,10 min)。取上清液加入2.5 mL 蒸馏水和0.5 mL 三氯化铁溶液(1 mg/mL)并混合均匀,静置10 min 后,于700 nm 处测定其吸光值。以不同体积(200,400,600,800 μL,1 mL)BHA 溶液 (0.5 mg/mL)代替样品作为阳性对照。
1.6 数据处理
以3 次重复试验每次同时做平行试验所得的数据为结果,用平均值±标准差表示。采用Microsoft excel 2010 软件进行数据统计与分析。
2 结果与讨论
2.1 茶渣蛋白质提取物的组分与分子质量分布
对碱法提取的茶渣蛋白质提取物中的蛋白质、总糖、多酚、灰分进行测定,结果如图1a 所示。在茶渣蛋白质提取物中,蛋白质含量最高,达到了52%。提取物中总糖含量占18%,其中半乳糖醛酸含量最高,达9.0%。这些半乳糖醛酸主要是来源于茶渣细胞壁中果胶[18]。提取物中未测定的成分占16%,这些成分可能主要来源于茶渣中多酚氧化形成的醌类化合物、脂质(蜡、有机酸)和木质素[19]及木质素被降解后的产物[20]。
采用SEC 色谱检测茶渣蛋白质提取物的分子质量分布,结果如图1b。茶渣蛋白质依据分子质量分布主要分为3 个组分(F1、F2、F3),其分子质量范围分别为F1>100 ku,100 ku>F2>3 ku,F3<3 ku。根据图1b 中虚线划分的3 个区域进行样品收集,并测定各组分的蛋白质含量,其中,F1 样的蛋白质含量最高,达到了83.2%,F2 样蛋白质含量为56.3%,F3 样蛋白质含量仅为32.3%。经推测,提取物中的F1 样蛋白质主要来源于细胞膜内的大分子二磷酸核酮糖羧化酶 (RuBisCO)[21],F2样蛋白质主要来源于细胞壁表面的膜蛋白、细胞膜内的大分子糖蛋白以及各种生物酶[22],F3 样蛋白质主要来源于细胞膜内小分子质量的多肽、氨基酸等物质[23]。

图1 茶渣蛋白质提取物Fig.1 Tea residue protein product
2.2 茶渣蛋白质提取物的理化性质和抑菌性
2.2.1 茶渣蛋白质提取物的溶解度与分散稳定性 通过测定茶渣蛋白质提取物在不同pH 值下的溶解度、Zeta 电位和粒径分布,探究了其溶解度与分散稳定性,结果如图2所示。在pH 值为7 时,茶渣蛋白质提取物具有较好的溶解度与分散稳定性。由图2a 可知,随着pH 值升高,茶渣蛋白质的Zeta 电位由正电位变为负电位,且负电位时的绝对值不断升高。当pH=7 时,Zeta 电位值为-31.89 mV,此时溶液应具有较好的稳定性,蛋白质不易发生沉淀。在Zeta 电位为0 mV 时,茶渣蛋白质pH 值为3.6,即为等电点pI。同时,随着溶液pH值升高,茶渣蛋白质的溶解度呈现先降低后升高的趋势,在pH 值为7 时,茶渣蛋白质完全溶解,溶解度大于5 mg/mL。由图2b 可知,随着pH 值升高,茶渣蛋白质粒径逐渐减小,且在pH 7 时茶渣蛋白质溶液均匀分布。在pH 值为7 时,茶渣蛋白质粒径的4 个峰分别出现在4,9,40 和180 nm处,而当pH 值为5 时,粒径的4 nm 和9 nm 两处峰消失,40 nm 处的峰增大,并右移至55 nm 附近。当pH 值继续降低后,由于溶液中蛋白颗粒过大而沉淀。这是因为蛋白分子以两性离子形式存在,当pH 值靠近pI 时,分子表面所带同性电荷减少,静电排斥作用减小,导致体系中蛋白分子倾向于相互聚集,使溶液溶解度和稳定性降低[24]。

图2 茶渣蛋白质提取物不同pH 值下的溶解度和分散稳定性Fig.2 Solubility and dispersion stability of tea residue protein product at different pH
2.2.2 茶渣蛋白质提取物的起泡性和乳化性 通过测定茶渣蛋白质提取物在不同pH 值下的起泡性与乳化性,结果如图3所示。随着pH 值增大,茶渣蛋白质的起泡性与乳化性均呈现升高的趋势,其中起泡性快速升高,而乳化性升高缓慢。茶渣蛋白质在pH 4 时,起泡性较低,为13.0 mL/g,当在pH 12 时,起泡性为75.0 mL/g。这可能是因为在等电点附近时,蛋白分子所带同性电荷最少,由于静电排斥作用减少,蛋白粒子易发生聚集和絮凝,使得蛋白颗粒表面无法形成水化层,从而导致起泡性最弱;在偏离等电点时,蛋白颗粒间静电斥力作用增强,分子向界面扩散能力增强,保持其形成蛋白膜性状的能力增强[25]。茶渣蛋白质在pH 4 时,乳化性为33.5 mL/g,当在pH 12 时,乳化性为45.7 mL/g。这是因为,pH 值的升高,导致蛋白质颗粒尺寸变小,蛋白质基团的亲水能力增强,同时,蛋白质结构展开,原本包裹在蛋白质分子内部的疏水基团暴露出来,增强了其表面亲油活性[26]。然而,可能因为蛋白质分子内部疏水基团较少,从而导致蛋白质乳化性未显著提高。

图3 不同pH 值下茶渣蛋白质提取物的起泡性和乳化性Fig.3 Foamability and emulsification capacity of tea residue protein product at different pH
2.2.3 茶渣蛋白质提取物的抑菌性与其多酚含量的相关性 通过测定茶渣蛋白质提取物及其脱酚处理产物对嗜冷菌和假单胞菌的抑菌圈及抑菌率,其抑菌效果如图4所示。结果表明,茶渣蛋白质提取物及其脱酚处理产物对假单胞菌的抑菌效果强于嗜冷菌。随着物质浓度的增加,茶渣蛋白质提取物及其脱酚处理产物抑菌效果不断增强,且茶渣蛋白质提取物的抑菌效果均较其脱酚处理产物更佳,该抑菌效果多为提取物中的多酚提供。由图4a 可知,在接种假单胞菌的培养基中,与空白对照相比,茶渣蛋白质提取物及其脱酚处理产物均呈现出明显的抑菌圈,且茶渣蛋白质提取物的抑菌圈范围较其脱酚处理产物大。在接种嗜冷菌的培养基中,与空白对照相比,茶渣蛋白质提取物的抑菌圈范围较小,其脱酚处理产物则没有出现明显的抑菌圈(见图4a)。这可能是因为茶渣蛋白质提取物中的多酚具有较强的抑制假单胞菌活性[27]。由图4b、4c 可知,随着茶渣蛋白质提取物及其脱酚处理产物浓度的增大,抑菌率均呈现上升趋势。在质量浓度为80 mg/mL 时,茶渣蛋白质提取物对嗜冷菌和假单胞菌的抑菌率分别可达98%和93%,具有较好的抑菌活性,而茶渣蛋白质脱酚处理产物则分别只有39%和50%,这表明茶渣蛋白质的多酚物质含量的增大可更为有效地抑制腐败菌活性,且茶渣蛋白质提取物的抑菌率较其脱酚处理产物抑菌率高。
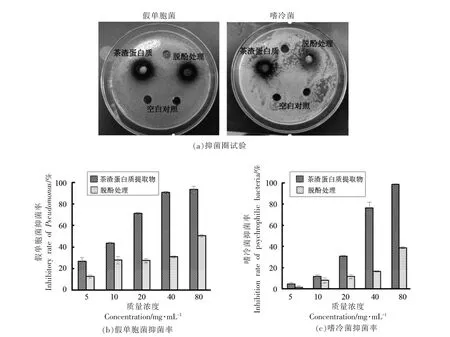
图4 茶渣蛋白质提取物及其脱酚产物对两株腐败菌的抑菌圈试验及抑菌率Fig.4 Inhibition zone experiment and inhibition rate of tea residue protein product and its dialysis products to two putrefactive bacteria
2.3 酶解对茶渣蛋白质提取物性质的影响
2.3.1 茶渣蛋白质提取物及其酶解产物的起泡性和乳化性
在不同体系的工业应用中,蛋白质溶液常以中性形式存在,因此测定pH 7 下茶渣蛋白质提取物及其酶解产物的起泡性和乳化性,结果如图5所示。经胃蛋白酶水解后,茶渣蛋白质提取物的起泡性与乳化性均有较大幅度的提升,而经碳水化合物复合酶水解后,其起泡性略微升高,乳化性下降,经脱酚处理后,其乳化性与起泡性基本无变化。

图5 pH 7 下茶渣蛋白质提取物及其酶解产物的起泡性和乳化性Fig.5 Foamability and emulsification capacity of tea residue protein extract and its enzymatic hydrolysis products at pH 7
与茶渣蛋白质提取物起泡性 (40.2 mL/g)相比,经胃蛋白酶水解的茶渣蛋白质提取物的起泡性(66.7 mL/g)提升了近2 倍,这可能是因为胃蛋白酶断裂蛋白质的芳香族氨基酸或酸性氨基酸上的肽键,从而增加蛋白质的表面疏水性,使蛋白质分子在界面大量聚集,提高了蛋白的起泡能力[28]。经碳水化合物复合酶水解的茶渣蛋白质提取物的起泡性(52.4 mL/g)略高于茶渣蛋白质提取物的起泡性,原因可能是碳水化合物复合酶通过水解糖类物质打破蛋白复合物的交联状态,降低蛋白复合物的亲水基团,从而增加形成的泡沫数量,提高了蛋白质的起泡性[29]。经脱酚处理后,茶渣蛋白质提取物的起泡性基本无影响。
与茶渣蛋白质提取物乳化性 (35.8 mL/g)相比,胃蛋白酶水解的茶渣蛋白质提取物的乳化性(100.0 mL/g)有显著的提高,这可能是因为胃蛋白酶通过断裂大分子复合物中蛋白质的芳香族氨基酸或酸性氨基酸的氨基所组成的肽键为小分子蛋白-多酚复合物、蛋白-多糖复合物、多肽和氨基酸等[30],使得多酚的亲水性酚羟基通过增加体系的溶解度来帮助提高乳化性[31]。碳水化合物复合酶水解的茶渣蛋白质提取物的乳化性(12.0 mL/g)低于茶渣蛋白质提取物的乳化性,原因可能是碳水化合物复合酶在水解蛋白复合物时,其中大量游离态多酚、单糖等小分子亲水性物质被透析释放,导致乳化性降低[29]。茶渣蛋白质提取物经脱酚处理后,其乳化性基本无变化。经脱酚处理后,茶渣蛋白质提取物的乳化性基本无影响。
2.3.2 茶渣蛋白质提取物及其酶解产物的抗氧化性 通过测定DPPH 清除率、ABTS 的清除率和铁离子还原能力,分析几种酶解方法对茶渣蛋白质提取物抗氧化性的影响,结果如图6所示。茶渣蛋白质提取物及其酶解产物的抗氧化性均与样品浓度呈正相关。经碳水化合物复合酶水解后,茶渣蛋白质提取物抗氧化性显著提高,而经胃蛋白酶水解的茶渣蛋白质提取物的抗氧化性变化较小,但均低于阳性对照BHA 的抗氧化性(Butylated hydroxy anisol,丁基羟基茴香醚)。由图6a、6b、6c 可知,经碳水化合物复合酶水解后的茶渣蛋白质提取物显示出较强的DPPH 清除能力、ABTS 的清除能力及铁原子还原力,仅低于阳性对照BHA。计算可得,碳水化合物复合酶水解的茶渣蛋白质提取物清除DPPH 的IC50为0.18 mg/mL,清除ABTS的IC50为0.07 mg/mL,在样品质量浓度为2.5 mg/mL 时,其FRAP 值为2.1 mmol/L Fe2+。经胃蛋白酶水解后,茶渣蛋白质提取物的DPPH 清除能力、ABTS 清除能力及铁原子还原力的变化较小。计算可得,胃蛋白酶水解的茶渣蛋白质提取物清除DPPH 的IC50为0.21 mg/mL,清除ABTS 的IC50为0.09 mg/mL,在样品质量浓度为2.5 mg/mL 时,其FRAP 值为2.0 mmol/L Fe2+。这可能是因为,茶渣蛋白质提取物对DPPH 清除率、ABTS 的清除率和铁离子还原能力与多酚的酚羟基及蛋白质上的羟基等相关。碳水化合物复合酶水解了复合物中呈交联状态的碳水化合物,释放了大量连接碳水化合物的多酚[29],而胃蛋白酶通过水解蛋白质为具有暴露羟基的多肽或氨基酸在一定程度上提高了茶渣蛋白质的抗氧化性[32]。

图6 茶渣蛋白质提取物及其酶解产物的抗氧化性Fig.6 Antioxidant activity of protein extract from tea residue and its hydrolysates
3 结论
茶渣碱提取物中蛋白质含量为52%,可主要分为3 个组分(F1>100 ku,100 ku>F2>3 ku,F3<3 ku)。其中,F1 样的蛋白质含量达83.2%,具有较高的商业价值。茶渣蛋白质等电点 (pI) 为3.6,当pH>7 时,蛋白质具有良好的溶解度和分散稳定性,可较好地应用于食品工业。在茶渣蛋白质提取物质量浓度为80 mg/mL 时,茶渣蛋白质提取物对嗜冷菌和假单胞菌的抑菌率分别可达98%和93%,该抑菌效果多为提取物中的多酚提供。采用碳水化合物复合酶ViscozymeRL 和胃蛋白酶对茶渣蛋白质提取物进行水解,较茶渣蛋白质提取物相比,经胃蛋白酶水解的起泡性(58.3 mL/g)提升了近1 倍,乳化性(100.0 mL/g)提升了近3 倍。经碳水化合物复合酶ViscozymeRL 水解的茶渣蛋白质提取物的抗氧化性提升了约0.5 倍,其清除DPPH 的IC50为0.18 mg/mL,清除ABTS 的IC50为0.07 mg/mL,其在提取物质量浓度为2.5 mg/mL 时的FRAP 值为2.1 mmol/L Fe2+。茶渣蛋白质提取物的性质分析与进一步优化改性,为茶渣资源的合理利用和深度开发提供必要的理论保障。
