1-MCP联合乙烯吸附剂处理对黄桃果实冷害与糖代谢的影响
2022-10-24董欣瑞袁楚珊张菊华苏东林朱向荣
董欣瑞,张 珮,袁楚珊,刘 伟,张菊华,苏东林,朱向荣
(1 湖南大学研究生院隆平分院 长沙 410125 2 湖南省农业科学院农产品加工研究所 长沙 410125 3 果蔬贮藏加工与质量安全湖南省重点实验室 长沙 410125 4 果蔬加工与质量安全湖南省国际联合实验室 长沙 410125)
黄桃系蔷薇科桃属植物果实,因呈金黄色而得名,色泽饱和度极高,肉质细嫩、有韧性,口感较脆,完全成熟后肉质软化,甜酸平衡,含有较多营养素且质量较好,广受消费者青睐。黄桃极易受低温环境影响而引发冷害,不耐贮藏,主要表现为果肉纤维化、凝胶化[1]。随着冷害褐变程度的增加,果肉腐烂,最终彻底丧失食用价值。亟需减轻果实冷害的处理方法,降低其造成的经济损失。
1-甲基环丙烯 (1-methylcyclopropene,1-MCP)是乙烯受体抑制剂,通过阻断乙烯激发的一系列生化反应起作用,可有效提高果实耐储性和抵抗力[2]。1-MCP 抵制冷害能力与果实抗冷性有关,经一定浓度1-MCP 处理的桃[3]、李果[4]、枇杷[5]和西葫芦[6]冷害褐变程度减轻。乙烯吸附剂(ethylene adsorbent,EA) 是填充高锰酸钾的活性炭,利用KMnO4的强氧化性氧化外界乙烯,抑制内源乙烯的生成,延长果蔬的贮藏时间[7]。EA 通过提高果实游离脯氨酸含量和增强细胞持水能力,抑制丙二醛的大量累积和电解质渗透率的增加,有效缓解细胞膜膜脂过氧化程度,进而增强果实抗冷能力,达到减轻冷害的目的[8]。已有研究证实EA 控制阳丰甜柿[9]、番茄[10]、香蕉李[4]、“八月脆”桃果实[11]等果蔬褐变的有效性。
糖具有调节渗透压、信号分子及激素峰等多种生物学功能,不仅为果实内部细胞提供能量,还为细胞内骨架的建立以及细胞器的形成提供原料[12]。黄桃果实中的可溶性糖与耐冷性密切相关,在低温贮藏过程中糖会发生一系列变化,作为渗透调节因子、低温保护剂和活性氧清除剂保护样品免受低温胁迫,进而缓解果实冷害[13]。黄桃糖代谢关键酶分为转化酶和合成酶两类,包括酸性和中性转化酶以及蔗糖和蔗糖单磷酸合成酶,不同转化酶与合成酶之间相互作用形成复杂的蔗糖代谢系统,控制植物在低温胁迫下的可溶性糖代谢,调节果实糖含量[14]。分析黄桃果实蔗糖代谢情况对冷害研究尤为重要。
目前关于黄桃低温贮藏期间的冷害控制和对蔗糖代谢的影响尚未有研究报道。本文以湖南麻阳 “锦绣” 黄桃品种为试验材料,分别采用1-MCP-EA 和1-MCP 处理,测定黄桃低温贮藏期间的冷害褐变指数、果肉质地变化、可溶性糖含量以及蔗糖代谢相关酶活等生理指标,探讨上述处理对黄桃贮藏品质的影响,为其采后贮藏保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
材料:试验所用黄桃于2020年8月3日采摘于湖南省怀化市麻阳县兰里镇横喇村,采摘当天运至冷库(4 ℃±1 ℃)冷藏。选择颜色、大小均匀一致,无机械损伤且已达到食用要求的果实。
果实处理:果实随机分为3 组,每45 个果实为1 组。1 组采用1-MCP 处理,1 组采用1-MCPEA 处理,剩余1 组作为对照组,每组设3 个重复,每个重复15 个果实。在贮藏期为0,7,14,21,28 d,对黄桃果实进行生理测定,剩余果肉切丁液氮冷冻处理,存储在-80 ℃环境供进一步使用。
试剂:0.03% 1-MCP,山东奥维特生物科技有限公司;3% EA,山东奥维特生物科技有限公司;蒽酮 (分析纯)、乙酸乙酯、浓硫酸、Na2HPO4·12H2O、NaH2PO4·2H2O、MgCl2·6H2O,国药集团化学试剂有限公司;β-巯基乙醇,长沙市佳和生物科技有限责任公司;Triton-X-100,国药集团化学试剂有限公司;交联聚乙烯吡咯烷酮(PVPP),上海瑞永生物科技有限公司;乙二胺四乙酸(EDTA),国药集团化学试剂有限公司;尿苷二磷酸葡萄糖(UDPG),上海麦克林生化科技有限公司;蔗糖,西陇科学股份有限公司;葡萄糖、果糖,国药集团化学试剂有限公司;氢氧化钾,西陇科学股份有限公司;果糖-6-磷酸,上海麦克林生化科技有限公司;葡萄糖-6-磷酸,上海麦克林生化科技有限公司。
1.2 试验主要仪器
Color Quest XE 型全自动色度分析仪,美国Hunter Lab 公司;CT-3 质构仪,Brookfield 工程实验室公司;JYZ-V5PLUS 智能原汁机,九阳股份有限公司;VANTI J-26XP 高效离心机,美国贝克曼库尔特公司;电子天平,上海光正医疗仪器有限公司;PAL-BX/acid1 型ATAGO 便携式糖酸度计,日本爱拓公司;WP-UP-WF-20 超纯水制备机,四川沃特尔水处理设备有限公司;BSA 124S 型精密分析天平,广州市授科仪器科技有限公司;MDF-86V408 型医用低温保存箱,安徽中科都菱商用电器股份有限公司;电热恒温水浴锅,北京三二八科学仪器有限公司;C22-CX2 型电磁灶,杭州九阳生活电器有限公司;UV-1800 型紫外-可见分光光度计,岛津仪器(苏州)有限公司;DHG-9053A 型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;多功能微孔板检测仪,广州大瑞生物科技股份有限公司。
1.3 试验方法
1.3.1 果皮色差的测定 采用Color Quest XE 色差仪,标准白板作参照,任意选取黄桃赤道处3 点测定L*、a*、b*值,平行测定3 次,取其平均值。
1.3.2 果皮硬度的测定 采用CT-3 质构仪,选择TA39 探头,于黄桃赤道等距离处测其硬度。参数选择CT-3 质构仪的TPA 分析模式,圆柱形,设置预测试速度1 mm/s,测试和返回速度2 mm/s,测试2 次,由质地特征曲线和报告中各数据获取硬度值。平行测定3 次,取其平均值。
教师引导学生正确地分析实训项目任务并将任务逐步分解,产生一些大大小小的子任务,通过解决这些子任务来完成原来的任务。工作任务是由浅入深的顺序设计,每一个操作步骤都有详细的提示,部分操作学生只要根据图文点击鼠标就能得到效果,从而大大激发了学生的兴趣,能促使学生根据步骤一环接一环地持续学习,使学生从“要我学”逐步变成“我要学”,自主学习得到较大提升。
1.3.3 褐变指数的测定 将黄桃果实沿赤道线纵切,按切面的褐变面积划分级别,0 级:0 褐变;1级: 切面褐变面积0~25%;2 级: 切面褐变面积25%~50%;3 级:切面褐变面积50%~75%;4 级:切面褐变面积>75%。汇总各级别果实个数计算褐变指数:

1.3.4 可溶性固形物(soluble solid content,SSC)的测定 使用JYZ-V5PLUS 智能原汁机,榨取黄桃果汁后装入50 mL 离心管进行离心,离心条件:4 ℃预冷,10 000 r/min,10 min。离心完成后取20 μL 上清液,用PAL-BX/acid 1 型ATAGO 便携式糖酸度计测定,3 次平行,取其平均值。
1.3.5 可滴定酸(titratable acids,TA)的测定 将1.1.4 节中的上清液稀释50 倍,混合均匀后,取适量稀释后的液体置于PAL-BX/acid1 型便携式糖酸度计上,混合均匀后读取酸度值,重复测定3次,平均值为该果实的TA(g/100 mL)值。
1.3.6 单糖含量的测定 蒽酮-硫酸比色法测黄桃葡萄糖和果糖含量,NaOH-蒽酮-硫酸法测其蔗糖含量,3 次平行,取其平均值。
1.3.7 蔗糖代谢相关酶活的测定 酶活性的测定参照王慧聪等[15]方法并略有改动,取1 g 样品备用,3 mL 缓冲液预冷,预冷完成后加至样品。该缓冲液含有50 mmol/L 的NaOH (pH 7.5、5 mmol/L的MgCl2、1 mmol/L 的Na2EDTA、2.5 mmol/L 的DTT 和0.05% Triton X-100(V/V))。冰浴条件下研磨均匀,匀浆在4 ℃下以11 000 r/min 离心15 min,上清液保存在-20 ℃低温箱备用。以失活酶液为对照组,测定AI 和NI 时读取其540 nm 处吸光值。测定SS 和SPS 时读取其620 nm 处吸光值。用试验组减去对照组的吸光度值计算还原糖的产生速率,根据葡萄糖标准曲线查出其对应含量后计算活性,表示为μmol/h·g,重复测定3 次,取平均值。
1.4 数据处理
采用WPS Office Excel 工具分析整理数据,SPSS 25.0 软件统计分析数据,邓肯多重极差法(LSR 法) 进行显著性检验(P<0.05),origin 2017软件作图。所有试验均包含3 次重复。
2 结果与分析
2.1 不同处理对黄桃果实色泽的影响

表1 不同处理对黄桃低温贮藏期间色泽的影响Table 1 Effects of different treatments on the color of yellow peach during low temperature storage
2.2 不同处理对黄桃果实硬度的影响
不同处理下黄桃硬度在贮藏期间的变化情况如图1所示,各处理组果实硬度持续降低,处理组果实硬度始终高于对照组,且有显著差异。果实初始硬度值为(1 015.00±43.30)g,到贮藏结束时对照组下降了65.76%,1-MCP 和1-MCP-EA 处理组下降幅度分别为59.19%和38.60%,联合处理组下降程度为三者最小。在贮藏前期,单独处理组果实硬度与联合处理组无显著差异;在贮藏中后期,联合处理组果实硬度显著高于单独处理组,且差异显著。说明1-MCP 单独处理和结合EA 的联合处理均能延缓黄桃果实硬度下降(P<0.05),联合处理组1-MCP-EA 延缓黄桃硬度下降的效果更好。

图1 不同处理对黄桃果实低温贮藏期间硬度的影响Fig.1 Effects of different treatments on the firmness of yellow peach during low temperature storage
2.3 不同处理对黄桃果实冷害褐变指数的影响
褐变是冷害最明显的症状,褐变指数能够用于判断黄桃冷害严重程度。在贮藏期间,黄桃冷害褐变指数的变化如图2所示,在贮藏期间3 组均在第7 天开始褐变,此时对照组的冷害褐变指数为9.38%,显著高于联合处理组。贮藏7 d 后,对照组显著高于其它组,表明1-MCP 处理能够延缓黄桃贮藏后期褐变指数的增加,而1-MCP 结合EA 处理能够延缓黄桃在整个贮藏期间的褐变情况,说明1-MCP 和1-MCP-EA 均能抑制黄桃果实褐变程度(P<0.05),1-MCP-EA 抑制效果更好。

图2 不同处理对低温贮藏黄桃冷害褐变指数的影响Fig.2 Effects of different treatments on browning index of yellow peach fruits during low temperature storage
2.4 不同处理对黄桃果实SSC 和TA 的影响
黄桃低温贮藏期间的SSC 和TA 变化如图3所示。由图3a 可知,不同处理SSC 变化趋势一致,表现为前期迅速上升,之后下降,分别在14 d 和21 d 到达峰值后迅速降低。在贮藏前期,3 组SSC迅速上升,其中对照组SSC 增加最多,上升幅度为27.05%,显著高于其它两组。对比3 组的冷害褐变指数表明,1-MCP 和1-MCP-EA 处理均能较好抑制SSC 的下降,其中1-MCP-EA 能够推迟SSC 最大值的出现时间,延缓其成熟衰老进程,说明1-MCP-EA 联合处理组控制果实成熟衰老的效果更好。由图3b 可知,在低温贮藏期间黄桃果实TA值先下降后上升。贮藏前期对照组下降速率显著高于1-MCP 和1-MCP-EA 处理组,1-MCP-EA下降速率显著低于1-MCP 组。贮藏中后期,对照组和处理组TA 值均小幅度增加,且处理组增加速率相对较大,可能是由于受到1-MCP、EA 作用使贮藏环境乙烯浓度较低,黄桃无氧呼吸,产生乳酸,TA 值上升。说明1-MCP 和1-MCP-EA 处理均能够推迟黄桃贮藏期间酸度下降,且1-MCPEA 联合处理效果更好。

图3 不同处理对低温贮藏黄桃SSC(a)和TA(b)的影响Fig.3 Effects of different treatments on SSC (a) and TA (b) of yellow peach during low temperature storage
2.5 不同处理对黄桃果实可溶性糖的影响
如图4a 所示,对比3 组果实蔗糖含量表明,1-MCP-EA 处理后果实低于其它两组的蔗糖水平,且差异显著(P<0.05),1-MCP 处理组整体低于对照组的蔗糖水平。3 组黄桃蔗糖含量在贮藏期间整体呈先增加后下降的趋势,贮藏至7 d 时达到峰值,之后下降。对照组上升幅度显著高于其它两组,1-MCP-EA 联合处理组上升最为平缓,且三者之间存在显著差异(P<0.05)。在贮藏7 d 后,3组蔗糖含量开始下降,1-MCP-EA 处理组下降幅度最大,1-MCP 组介于两者之间。说明1-MCPEA 和1-MCP 处理均能抑制蔗糖含量上升,而1-MCP-EA 组抑制效果最好。
如图4b 和图4c 所示,在整个贮藏期间,黄桃的葡萄糖和果糖含量的升降情况类似,呈逐渐升高的态势,与蔗糖变化情况相反。1-MCP-EA 处理组葡萄糖和果糖含量始终高于对照组,1-MCP 单独处理组整体高于对照组。表明1-MCP 和1-MCP-EA 处理可促进黄桃贮藏期间葡萄糖和果糖的生成,其中1-MCP-EA 对葡萄糖和果糖含量的促进效果最好。
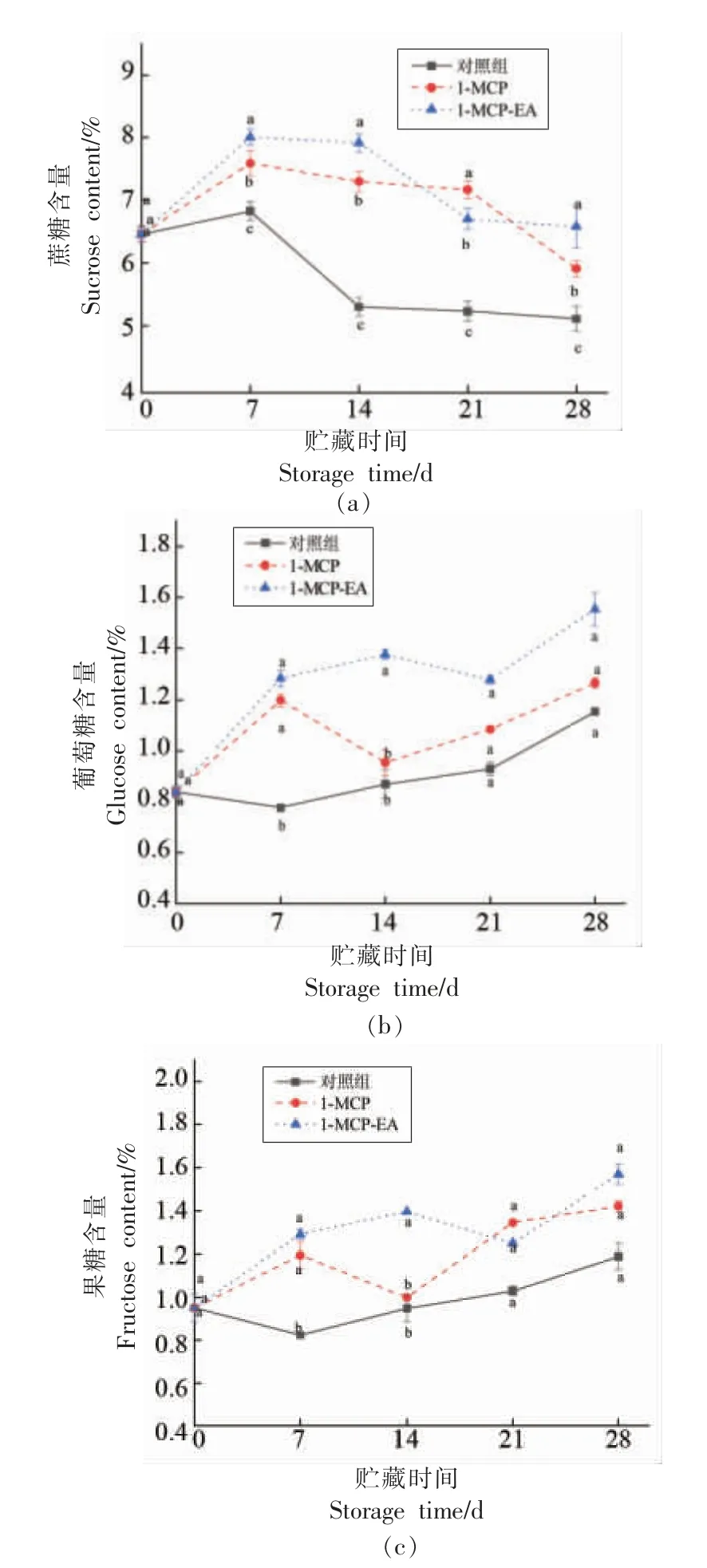
图4 不同处理对黄桃低温贮藏期间蔗糖(a),葡萄糖(b)和果糖(c)含量的影响Fig.4 Effects of different treatments on the content of sucrose (a),glucose (b) and fructose (c)of yellow peach during low temperature storage
2.6 不同处理对黄桃果实蔗糖代谢酶活的影响
由图5a 和图5b 可知,在贮藏期间,3 组黄桃果实的NI 和AI 总体上升。在贮藏前期,对照组AI 活性显著高于1-MCP-EA 和1-MCP 组,对照组NI 活性显著高于1-MCP-EA 组,略高于1-MCP 组;在贮藏中期,对照组活性迅速下降,处理组活性急剧上升,且对照组与处理组之间在每个贮藏节点均有显著差异,表明1-MCP 和1-MCPEA 处理均能有效抑制贮藏前期黄桃NI 与AI 活性,明显促进贮藏后期AI 和NI 活性,而在贮藏前期1-MCP-EA 联合处理组对NI 和AI 活性的抑制效果更好。
由图5c 和图5d 可知,在整个贮藏期间黄桃SPS 和SS 的活性整体呈现下降趋势。1-MCP-EA和1-MCP 组SS 活性和SPS 活性始终高于对照组,且具有显著差异。1-MCP-EA 组除在第21 天显著高于1-MCP 组活性外,其余时间无显著差异。表明1-MCP-EA 和1-MCP 处理均可抑制SPS和SS 的活性下降,而在贮藏中后期,相比于1-MCP 组,1-MCP-EA 处理对SPS 和SS 活性影响更大,可能会由此促进黄桃积累蔗糖,增强果实耐冷性,缓解冷害的发生。
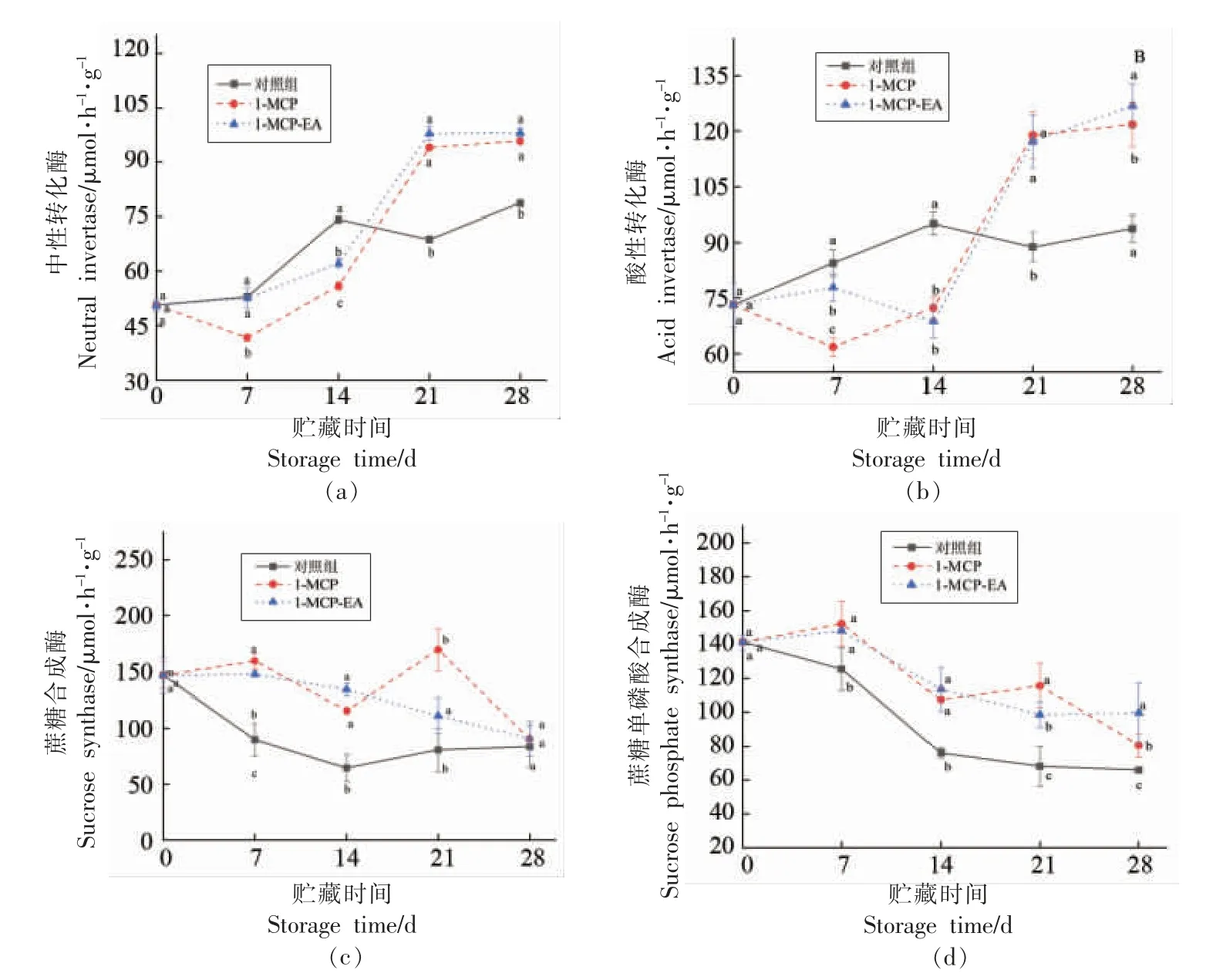
图5 不同处理桃果实低温贮藏期间NI(a),AI(b),SS(c)和SPS(d)的变化Fig.5 Effects of different treatments on NI (a),AI (b),SS (c) and SPS (d) of yellow peach during low temperature storage
3 讨论
黄桃在贮藏期间果皮越偏向红色,表明果实越成熟。在低温贮藏期间,果实b*值波动下降,对照组比1-MCP 和1-MCP-EA 处理组下降程度大且有显著差异(P<0.05),表明1-MCP 与1-MCPEA 处理均能较好地减少黄桃贮藏期间果实颜色转变,且1-MCP-EA 处理组维持a*值效果较好。对苹果的研究也说明1-MCP-EA 延缓果皮转黄效果优于1-MCP 单独处理。
1-MCP 和1-MCP-EA 处理均可有效维持黄桃果实固有硬度,1-MCP-EA 处理维持果实硬度的效果更好,与及华等[2]的研究结果一致。随着贮藏时间延长,果实冷害褐变指数快速上升,1-MCP-EA 有效延缓了冷害指数上升程度,且显著优于1-MCP 单独处理的效果。
相比于处理组,对照组黄桃果实的总可滴定酸下降迅速,这可能因为有机酸大量参与果实成熟进程中的糖合成[17]。在贮藏期间各处理组黄桃SSC 含量变化差异可能与果实后熟有关,贮藏期间黄桃SSC 含量下降,其中两种处理组SSC 含量始终高于对照组,此现象可能是因1-MCP-EA 和1-MCP 均能够促进黄桃果实内部的多糖向可溶性固形物降解[18],1-MCP-EA 效果更好,可能由于1-MCP-EA 处理吸收环境中的乙烯,抑制呼吸速率,使果实内部的可溶性固形物降解缓慢[20]。
糖参与干旱、寒冷和盐度等不利环境条件下的植物防御反应,可溶性糖是果实抵抗低温的主要渗透调节物质,其中蔗糖是重要低温保护剂,能够保护植物免受低温损伤[12]。果实抗冷能力可能与外源处理引起的可溶性糖含量波动有关[21]。1-MCP-EA 处理后黄桃的蔗糖含量显著高于其它两组,Zhao 等[22]的研究表明在近冰温贮藏时水蜜桃蔗糖含量与冷害指数呈显著负相关,说明1-MCP-EA 可能是通过维持较高的蔗糖水平保证抗冷性,延缓冷害。对照组和处理组的NI 和AI 活性呈整体上升趋势,杨玉梅[23]的研究表明蔗糖含量可能与AI 和NI 活性呈负相关关系,提高AI 活性可能会促进蔗糖的降解和己糖的积累,更多的己糖用于呼吸作用,进一步促进蔗糖降解,这与黄桃蔗糖含量呈下降趋势一致。说明1-MCP-EA 处理可能通过抑制贮藏前期AI 活性增加,有效抑制了蔗糖含量的损失,提高果实抗冷性,延缓冷害。
在整个贮藏期间,处理组SS 和SPS 始终显著高于对照,由于蔗糖含量与其SS、SPS 呈显著正相关[25]说明1-MCP-EA 与1-MCP 处理可能是通过显著提高蔗糖合成酶活性,促进蔗糖的合成。姚明华等[24]发现茄子中可溶性糖含量与其冷害指数呈极显著负相关,说明1-MCP-EA 处理可能通过调节糖代谢,诱导提高蔗糖代谢相关酶活,维持高蔗糖水平发挥果实抗冷性,缓解冷害。
4 结论
通过研究黄桃低温贮藏期间硬度、色差值、冷害褐变指数、SSC 和TA 变化发现,与对照相比,1-MCP-EA 处理能明显延缓黄桃果实硬度下降,抑制果皮色泽转变,降低冷害褐变,抑制SSC 降低和贮藏前期TA 下降程度,而1-MCP 单独处理效果不显著;通过同时抑制AI 和NI 活性的增加,SS和SPS 活性的降低,以及果糖和葡萄糖的上升,使蔗糖含量维持在较高水平,对减轻冷害起重要作用。
1-MCP-EA 处理为黄桃果实冷害控制提供新的思路和理论依据,同时具有经济、方便和实用等优点,将在黄桃采后商品化处理方面发挥较大作用。
