灵武长枣贮藏过程中细胞壁降解及多糖结构的变化
2022-10-24郝慧慧张海红杨静慧
郝慧慧,邱 雪,张海红,杨静慧
(宁夏大学食品与葡萄酒学院 银川 750021)
灵武长枣,别名马牙枣,为宁夏特色鲜食长枣,中国国家地理标志产品,具有色泽诱人、质脆肉丰、营养丰富、酸甜适口等特点,其最大单果质量可达40 g,含可溶性固形物≥25.0%,有“百果之王”的美称[1]。其在采后贮藏过程中极易发生失水、软化、皱缩等情况,造成脆性降低、品质下降、口感柴化、营养成分流失等现象,严重影响灵武长枣的货架期及商品价值。
果实在采后贮藏过程中随着质地不断软化,生理、生化指标会发生变化。植物细胞壁主要由胞间层、初生壁和次生壁构成,其主要成分是果胶和纤维素,对细胞具有支持、保护作用。研究表明,诸多果实,如杏[2]、蓝莓[3]、苹果[4]、梨[5]、草莓[6]等在贮藏过程中,伴随着细胞壁修饰酶的作用,细胞壁多糖结构不断改变、降解、溶解,使果实硬度不断下降,最终导致果实软化。Wang 等[7]研究发现蔗糖分解代谢会促进果实软化,且蔗糖含量、蔗糖磷酸合成酶活性与果实硬度下降呈正相关。Jain 等[8]发现在储存过程中,纤维素、半纤维素和果胶含量持续下降的同时,伴随着细胞壁酶活性的上升,果胶的降解与聚半乳糖醛酸酶和果胶甲酯酶的表达密切相关,且细胞壁酶活性与果实硬度的降低呈正相关,表明细胞壁软化与多糖代谢具有一定的关联性。
植物细胞壁中果胶主要由同型半乳糖醛酸聚糖(Homogalacturonan,HG)和鼠李半乳糖醛酸聚糖(Rhamnogalacturonan,RG)组成,一般根据半乳糖醛酸与鼠李糖残基的比例来判别果胶主链的变化,再根据半乳糖基与鼠李糖残基的比例及阿拉伯糖基与鼠李糖残基的比例判别果胶侧链的变化[9]。Fan 等[10]以杏为研究对象,发现其贮藏过程中,水溶性果胶侧链的缺失会改变细胞壁的刚性和强度,影响果胶的溶解度,进而改变果实的质地。Liu 等[11]利用原子力显微镜研究钙处理结合低温贮藏的杏细胞纳米结构,通过测量果胶组分的链长及链宽变化,发现杏的软化过程遵循多糖在贮藏过程中降解的变化趋势。
目前关于贮藏过程中果蔬二级结构的变化鲜有研究报道。本文拟以灵武长枣为研究对象,研究贮藏过程中,伴随着果实软化,细胞壁组分含量及细胞壁结构的变化。结合傅里叶红外光谱技术,分析细胞壁果胶多糖中官能团变化对果胶组分及细胞壁结构的影响,为灵武长枣采后贮藏保鲜提供试验参考。
1 材料与方法
1.1 试验材料与试剂
本试验所用的灵武长枣采摘于宁夏灵武市大泉林场长枣生产基地,采摘后装于纸板箱常温下24 h 内送至实验室。挑选出无机械损伤、无病虫害、果形大小相似的果实作为实验试材,分装于7个聚乙烯塑料保鲜袋内,对应于7 次不同的取样测定时间,每袋内枣果数量不低于50 个。室温下散失呼吸热12 h 后将果实置于4 ℃冰箱内贮藏待测。
咔唑、溴化钾(光谱纯)、无水乙醇,天津市瑞金特化学试剂有限公司;蒽酮,天津市科密欧化学试剂开发中心;二甲基亚砜、1,2-环己二胺四乙酸,天津市津科化工研究所;氯仿,中国宿迁化学试剂有限公司;碳酸钠,天津市永大化学试剂有限公司;氢氧化钠、硼氢化钠,国药集团化学试剂有限公司。
1.2 试验设备与仪器
GL-20C 高速冷冻离心机,北京哈纳科仪科技有限公司;HH-4 电热恒温水浴锅,上海比朗仪器有限公司;LGJ-18 小型烘箱,上海力辰科技有限公司;TA-XT2i 质构仪,英国Stable Micro Systems公司;WYT-J 手持糖度折光仪,成都兴晨光光学仪器有限公司;MC10000 离子溅射仪、SU8100 扫描电子显微镜,hitachi;WQF-520 傅里叶红外变换光谱仪,北京瑞利分析仪器有限公司。
1.3 灵武长枣果实品质变化的测定
1.3.1 硬度 从每组样品中随机选取10 个果实,削去果皮,沿长枣赤道部相对的两个位置,通过TA-XT2i 质构仪,选用P2n 针状探头,以穿刺模式进行枣果硬度的测试。设置测试速度1 mm/s,返回速度5 mm/s,触发点负载5 g,穿刺深度5 mm。
1.3.2 可溶性固形物含量 用手持糖度折光仪测定可溶性固形物(soluble solids content,SSC)含量,取5.0 g 枣果果肉部分放入研钵中磨碎后,4 000 r/min 离心10 min,取上清液重复测定3 次。
1.4 细胞壁成分的分离及测定
参考Marwa 等[12]与曹建康等[13]的方法并稍作修改,分别提取灵武长枣细胞壁物质中的水溶性果胶 (Water-soluble pectin,WSP)、螯合性果胶(CDTA-soluble pectin,CSP)、碱溶性果胶(sodium carbonate-soluble pectin,SSP)、纤维素(Cellulose,CE)和半纤维素(Hemicellulose,HC),详细步骤如图1。果胶含量采用咔唑法测定,半纤维素和纤维素含量采用蒽酮法测定[14]。
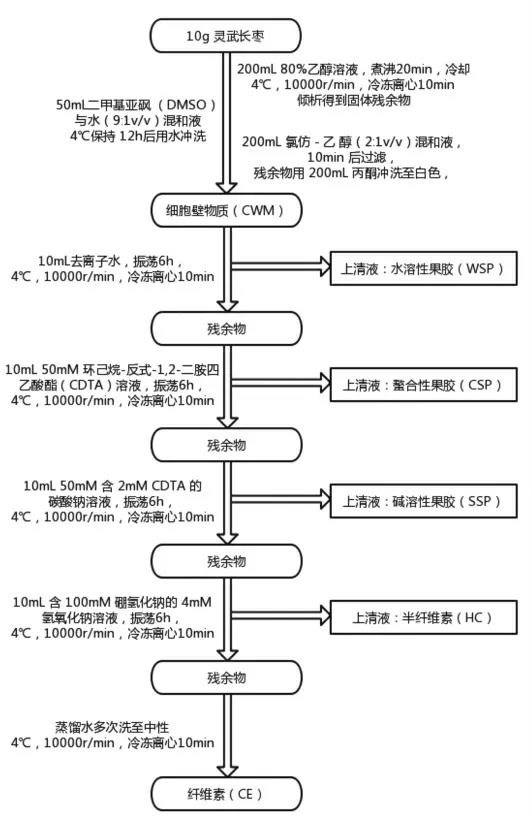
图1 细胞壁成分的分离提取步骤图Fig.1 Step diagram of separation and extraction of cell wall components
1.5 扫描电镜观察
取贮藏初期与贮藏末期的灵武长枣果肉组织块,组织块面积不超过3 mm2,用PBS 轻轻漂洗样本后迅速放入电镜固定液中,室温固定2 h。固定好的样品经0.1 mol/L 磷酸缓冲液PB(pH 7.4)漂洗6 次,每次15 min。然后将组织依次放入30%,50%,70%,90%,95%,100%,100%酒精溶液中进行脱水处理,每次15 min,再用乙酸异戊酯溶液处理15 min。然后将样本放入临界点干燥仪内进行干燥,干燥后将样本紧贴于导电碳膜双面胶上,放入离子溅射仪样品台上进行30 s 喷金导电处理,最后在SU8100 扫描电子显微镜观察采图。
1.6 傅里叶红外(FT-IR)光谱
采用KBr 压片法,将200 mg 干燥好的KBr 与2 mg 样品在红外灯照射下于玛瑙研钵中研磨至无明显颗粒状,取100 mg 研磨好的混合样品,用HY-12 型油压机压制成薄膜,在傅里叶红外光谱仪 (Fourier transform infrared spectroscopy,FTIR)上进行透射扫描,扫描波长范围为4 000~400 cm-1,分辨率为4 cm-1。
1.7 数据分析
数据采用Origin 2019 软件进行作图和统计分析,用SPSS 进行差异显著性分析(P<0.05 差异显著,P<0.01 差异极显著)和相关性分析,用Unscrambler 对光谱数据进行多变量统计分析。结果用3 次重复的平均值表示。
2 结果与分析
2.1 硬度及可溶性固形物含量的变化
硬度是反映果实品质的重要参数之一,鲜食灵武长枣的硬度能反映其脆度的变化,是判定贮藏过程中质地变化的重要指标[15]。如图2所示,灵武长枣在贮藏过程中,硬度呈现稳定下降趋势。在第4 天至第18 天贮藏时间内,各测量时间段硬度下降有显著差异性(P<0.05),且在第10 天至第14天内硬度下降趋势最明显,期间硬度下降了5.13 N,在贮藏后期下降缓慢,在贮藏25 d 后硬度为贮藏初期的84.77%。
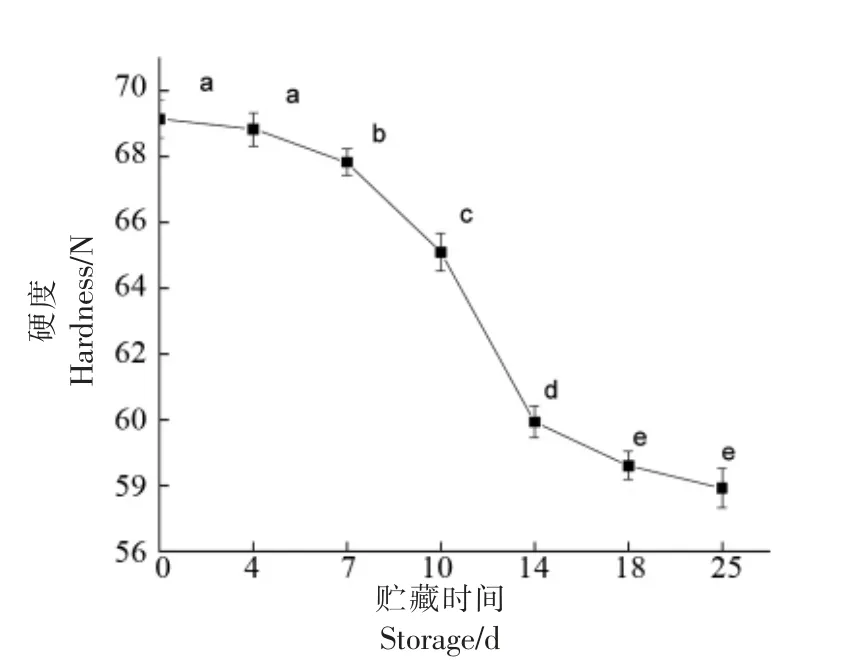
图2 贮藏过程中灵武长枣硬度的变化Fig.2 Changes of hardness of Lingwu long jujube during storage
可溶性固形物是反映果实成熟及生理变化的重要指标。由图3可知,随贮藏时间的延长,灵武长枣果实内SSC 含量有波动,呈现上升-下降-上升趋势。从贮藏开始至第10 天,SSC 含量变化不显著,贮藏后第7 天SSC 含量达到最高为27.07%,在第10 天至第14 天内该含量下降趋势最明显(P<0.05)。这是由于在贮藏过程中,灵武长枣自身的新陈代谢活动不断进行,伴随着果实后熟与软化的发生,前期果实呼吸消耗基质,后期淀粉水解为可溶性糖导致SSC 含量上升[16]。
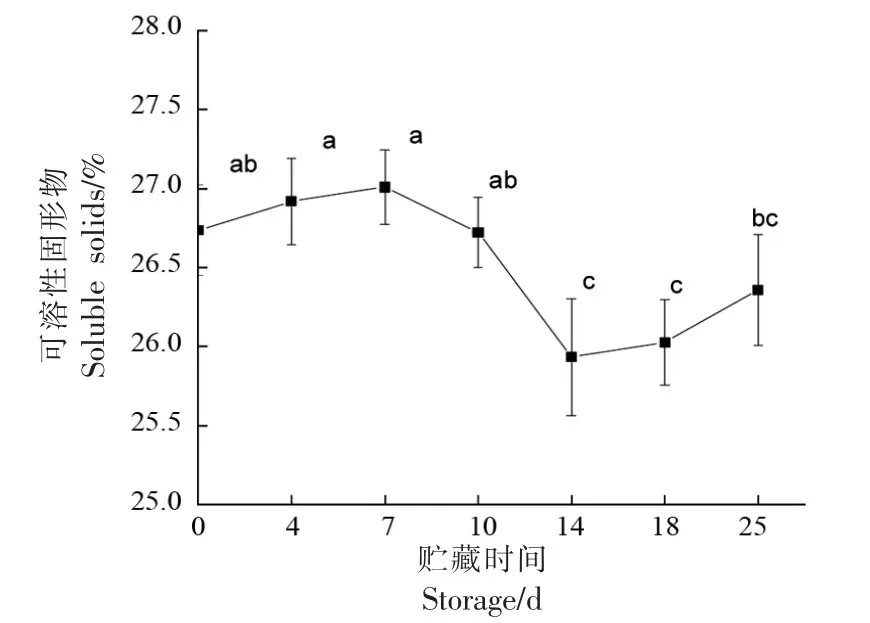
图3 贮藏过程中灵武长枣可溶性固形物的变化Fig.3 Changes of soluble solids in Lingwu long jujube during storage
2.2 细胞壁物质含量变化
果胶物质、纤维素和半纤维素是构成细胞壁骨架的重要物质,水溶性果胶WSP、螯合性果胶CSP 与碱溶性果胶SSP 主要存在于细胞壁中胶层中,保持细胞间内聚力,在细胞间有粘连作用,CE被认为是果蔬细胞中最稳定的聚合物,是形成细胞壁的机械基础[17-18]。在灵武长枣贮藏期间内,细胞壁物质含量均呈现先上升后下降的趋势。在贮藏0~18 d,WSP 含量变化差异性显著(P<0.05),在贮藏第18 天达到峰值598.96 mg/100 g FW。CSP、SSP、HC 及CE 含量在第14 天均出现拐点,之后开始不断下降,其中CE 含量下降速度最快,第25天含量相比第14 天下降了28.40%。在酶的作用下,细胞壁果胶层不断降解,原果胶转化成为果胶多糖,HC、CE 降解使含量降低,WSP 含量不断上升,破坏了细胞壁的结构使果实不断软化。
2.3 细胞壁物质与硬度、可溶性固形物相关性分析
由表1可知,灵武长枣果实硬度与SSC、WSP呈极显著相关,相关系数分别为0.9638,-0.8862;SSC 与WSP 呈显著负相关,相关系数为-0.8738;CSP 与SSP、HC 呈极显著正相关,相关系数分别为0.8902,0.9172;SSP 与HC 呈显著正相关,相关系数为0.8500;HC 与CE 呈显著正相关,相关性系数为0.8027。说明枣果在采后贮藏过程中,硬度、SSC 与细胞壁组分之间有密切相关性,细胞壁组分的降解转化使得枣果硬度下降,最终导致果实软化。
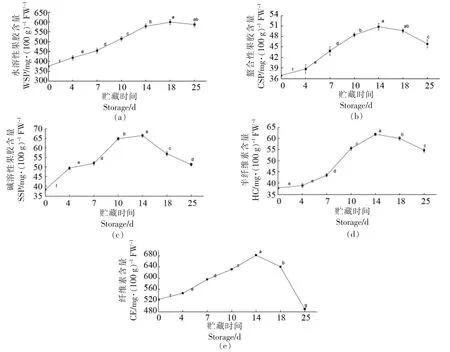
图4 贮藏过程中灵武长枣细胞壁物质含量的变化Fig.4 Changes of cell wall substance content of Lingwu long jujube during storage
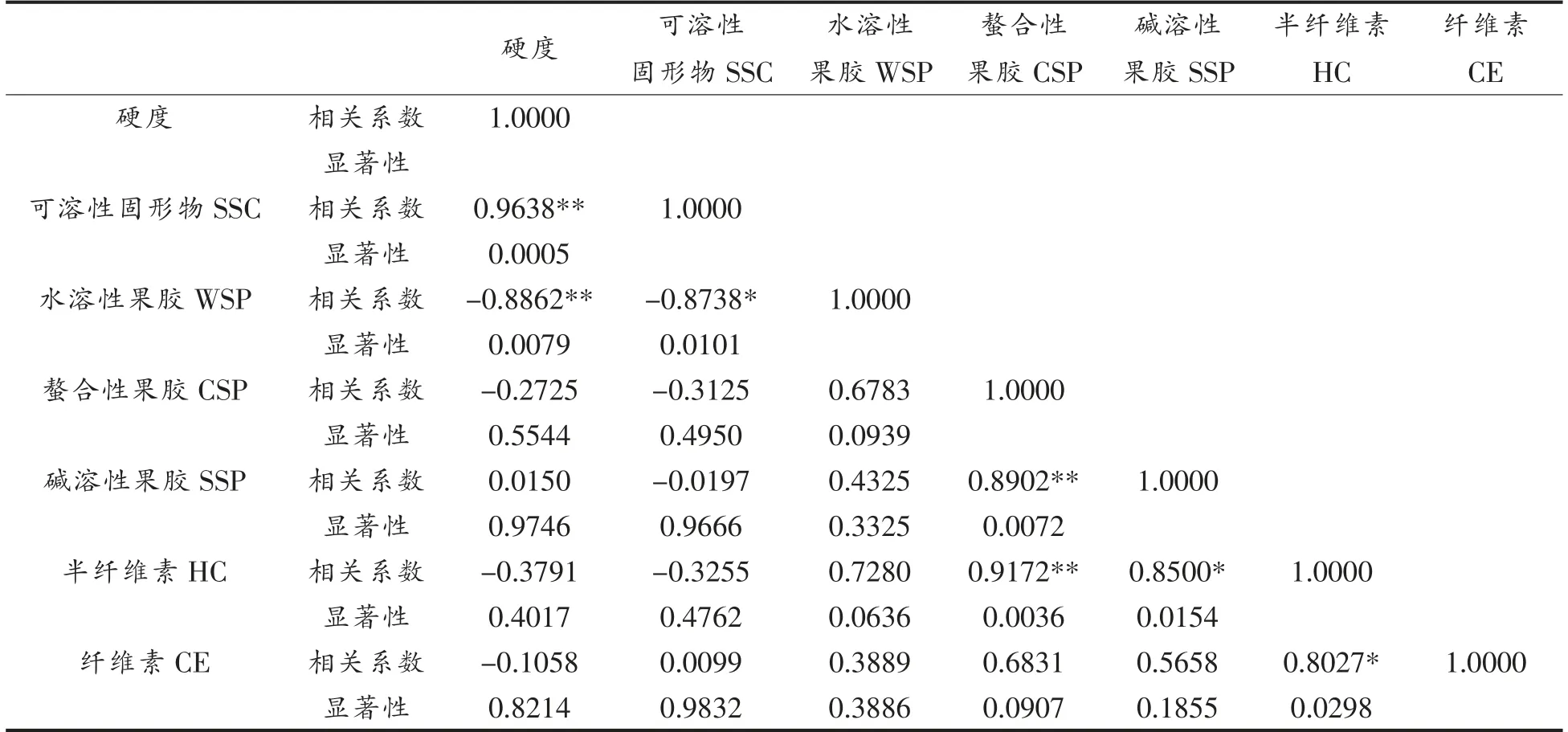
表1 灵武长枣贮藏期间细胞壁物质与硬度、可溶性固形物相关性Table 1 Correlation between cell wall substances and hardness and soluble solids of Lingwu long jujube during storage
2.4 微观图像分析
对贮藏初期与贮藏末期的枣果组织块分别进行电镜扫描分析。结果显示,贮藏初期(图5a,5b)细胞分布呈现规则的蜂窝状结构,此时细胞排列紧密,细胞结构完整。贮藏末期(图5c,5d)部分细胞发生肿胀弯曲变形,细胞分布呈现不规则的形状,细胞间出现空隙,变得松散。说明在贮藏过程中细胞壁成分结构的改变使CE 降解,木葡聚糖发生断裂,打破了纤维素-木葡聚糖的结构及细胞壁整体结构,使细胞壁空隙增大。WSP 含量的上升,导致细胞壁发生膨胀作用,降低了细胞壁的刚度,使其结构变得疏松多孔,进而降低了细胞间黏附,促进了细胞壁的解体[19]。这与前人在苹果[20]、杏[21]、番茄[22]等中发现的规律一致。

图5 贮藏初期(a,b)与贮藏末期(c,d)电镜扫描图Fig.5 Scanning electron microscope images of early storage (a,b) and late storage (c,d)
2.5 分子结构特征分析
傅里叶红外光谱可以区分多糖的特征吸收峰以表征多糖分子结构特征,在所测得的光谱数据中,1 800~800 cm-1包含有最有价值的光谱信息[23]。根据Kyomugasho 等[24]的研究发现,可根据酯化与非酯化羧基的红外波段特征之间的变化关系来判断果实成熟过程中果胶酯化度的变化,甲基酯化度可根据果胶红外光谱1 740 cm-1处的峰强度与1 740 cm-1和1 630 cm-1处的峰强度之和的比率来计算。图6显示了灵武长枣在贮藏初期与贮藏末期不同果胶组分的傅里叶红外光谱。
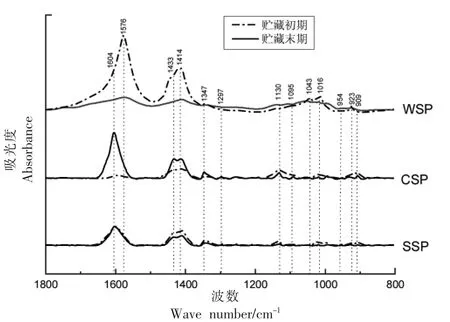
图6 灵武长枣在贮藏初期与贮藏末期果胶物质的傅里叶红外光谱图Fig.6 Fourier infrared spectra of pectin in Lingwu long jujube at the beginning and end of storage
WSP 在贮藏前后酯化度从37.39%降到21.27%;在1 576 cm-1处有强吸收峰,表明有CO-O 键的存在;在1 414 cm-1处出现的吸收峰是C=O 双键伸缩振动引起的;贮藏初期的1 043 cm-1处与贮藏末期的1 016 cm-1处出现的吸收峰为吡喃糖苷吸收峰,波峰的迁移说明WSP 中吡喃糖苷键在贮藏过程中发生了改变,也表明枣果的软化与吡喃糖苷键有关;贮藏初期的923 cm-1处与贮藏末期954 cm-1处的吸收峰主要是由吡喃环引起的非对称环伸缩振动,波峰的迁移可能是由脱氧的鼠李糖末端次甲基的摇摆振动引起的。
CSP 在贮藏前后酯化度从31.27%降到25.77%;贮藏初期在1 433 cm-1处有吸收峰,而贮藏末期却没有,说明在贮藏过程中CSP 链发生了改变,而这种变化可能与果胶组分之间的相互转换有关;1 300~1 400 cm-1处的吸收峰可能由C-O伸缩振动引起,在1 347 cm-1处的吸收峰表明CSP中存在烷烃;在1 297 cm-1处的吸收峰表明存在非对称C-O-C 拉伸振动;在1 130 cm-1处的吸收峰表明CSP 中存在酯或内酯;贮藏末期与贮藏初期相比,在1 200~1 010 cm-1之间的吸收峰减少,表明随贮藏时间的延长,CSP 中吡喃基减少,推测该基团与枣果的软化有关。
SSP 果胶酯化度较低,在贮藏前后1 740~1 630 cm-1处的吸收峰没有明显变化;在1 604 cm-1处有强吸收峰,表明该果胶中存在C-O-O键;在1 433,1 414 cm-1处出现的吸收峰为C=O双键伸缩振动吸收峰;在1 200~1 400 cm-1区间出现的吸收峰是由C-H 的变角振动所引起的;1 010~1 100 cm-1之间出现的吸收峰为吡喃糖苷吸收峰;909 cm-1处的吸收峰是由吡喃环的非对称环伸缩振动引起的。
总体来说,灵武长枣在25 d 贮藏期内,果胶组分结构没有发生巨大变化,但贮藏末期果胶中的某些基团与贮藏初期相比,明显减少。例如在贮藏末期,WSP 在1 576 cm-1附近C-O-O 特征峰、1 414 cm-1附近C=O 双键伸缩振动峰均消失,据此推测贮藏后单糖组分与含量发生变化。这与前人的研究结果一致[25-26],表明贮藏过程中果实的软化与果胶结构和基团的破坏有密切关系。
2.6 光谱降维分析
利用PCA 方法对枣果样本的傅里叶红外光谱1 800~800 cm-1的数据进行降维分析,以突出多糖光谱之间的差异,样品在坐标轴间距离越大,则差异性越大[27]。如图7所示,每个数据点代表1个光谱,在图中分别显示了PC1(贡献率为73%)与PC2(贡献率为17%)和PC3(贡献率为9%)与PC2(贡献率为17%)的得分图,PC1、PC2、PC3 的累计贡献率为99%,表明3 个PC 能够反映原始数据信息[28]。SSP 的分数位于PC1 的负半轴,CSP的分数位于PC1 的正半轴,同时在PC1 上SSP(2)的分数几乎为零。随贮藏时间的变化,WSP 在PC1上得到了分离,WSP(1)在PC1 的负半轴,而WSP(2)在PC1 的正半轴。在两幅图中都可以沿着PC2线看到WSP 与CSP 的区别,WSP(1)、WSP(2)与PC2 呈明显正相关,CSP(1)、CSP(2)与PC2 呈明显负相关。
PC1 的载荷图谱(图7c)仅显示负值,在1 604,1 393,1 132,1 064,987,808 cm-1附近有强烈的峰出现,这些均符合果胶多糖光谱的特征,在1 064 cm-1处有最小负值,这主要是由多聚半乳糖醛酸中C-C、C=O 的伸缩振动和环振动引起的。PC2 在1 575 cm-1处出现了最大负值,这与果胶组分中WSP 的光谱最大特征相符。果胶组分在1 433与1 414 cm-1处均有特征吸收峰,但在PC 中得分均为负。

图7 贮藏初期(1)与贮藏末期(2)果胶物质傅里叶红外光谱的PCA 分析的得分图(a、b)及载荷图(c)Fig.7 Scores plots (a,b) and loadings plot (c) of PCA analysis of pectin in early storage (1) and late storage (2)
3 讨论与结论
本文研究了冷藏(4 ℃)过程中灵武长枣硬度、可溶性固形物与细胞壁组分的变化规律,分析了长枣软化机理。结果表明:随着贮藏期的延长,细胞壁硬度不断下降,在贮藏中期下降速率最快,贮藏末期硬度共下降了15.23%。可溶性固形物含量在贮藏期内不断波动变化,但波动范围不大,在贮藏后第7 天含量达到最高值为27.07%,在贮藏后第14 天含量达到最低值为25.95%。WSP 含量不断上升,在贮藏期内变化差异性显著(P<0.05),在贮藏第18 天达到峰值598.96 mg/100 g FW。CSP、SSP、HC 及CE 含量先上升后下降,在第14 天均出现拐点,之后开始不断下降。这主要与果实的自身代谢活动有关,一方面果实呼吸消耗基质,使含量降低;另一方面在酶的作用下果胶间不断转化改变,使WSP 含量上升。根据相关性分析发现:果实硬度与SSC、WSP 呈极显著相关,相关系数分别为0.9638,-0.8862,表明果实硬度与细胞壁WSP之间密切相关。
贮藏过程中果肉细胞从排列紧密的蜂窝状结构,发展到松散的有空隙结构,且膨胀弯曲。推断主要是由细胞壁果胶间的降解转化使WSP 含量升高所引起的。傅里叶红外光谱分析表明,由于脱氧的鼠李糖末端次甲基的摇摆振动,贮藏初期923 cm-1处由吡喃环引起的波峰在贮藏末期发生迁移,导致WSP 中吡喃糖苷键在贮藏过程中发生了改变,分析得吡喃糖苷键是引起枣果软化的主要因素。CSP 贮藏初期在1 433 cm-1处的吸收峰在贮藏末期消失,表明CSP 结构发生了改变,这可能与细胞壁果胶的相互转化有关。
综上所述,在灵武长枣贮藏熟软化过程中,果胶甲酯化程度降低,不溶性的果胶被降解为水溶性的果胶,导致细胞结构发生改变,细胞壁硬度下降,进而导致果实软化。
