P4及FSH处理对育成母羊卵泡发育和生殖激素分泌的影响
2022-10-24宋志攀段春辉岳思聪郭云霞刘月琴张英杰
宋志攀,段春辉,李 宇,岳思聪,郭云霞,刘月琴,张英杰
(河北农业大学 动物科技学院,河北 保定 071000)
通过使用外源激素处理调控母羊发情周期[1],达到短时间集中发情效果[2],可解决规模化养羊中发情不集中和繁殖率低的问题。埋植孕激素阴道栓期间,血液P4水平上调,负反馈抑制垂体前叶FSH和促黄体素(LH)分泌,影响黄体功能[3]。黄体期使用P4可以加速卵泡发育,减少大卵泡数量,维持大卵泡存在,促进中小卵泡闭锁[4-5],卵泡期使用P4减少大卵泡数量,降低排卵率[6-7]。在超排处理中,绵羊存在大卵泡会影响卵巢反应和胚胎产量[8-9],排卵后不久注射FSH可避免优势卵泡再次出现[10],提高黄体和胚胎数量[11-12]。RUBIANES等[13]研究表明,仅使用FSH,而不使用P4预处理,促发情作用较小。P4预处理可促进FSH生理功能[14],这种影响可能与其质量浓度有关,当基础质量浓度P4<0.5 μg/L 时,FSH处理可促进卵泡发育并增加卵泡数量。有研究显示,高质量浓度P4可提高卵母细胞受精率和胚胎质量[15],在FSH处理时补充P4,可能会增强卵巢反应[15],P4对FSH促卵泡发育起重要调节作用[16-17]。
绵羊发情周期不同阶段生殖激素分泌呈现动态变化[18],由于发情周期各阶段血液激素含量的差异,造成卵巢对外源生殖激素反应不同[19]。虽然前人研究证实了同期发情处理方法对生殖激素分泌有影响[20],但没有在同一生理状态下研究血清激素变化及与卵泡发育的关系。因此,本试验将试验羊先进行发情周期同步化处理,在生理状态基本一致的前提下,研究埋置P4阴道栓、肌注FSH及P4+FSH联合处理,在发情周期不同时间节点对卵泡发育及生殖激素的变化,探究P4和FSH对卵泡发育和激素分泌的影响,为优化羊同期发情技术提供理论依据。
1 材料与方法
1.1 试验时间及地点试验于2020年11-12月在河北省衡水市志豪畜牧科技有限公司进行。
1.2 试验动物与试验设计
1.2.1试验动物 试验选择体况良好、发情周期正常、体质量(35.16±1.66)kg的黄体期湖羊育成母羊,共80只。
1.2.2试验羊发情周期同步化处理 试验羊埋植氟孕酮海绵栓(MAP,45 mg/只,SYNCRITE-45 Vaginal Sponge,澳大利亚生产)5 d,撤栓前1 d肌注氯前列醇钠,每只羊剂量为0.1 mg(PGF2α,0.2 mg/支,宁波三生生物科技有限公司),撤栓同时肌注孕马血清促性腺激素,每只羊剂量为330 IU(PMSG,1 000 IU/瓶,宁波三生生物科技有限公司)。撤栓后60 h内的发情率为97.5%,选择撤栓后发情集中在24~48 h范围的72只发情同步化较好的试验羊进行接下来的试验。
1.2.3试验设计 同步化处理的试验羊撤栓5 d后记为正式试验的第0天。将72只试验羊随机分为9组,每组8只,1,2,3组在第0天埋植P4阴道栓,分别在第5,8,11 d撤栓;4,5,6组用FSH(500 IU/支,宁波三生生物科技有限公司)处理,分别在试验的第4,7,10 天肌肉注射FSH 2次(上午8:00注射70 IU,下午6:00注射30 IU);7,8,9组用P4阴道栓与肌肉注射FSH联合处理,在第0天埋植P4阴道栓,分别在第5,8,11天撤栓,并在第4,7,10天肌肉注射FSH 2次,时间剂量同4,5,6组。9组试验羊分别在试验第0,5,8,11天上午8:00撤栓后(没有埋栓组在相同时间节点)静脉采血5 mL,用于分析血清激素含量,并手术观察记录直径≥3 mm卵泡数量。试验设计具体步骤见图1。

注:1.G1~G9分别代表1~ 9组;2.横轴底端第1行数字表示试验处理天数,第2行括号中的数字表示处理天数所对应的发情周期中的天数(例:处理第0天为排卵后第3天即处于发情周期的第3天)
1.3 试验羊的饲养管理所有试验羊均舍饲养殖,饲喂全混合日粮(TMR),精粗比为2∶8,每日于7:00和16:30饲喂,自由饮水。
1.4 测定指标
1.4.1卵泡数量 在试验开始后的第5,8,11天上午8:00试验羊进行手术,将卵巢暴露于体外,记录双侧卵巢上≥3 mm的卵泡数量。
1.4.2生殖激素 各组试验羊分别在试验开始的第0 天(埋植阴道栓前)以及第5,8,11天上午8:00撤栓后(没有埋栓组在相同时间节点)静脉采血5 mL,静置2 h后3 500 r/min离心15 min(血清静置和离心均在4℃环境进行),分离血清并分装,-20℃ 保存待用。FSH、LH、PRL、P4、E2、MT等6种激素采用酶联免疫分析法(ELISA)测定,试剂盒均购自南京建成生物工程研究所,各激素测定标准品线性回归与预期浓度相关系数R值均在0.99以上。试验采用酶标仪检测试剂盒中标准品中激素含量,回归方程需要利用所得标准品D值进行计算,通过回归方程计算获得样本中FSH、LH、PRL、P4、E2、MT等激素含量。

2 结果
2.1 P4、FSH及处理时间互作对育成母羊卵泡数量的影响由表1可知,试验9组卵泡数显著高于1,2,3,4,5,7,8组(P<0.05),与6组差异不显著(P>0.05),试验6组卵泡数显著高于1,4,5组(P<0.05)。
2.1.1处理时间对各处理组卵泡数的影响 3个处理组随处理时间的延长,卵泡数量均呈上升趋势,P4处理中,试验3组(埋植阴道栓11 d)卵泡数量高于1组(埋植阴道栓5 d)和2组(埋植阴道栓8 d),但3个组间差异不显著(P>0.05)。FSH处理中,试验6组卵泡数量显著高于4组和5组(P<0.05),但是试验4,5组间差异不显著(P>0.05)。P4+FSH处理中,试验9组卵泡数显著高于7,8组(P<0.05),但是试验7,8组间差异不显著(P>0.05)。
2.1.2同一处理时间处理组对卵泡数的影响 在第5,8天,P4+FSH处理组的卵泡数量高于P4和FSH处理组,但是3组间差异不显著(P>0.05);在第11天,P4+FSH处理组的卵泡数量显著高于P4处理组(P<0.05),与FSH处理组差异不显著(P>0.05)。
2.1.3处理组、处理时间及两者交互作用对卵泡数的影响 P4及FSH处理组间卵泡数量差异不显著(P>0.05),但是P4+FSH处理组卵泡数量有增加趋势,比FSH组和P4组分别高38.02%和47.12%;处理时间对卵泡数影响极显著(P<0.01),第11天的卵泡数量极显著高于第5,8天(P<0.01);处理组与时间交互对卵泡数量未产生显著影响(P>0.05)。
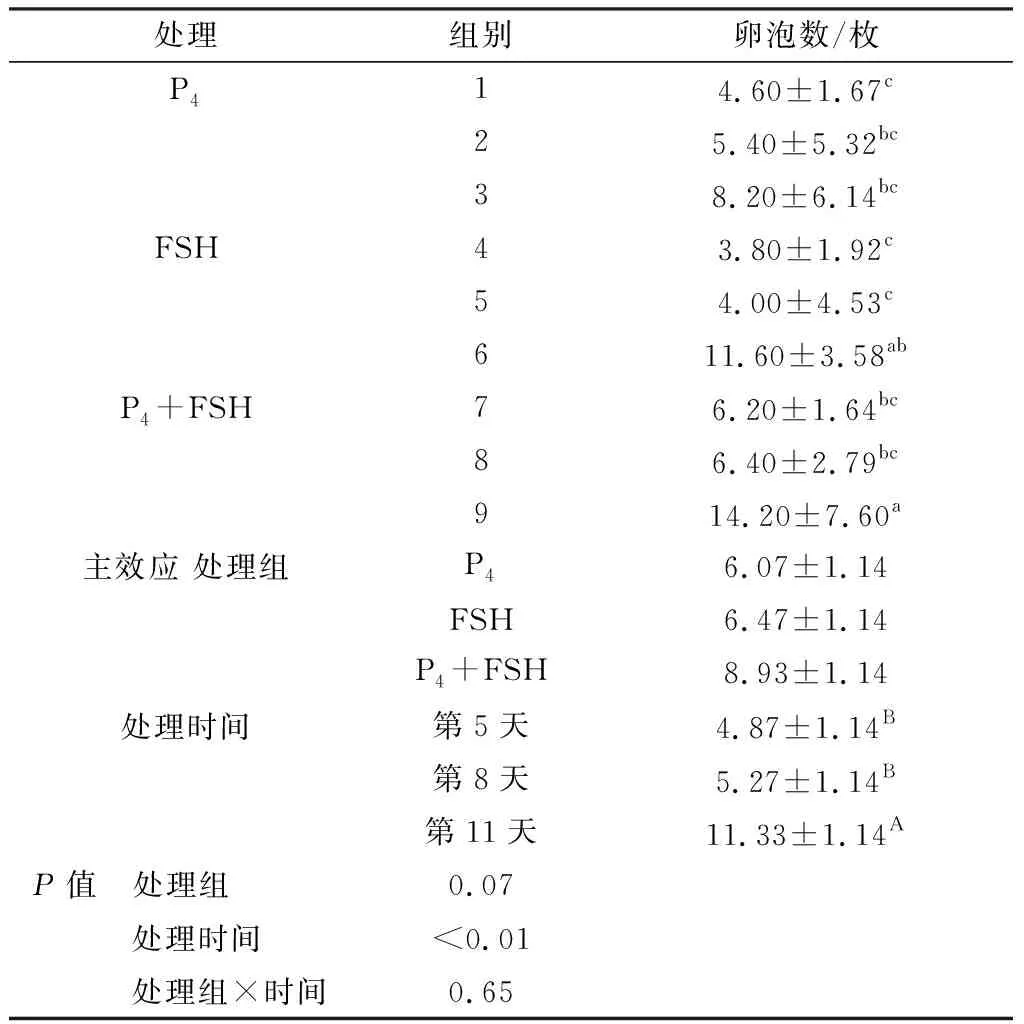
表1 P4及FSH处理对育成母羊卵泡数量的影响
2.2 P4、FSH及处理时间互作对育成母羊生殖激素分泌的影响对第0 天各个试验组FSH、LH、PRL、P4、E2、MT血清中激素含量分析结果显示,9个组间,P4、FSH及P4+FSH各处理组间差异均不显著,为此,表2中0 d激素数据采用了所有试验羊数据的平均值±标准差。
2.2.1激素含量对育成母羊生殖激素分泌的影响 由表2可知,FSH浓度试验3组和7组显著高于1组(P<0.05),其他组间差异不显著(P>0.05);LH初始组浓度及3,4,7,9组显著高于1组(P<0.05),且试验7组显著高于2组(P<0.05),其他组间差异不显著(P>0.05);PRL质量浓度试验1组比初始浓度及5,7,8,9组显著增加(P<0.05),其他组间差异不显著(P>0.05);P4质量浓度试验1组比初始浓度及其余组显著增加(P<0.05),试验7组比初始浓度及1,2,3,5,6组显著降低(P<0.05),其他组间差异不显著(P>0.05);除试验2组外,E2质量浓度试验1组均显著低于其他各组(P<0.05);MT浓度试验7组显著高于1,2组,其他组间差异不显著(P>0.05)。
2.2.2处理时间对处理组生殖激素的影响 P4处理中,埋栓11 d 的3组FSH、LH和E2含量显著高于埋栓5 d的1组(P<0.05),与初始浓度和2组(处理8 d)无显著差异(P>0.05);P4质量浓度试验1组显著高于初始及2,3组(P<0.05),试验2,3组与初始浓度无显著差异(P>0.05);PRL质量浓度试验1组显著高于初始浓度(P<0.05),与试验2,3组无显著差异(P>0.05);MT浓度在不同组间无显著差异(P>0.05)。FSH处理中,各组间血清中FSH、LH、PRL、P4、E2、MT等含量无显著差异(P>0.05),即不同时间节点注射FSH对试验羊血液中FSH、LH、PRL、P4、E2、MT等激素浓度无影响。P4+FSH处理中,试验7组P4浓度显著低于初始浓度(P<0.05),与试验8,9组无显著差异(P>0.05);各组间血清中FSH、LH、PRL、E2、MT等含量无显著差异(P>0.05),即不同时间节点埋植孕酮阴道栓联合注射FSH对试验羊血液中FSH、LH、PRL、E2、MT等激素浓度无影响。
2.2.3同一处理时间处理组对生殖激素的影响 在试验的第5天,FSH、LH和MT含量P4+FSH处理组显著高于P4组(P<0.05),与FSH组无显著差异(P>0.05);E2含量P4+FSH和FSH处理组显著高于P4组(P<0.05);PRL含量P4处理组显著高于P4+FSH组(P<0.05),与FSH组无显著差异(P>0.05);P4含量P4组显著高于P4+FSH和FSH处理组(P<0.05)。第8,11天,各处理间生殖激素无显著差异(P>0.05)。
2.2.4处理组、处理时间及两者交互作用对生殖激素的影响 PRL含量P4处理组和FSH处理组极显著高于P4+FSH处理组(P<0.01);P4含量 P4处理组极显著高于FSH组和P4+FSH组(P<0.01);LH和MT含量P4+FSH处理组显著高于P4组(P<0.05),与FSH组无显著差异(P>0.05);E2含量FSH处理组和P4+FSH处理组显著高于P4组(P<0.05)。处理时间对生殖激素无显著影响(P>0.05)。处理组与处理时间交互极显著影响了P4水平(P<0.01)。
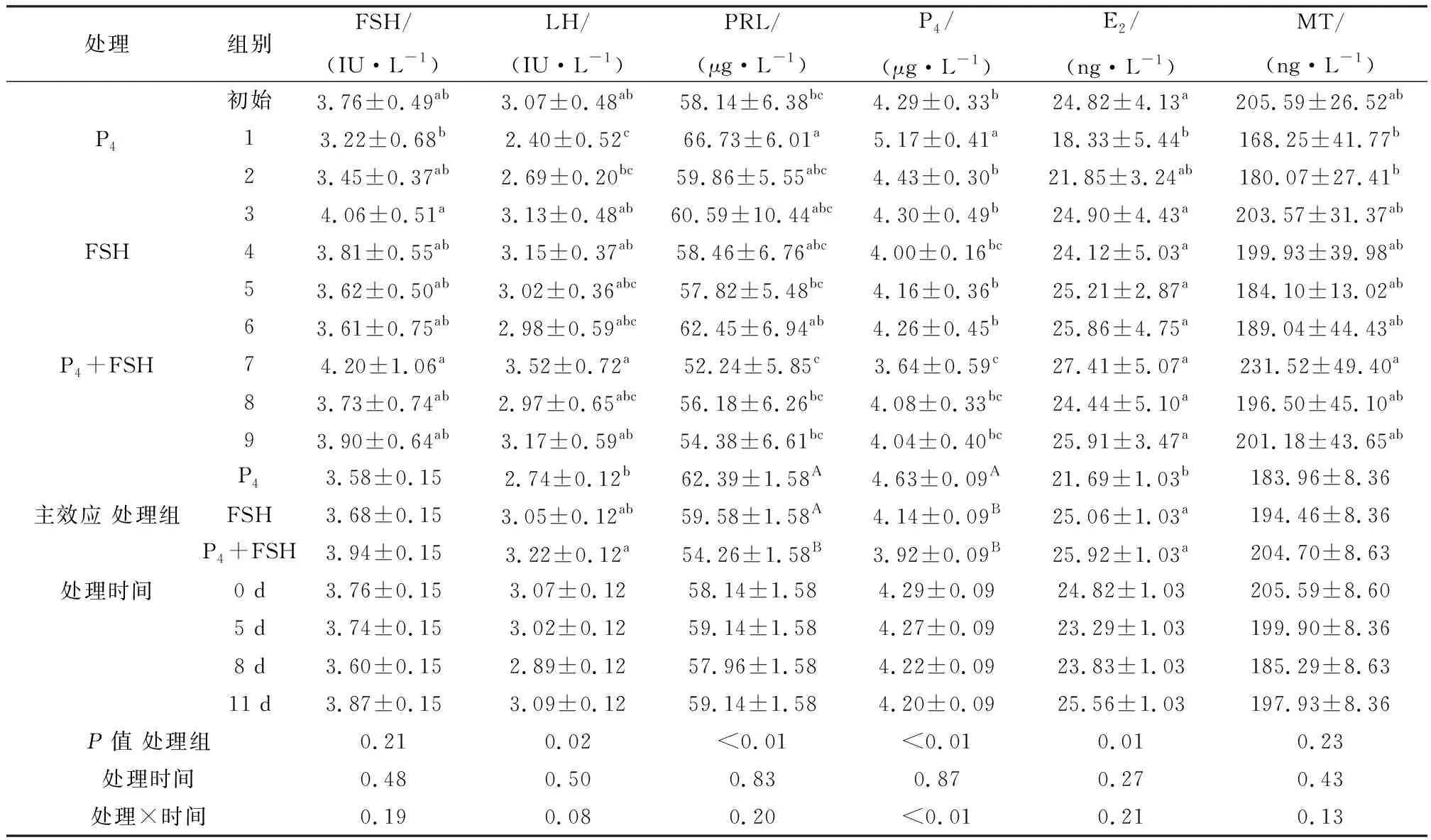
表2 P4及FSH处理对育成母羊生殖激素分泌的影响
3 讨论
3.1 P4及FSH处理对育成母羊卵泡发育的影响卵泡位于卵巢皮质部,随着雌性动物年龄的增长卵泡数量不断减少,多数卵泡在排卵前闭锁退化,只有少数卵泡发育成熟并破裂排卵[21]。FSH对维持窦状卵泡生存是必须的,FSH不足会导致卵泡无法形成对FSH的高敏感性而促使卵泡发生程序性细胞死亡,随着上一个黄体期P4、E2、抑制素A水平降至最低促进了下一个性周期FSH不断升高,从而启动卵泡成熟[22]。本试验结果显示,在黄体期进行3次FSH处理(间隔3 d),第3次处理后卵泡数量显著高于前2次,说明在黄体末期(退化前)进行FSH处理的促卵泡发育作用较大。P4随着发情周期中黄体的形成而增加,并随下一次发情前黄体的退化而减少。黄体期血液中P4质量浓度升高,对下丘脑和腺垂体产生反馈抑制,使促性腺激素释放激素(GnRH)分泌减少,导致FSH和LH浓度下降,从而抑制卵泡发育和排卵[23]。本试验结果显示,P4处理组卵泡数量最低,且P4组在第5天的卵泡数量最少,第11天卵泡数量升高,但与第5,8天无差异,说明阴道埋置P4栓随着埋置时间的延长,P4含量有所下降,对卵泡发育的抑制作用减弱。P4处理组3个埋栓时间卵泡数量无显著差异,这可能是外源补充P4抑制卵泡发育的直观体现[23],虽然P4处理组第11天卵泡数量开始上升,但无显著差异,说明黄体未完全溶解且外源P4对卵泡发育仍存在抑制作用。NOЁL等[24]使用羊埋置孕酮栓14 d,撤栓同时肌注PMSG 800 IU,结果显示血液中P4浓度升高加速了卵泡生长,但减少了大卵泡的数量,提高了闭锁率;PMSG处理提高了血液中FSH浓度,促进了小卵泡的募集和排卵率[25]。李俊杰等[26]对母羊埋置硅胶阴道栓(CIDR)14 d,于放入CIDR的第10天开始连续3 d注射FSH(2次/d),撤栓同时肌注PG 0.1 mg,结果显示撤栓后P4水平迅速下降,数小时回到基础水平,使大量卵泡发育成熟、排卵并形成黄体。本研究也取得类似的结果,虽然各处理组对卵泡数无显著影响,但P4+FSH处理组的卵泡数比FSH组和P4组分别高38.02%和47.12%,且P4+FSH组在第11天的卵泡数显著高于第5,8天,说明血液中P4水平对FSH促使卵泡发育的作用影响较大,黄体期低P4水平更有利于外源FSH发挥促排卵作用[13]。
3.2 P4及FSH处理对育成母羊生殖激素分泌的影响FSH和LH由垂体前叶合成并释放,FSH作用于卵巢刺激卵泡生长发育和成熟[27-28]。LH是主要的排卵激素和黄体功能调节因子[29],通过与促黄体素受体(LHR)结合启动信号级联反应,促进雄激素合成,FSH与促卵泡激素受体(FSHR)结合促进细胞色素P450芳香化酶(CYP19A1)释放,将雄激素转化为E2[30]。本试验结果显示,各处理组FSH和LH的变化趋势一致。P4+FSH组在第5天 FSH和LH含量最高,可能是由于第5天(黄体前期)撤栓后,血液中高质量浓度P4突然下降,对下丘脑和腺垂体抑制作用减弱,GnRH分泌增多,从而导致FSH和LH浓度升高[23],促进卵泡发育,因此从激素内分泌的角度看,P4和FSH联合应用诱导母羊发情处理5 d可实现促卵泡发育,缩短常规同期发情的时间在理论上可行,本试验利用P4+PMSG+PG方法进行发情周期同步处理,撤栓后60 h内的发情率高达97.5%,印证了短周期同期发情效果。P4组在第5天时FSH和LH浓度最低,说明在此时下丘脑和腺垂体对P4质量浓度的反应不敏感,而撤栓前应用外源FSH更有利于解除高质量浓度P4对下丘脑和腺垂体的抑制作用;P4组FSH和LH在第11天质量浓度最高,说明在黄体后期下丘脑和腺垂体对P4质量浓度较前期敏感,单独使用P4诱导发情的处理时间应在10 d以上。FSH组的FSH和LH在各时间点的浓度变化不大,说明在黄体期使用外源FSH与其对卵泡发育的调控作用不大。本试验结果显示,各处理组对血清FSH浓度无影响,但P4处理组最低,处理显著影响了LH的分泌,P4+FSH组LH浓度显著高于P4组,P4处理组P4质量浓度极显著高于P4+FSH和FSH组,因此高质量浓度的P4负反馈抑制了下丘脑和腺垂体,GnRH分泌减少,从而导致FSH和LH浓度降低[23]。
PRL是垂体前叶分泌的蛋白质类激素,通过与卵泡上催乳素受体(PRLR)结合,调节哺乳动物生殖功能[31]。小剂量PRL通过刺激黄体LHR生成,促进卵泡发育排卵[23],表明低浓度PRL对卵泡发育具有促进作用。MT是由松果腺分泌的,其分泌受光照周期的调节,是调控动物季节性繁殖的主要激素,主要通过下丘脑-垂体-性腺轴调控季节性发情动物的性腺发育和生殖行为[32]。高质量浓度的MT会抑制PRL释放,刺激GnRH和促性腺激素的释放,从而增强性腺活动;当MT质量浓度较低时,PRL质量浓度升高,性腺活动受到抑制[33]。本试验结果显示,P4+FSH组PRL质量浓度极显著低于FSH组和P4组,MT质量浓度高于P4组,说明P4+FSH组可通过调节PRL和MT促进卵泡发育,因此P4+FSH组卵泡数量多于FSH和P4组。P4+FSH组和FSH组均在第5天时MT质量浓度最高、PRL质量浓度最低,此时性腺活动最强,因此推断P4和FSH联合应用诱导母羊发情的最佳处理时间为5 d,FSH单独使用促进卵泡发育时第4天注射效果优于第7,11天。P4组在第11天时MT质量浓度最高,PRL处于较低水平,说明单独使用P4诱导发情的处理时间在10 d以上时效果较好。
P4是主要由黄体分泌的一种类固醇激素,可通过调节卵巢功能,使卵巢由静止状态转为活跃状态,促进母羊发情和排卵[34]。孙爽等[35]研究发现,各组试验羊在埋栓第5天 P4质量浓度最高,撤栓时P4质量浓度降低。有研究表明,撤栓时P4质量浓度的降低有效抑制了卵泡波的持续发生,并启动卵巢活动[36]。本试验结果显示,P4+FSH和FSH组P4质量浓度极显著低于P4组,卵泡数量均多于P4组,表明P4和FSH联合使用或FSH单独使用对卵巢活动的促进作用优于单独使用P4,可能是因为P4+FSH和FSH组在肌注FSH后,黄体功能分泌降低,从而导致P4质量浓度降低[37-38]。P4组在黄体晚期(第11天),由于埋栓时间延长P4质量浓度降低,低质量浓度P4与E2协同作用促进卵泡发育[39]。
E2是主要由卵巢颗粒细胞分泌的类固醇激素,与雌激素受体(ER)结合,以自分泌方式刺激卵泡发育[40]。LH波出现前3~4 d E2浓度开始缓慢上升,LH峰出现的12 h前急剧升高,LH峰出现当天达最大值,之后迅速下降[41],因此E2的高峰时期大致与LH峰出现的时间一致。SCARAMUZZI等[42]发现,发情期绵羊的卵巢静脉和外周静脉血液E2和LH的含量变化与排卵相关,在排卵时含量显著升高。本试验结果显示,P4+FSH组和P4组E2的质量浓度变化与LH变化一致,因此P4和FSH联合处理或P4单独处理用于诱导发情与自然周期中卵泡发育的内分泌调控较接近。黄体期低水平P4对FSH和LH分泌的负反馈作用较弱,使FSH和LH分泌增加,E2分泌增加,表明低质量浓度P4与E2协同作用可促进中小卵泡的发育[43]。本试验结果显示,P4+FSH组第5,11天及P4组第8,11天撤栓时均表现P4质量浓度降低,E2质量浓度升高,说明P4和FSH联合处理或P4单独处理均可用于诱导母羊卵泡发育。
母羊黄体末期肌注FSH 100 IU促卵泡发育效果较好,平均卵泡数为11.60枚; P4埋栓11 d,撤栓前1 d 肌注FSH 100 IU促卵泡发育效果更佳,平均卵泡数为14.20枚。
