致犊牛脑炎大肠杆菌分离鉴定、耐药性及毒力基因检测
2022-10-24操义恒张丽媛韩猛立吴桐忠张星星钟发刚
操义恒,马 雪,张丽媛,李 劼,周 霞*,黄 新,韩猛立,吴桐忠,张星星,钟发刚
(1.石河子大学 动物科技学院,新疆 石河子 832003;2.新疆农垦科学院 省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆 石河子 832000)
细菌性脑炎是人和动物严重的致死性感染性疾病,在患病后不治疗的情况下,病死率接近100%,能够引起动物脑炎的细菌性病原主要有大肠杆菌、链球菌、金黄色葡萄球菌、李斯特菌等[1]。其中,大肠杆菌(E.coli)是导致脑炎的重要病原菌。因大肠杆菌感染宿主及其部位不同可以分为肠道致病性大肠杆菌和肠外致病性大肠杆菌(extraintestinal pathogenicEscherichiacoli,ExPEC)[2]。ExPEC中的新生儿脑膜炎大肠杆菌(neonatal meningitisEscherichiacoli,NMEC)是28%~29%的新生儿细菌性脑炎病例的病原体,在兽医临床中ExPEC也常引起动物脑炎、败血症、肺炎等,临床发病率与病死率较高[3-4]。
E.coli毒力因子包括黏附素、毒素、自身转运蛋白、铁摄取因子、脂多糖、外膜蛋白等,它们通常由致病岛、质粒和其他一些可移动遗传元件编码,与致病性有密切关系[5-6]。此外,E.coli抗生素耐药性也是引起动物感染难以控制的另一主要原因,其与细菌本身获得传递质粒和其他编码耐药性基因的可移动遗传元件有关。研究表明,E.coli的可移动遗传元件可以在相关细菌或不同家族的细菌之间水平交换,由此增加了不同细菌之间交换某些毒力及耐药基因的几率,导致细菌致病力增强[7]。近年来,抗生素的广泛使用导致了E.coli耐药性显著增加,尤其对第3代头孢菌素和氟喹诺酮类药物耐药更加普遍[8]。
2020年6月,新疆石河子市某规模化养殖场部分犊牛出现以行为失常、持续尖叫、对外界反应迟钝等神经症状为主要特征的疾病,从出现明显临床症状到死亡时间短暂。流行病学调查结果显示:6月死亡3头,7月产仔33胎死亡3头,8月产仔32胎死亡3头,8月产仔32胎死亡2头,9月产仔21胎死亡3头,11月产仔20胎发病6头。11月中旬送检病牛剖检发现,患病犊牛大脑表面出血,脑后侧出现灰色梗死,肺脏有出血,出血面积覆盖整个肺大叶,脾脏有出血点,肠系膜淋巴结水肿,小肠浆膜有大量出血点。因此,本试验应用常规细菌分离鉴定方法从病变组织中分离鉴定细菌,并对分离株进行动物致病性试验、药物敏感性研究以及检测携带耐药基因和相关毒力基因情况,以期为新疆地区犊牛大肠杆菌病的防制研究提供基础。
1 材料与方法
1.1 病料来源及试验动物病料取自新疆石河子市某规模化养殖场送检的因神经症状死亡的7日龄犊牛;1月龄昆明系小鼠购自新疆医科大学实验动物中心。
1.2 药品及试剂21种药敏纸片购自杭州天和微生物试剂有限公司;细菌基因组DNA提取试剂盒购自天根生化科技有限公司;dNTP Mix、ddH2O、Marker等购自TaKaRa公司;PCR仪购自德国Biometra公司;凝胶成像仪购自美国BIO-RAD公司;细菌生化鉴定仪(VITEK 2 COMPACT)购自法国梅里埃生物公司。
1.3 病原分离纯化无菌采集病死犊牛的脑、肺脏、肠系淋巴结等病变明显的脏器组织,接种BHI琼脂平板培养后观察菌落形态,挑取单菌落进行革兰染色并镜检。
1.4 生化鉴定及16S rRNA基因序列分析将分离株按照全自动细菌生化鉴定仪要求进行生化鉴定,共选用47种生化鉴定反应。按照细菌基因组DNA提取试剂盒说明书提取纯化菌的DNA,参考文献[9]合成16S rRNA基因通用引物进行16S rRNA基因PCR扩增,引物具体信息见表1。50 μL扩增体系为dNTP Mix 25 μL、ddH2O 22 μL、上下游引物和扩增模板各1 μL。扩增产物送上海生工生物工程股份有限公司测序,测序结果在NCBI数据库中进行同源性分析。
1.5 小鼠致病性试验将20只雌雄各半的小鼠随机分为试验组和对照组,每组5只。按0.2 mL/只(1.7×109CFU/mL)剂量腹腔注射菌液,对照组腹腔注射等量灭菌PBS。观察并记录小鼠状态和死亡情况,剖检死亡小鼠并从脑、肺脏、肝脏、脾脏等脏器上分离细菌并进鉴定。
1.6 药敏试验按美国临床标准委员会(NC- CLs) 推荐的 Kirby-Bauer 纸片扩散法对青霉素(P)、阿莫西林(AMX)、头孢他啶(CAZ)、头孢唑啉(KZ)、头孢拉定(CE)、头孢哌酮(SCF)、链霉素(STR)、庆大霉素(GEN)、多西环素(DOX)、麦迪霉素(MD)、氟苯尼考(FFC)、丁胺卡拉(AK)、多黏菌素B(PB)、诺氟沙星(NOR)、恩诺沙星(EN)、环丙沙星(CIP)、左氧氟沙星(LEV)、复方新诺明(SMZ)、阿奇霉素(AZM)、替考拉宁(TEC)、克林霉素(DA)进行药敏试验。
1.7 耐药基因检测根据参考文献[10]选择以下17种耐药基因作为检测对象。其中,β内酰胺类有blaTEM、blaSHV、blaCTX-M;磺胺类有sul1、sul2、sul3;喹诺酮类有aac(6’)-Ib、oqxAB、qnrA、gyrA;氨基糖苷类有aadA1、aadB、aacC2、aph(3’)-Ia;四环素类有tetA、tetB、tetC。引物具体信息见表1,20 μL扩增体系为dNTP Mix 10 μL,ddH2O 7 μL,上、下游引物和扩增模板各1 μL。耐药基因引物均由上海生工生物工程股份有限公司合成。
1.8 毒力基因检测根据参考文献[11]选择以下22 种毒力基因作为检测对象。黏附素类有crl(curli菌毛)、fimH(Ⅰ型菌毛)、papC(P菌毛)、sfaS(s/fic菌毛)、K88(F4菌毛)、eaeA(紧密黏附素)、K99(F5菌毛)、fliC(鞭毛)、kpsMⅡ(二型荚膜多糖);毒素类有stx1(志贺毒素1)、hlyA(α溶血素)、hlyE(溶血素E)、astA(肠聚集性大肠杆菌毒素)、iucD(气杆菌素)、cnfI(细胞毒性坏死因子)、malX(高致病性毒力岛)、irp2(耶尔森强毒力岛)、ibeA(脑内皮侵袭因子)、ompA(外膜蛋白A)、ompC(外膜蛋白C)、ompF(外膜蛋白F);铁摄取系统有ireA(嗜铁素受体)。引物具体信息见表1。20 μL 扩增体系为dNTP Mix 10 μL,ddH2O 7 μL,上、下游引物和扩增模板各1 μL。毒力基因引物均由上海生工生物工程股份有限公司合成。

表1 试验所需引物序列信息

续表1
2 结果
2.1 病原分离纯化无菌采集病死犊牛的脑、肺脏和淋巴结等组织进行分离鉴定,得到3株分离株,其中1株于脑组织分离得到(F3),2株于肺脏分离得到(F1和F2)。3株菌在BHI琼脂平板上长出具有边缘光滑整齐,圆形的白色菌落;革兰染色可见两端钝圆的短小阴性杆菌。
2.2 生化鉴定及16S rRNA基因序列分析使用全自动细菌生化鉴定仪对分离菌株进行47项生化鉴定,分离菌株产生赖氨酸脱羧酶,不产生氧化酶、DNA酶和苯丙氨酸脱氨酶,不产生H2S,利用乳糖,不分解D-阿东醇、D-纤维二糖和柠檬酸盐等,是E.coli的可信度为90%~99%。PCR扩增16S rRNA 基因序列得到1 500 bp目的条带,其序列与GenBank数据库E.coli参考株FJ949577.1、KT260578.1、MH255532.1的同源性在99.9%以上,最终确定3株分离株为大肠杆菌。
2.3 小鼠致病性试验试验组小鼠感染后表现为食欲废绝、精神萎靡、被毛蓬松、畏寒扎堆、共济失调、死后身体呈角弓反张。对照组小鼠无变化未死亡。3株E.coli分离株分别在8,12,22 h开始死亡,F1在30 h时全部死亡,F2在22 h时全部死亡,F3在32 h死亡2只。试验组小鼠在解剖后表现为脑大面积出血,肺脏、脾脏、肝脏和心脏有不同程度的肿大和出血,肠段松软、肿胀,肠壁变薄。且从发病死亡小鼠肺、脾、脑等脏器中均分离到感染细菌。
2.4 药敏试验3株分离菌对β-内酰胺类的青霉素、阿莫西林、头孢他啶、头孢唑啉、头孢拉定,氨基糖苷类的链霉素和庆大霉素,四环素类的多西环素,大环内酯类的麦迪霉素,氯霉素类的氟苯尼考,喹诺酮类的诺氟沙星、恩诺沙星、环丙沙星,磺胺类的复方新诺明,万古霉素类的替考拉宁,林肯霉素类的克林霉素表现出100%耐药。F1对头孢哌酮、丁胺卡拉、左氧氟沙星耐药。F2和F3对头孢哌酮、左氧氟沙星中度敏感,对丁胺卡拉表现出高度敏感。3株分离菌都对多肽类的多黏菌素B、大环内酯类的阿奇霉素表现出高度敏感,具体结果如表2所示。
2.5 耐药基因检测对分离到的3株E.coli进行17种耐药基因检测,结果发现F1共检测出12种耐药基因,F2共检测出8种耐药基因,F3共检测出9种耐药基因。3株E.coli均检测到β-内酰胺类的bla-CTX-M,磺胺类的sul1、sul2,喹诺酮类的gyrA,氨基糖苷类的aadA1、aacC2、aph(3’)-Ia,四环素类的tetB共8种耐药基因。F1还检测出blaTEM、aac(6’)-Ib、oqxAB、tetA共4种耐药基因,F3也检测出blaTEM基因。3株分离菌均未检测到blaSHV、sul3、qnrA、aadB、tetC等6种耐药基因,具体结果见图1和表2。

1~3.blaTEM;4~6.blaCTX-M;7~9.sul2;10~12.gyrA;13~15.aadA1;16~18.aph(3’)-Ia;19~21.tetA;22.DL2000 DNA Marker;23.阴性对照
2.6 毒力基因检测对分离到的3株E.coli进行22种毒力基因检测,结果发现F1共检测出10种毒力基因,F2共检测出9种毒力基因,F3共检测出11种毒力基因,其中crl、papC、hlyE、iucD、malX、irp2、ompA、opmC、ompF共9种毒力基因在3株E.coli中都被检测到,F1还检测出fimH,F3检测出fimH和K88。剩下的stx1、hlyA、astA、ibeA、kpsMⅡ、cnfI、sfaS、filC、k99、eaeA、ireA共11种毒力基因均未被检测出,具体结果见图2和表2。
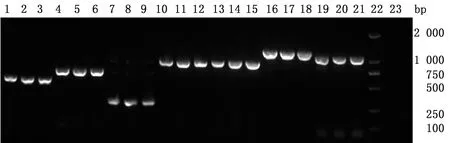
1~3.hlyE;4~6.IucD;7~9.papC;10~12.malX;13~15.ompA;16~18.ompC;19~21.ompF;22.DL2000 DNA Marker;23.阴性对照

表2 分离菌株的毒力基因、药物敏感性及耐药基因检测结果
3 讨论
近年来,ExPEC对人类健康和养殖业造成巨大的威胁。CLERMONT等[12]通过研究动物源和人源致病性E.coil遗传进化背景,提出根据E.coli携带某些特定毒力基因的种类和数量(≥2)可初步确定分离株是否为ExPEC。在我国,由细菌引发的脑膜炎中有50%以上是ExPEC所导致的,此类菌株可穿越血脑屏障进入中枢神经系统,引起新生儿脑膜炎,继而可能引起菌血症、败血症等更严重的疾病[13-14]。LI等[15]从以败血症和神经系统疾病为特征的犬大脑中分离到E.coli,并用小鼠模型证明分离的E.coli具有引起败血症和脑膜脑炎的能力。美国一项关于婴幼儿脑炎评估报告表明,由E.coli和B族链球菌引起的脑炎仍然是婴儿细菌性脑炎的最常见原因[16]。许丹丹[17]从2头神经症状死亡犊牛的脑脊液和肝脏中分离到3株E.coli,用其人工感染家兔可导致脑组织损伤,呈现化脓性脑炎变化。本试验从发生一系列神经症状的犊牛病理变化明显的脑组织和肺脏中也分离到E.coil,说明这类细菌在人和动物中的感染已较为普遍。
gyrA和gyrB是编码E.coli螺旋酶A和B 2个亚基的基因,当其中1个基因发生变化时,导致E.coli对喹诺酮类药物的耐药性。本试验3株E.coli分离菌均携带有gyrA基因,因此对喹诺酮类药物表现出高度耐药,对诺氟沙星、恩诺沙星、环丙沙星的耐药率高达100%。产CTX-M型超广谱β-内酰胺酶菌株对公共卫生的威胁最大,在巴基斯坦健康家畜肠杆菌的传播过程中,blaCTX-M的携带率最高(73.9%),其次是blaTEM(26.1%)和blaSHV(14.2%),这与德国69.9%和尼日利亚44.7% 的blaCTX-M检测结果一致[18-19]。肠杆菌科细菌可以通过突变或水平转移质粒获得超广谱β-内酰胺酶基因,从而导致头孢菌素耐药[20]。本试验中检出了blaCTX-M和blaTEM基因,对青霉素、阿莫西林、头孢他啶、头孢唑啉、头孢拉定等β-内酰胺类药物的耐药率高达100%。有研究表明,我国ExPEC对第3代头孢菌素和氟喹诺酮类药物的耐药率略有下降,但仍处于较高水平(>50%),因此合理用药已成为防止各类药物耐药率继续上升的当务之急。
ExPEC致病性相关的毒力因子较多,在增加ExPEC的毒力方面发挥重要作用。本试验检出了可以编码curli菌毛、P菌毛和1型菌毛的crl、papC、fimH基因,其可增加菌体对靶细胞的黏附能力。有研究表明,当菌株同时携带编码fimG/fimH(1型菌毛基因)、sfaD/sfaE(S菌毛基因)、papC(P菌毛基因)和afa/dra(A菌毛样黏附素)中的2种黏附因子时,其进入循环系统的概率明显增高[21]。本试验从F1和F3菌株中均检测到fimH和papC基因,其可增强分离株在犊牛和感染小鼠的脑部定植。OmpA是ExPEC一种重要的结构蛋白,不仅可以保证菌体完整性,而且有助于NMEC跨越血脑屏障进入人脑微血管内皮细胞(HBMEC),并在血液中持续存在[22]。周磊等[23]检测的54株猪源ExPEC均携带ompA基因,顾晓晓等[11]检测的104株牛源ExPEC和28株羊源ExPEC中共检测出103株携带有ompA基因,本试验分离株同样也检测到该基因,表明ompA存在于大部分E.coli中,这可能与E.coli能突破血脑屏障进入脑部定植有关。此外,本试验发现3株分离株的致病力差异较大,但检出的毒力基因差异不大,该现象有待进一步研究。
