宿主通过激活NLRP3信号通路抑制HY12肠道病毒的复制
2022-10-24王浴光胡俊英常晓冉古丽巴哈尔图尔荪胡卉琪王新平
王浴光,胡俊英,章 凡,常晓冉,古丽巴哈尔·图尔荪,张 群,胡卉琪,王新平.2*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.吉林大学 教育部人兽共患病研究重点实验室,吉林 长春 130062)
肠道病毒(enterovirus,EV)是一类能够引起动物和人类消化系统和呼吸系统疾病的病毒,属于小RNA病毒科肠道病毒属。依据病毒的最新分类,肠道病毒属目前共分为12个肠道病毒种和3个鼻病毒种。研究发现,不同种肠道病毒具有不同的致病机理及动物种属特异性[1]。肠道病毒HY12毒株为本实验室从呈现严重腹泻和呼吸道症状为主要特征的牛群中分离获得的国内首株E种肠道病毒[2]。据报道,该病毒具有独特的生物学特性及5-UTR二级结构;病毒能够通过口鼻、腹腔注射、肌肉注射和静脉注射等多种途径感染小鼠,且具有组织器官的泛嗜性[3]。同时,小鼠感染HY12病毒后通过干扰素调节因子3 (interferon regulatory factor 3,IRF3)和干扰素调节因子7(interferon regulatory factor 7,IRF7)介导激活干扰素通路,抑制病毒的复制。此外,病毒在感染小鼠48 h后,其体内载量突然增强且感染18 d后仍能从其体内检测到病毒,说明病毒具有独特的免疫逃避机制[4]。
NLRP3炎性小体信号通路通过控制多种促炎性细胞因子的成熟与分泌调节炎性反应及相关免疫细胞的功能,是先天性免疫的一个重要组成成分。该信号通路能够识别多种病原相关分子模式(pathogen-associated molecule pattern,PAMP)和危险相关分子模式(damage-associated molecule pattern,DAMP),促进细胞产生IL-1β、IL-18等细胞因子,介导机体抗感染免疫反应[5]。但是,过度炎性反应会激活细胞中Gadermin D蛋白自身活化并寡聚在细胞膜上形成孔道结构,引起细胞内容物的释放,导致细胞的焦亡[6]。研究表明,NLRP3与很多先天性免疫疾病有关,如肥胖、2型糖尿病和动脉粥样硬化等[7],但有关牛肠道病毒的致病机制和宿主抗病毒感染免疫反应的研究以及NLRP3炎性小体信号通路对牛肠道病毒复制的影响在国内外尚未见有报道。为了探索NLRP3炎性小体信号通路对HY12病毒感染及复制的影响,本试验利用Q-PCR和Western blot等方法,以小鼠原代巨噬细胞,NLRP3敲除小鼠原代巨噬细胞和RAW264.7细胞为模型,开展了HY12感染对NLRP3炎性小体信号通路及该通路的激活对病毒自身感染与复制的影响研究,以期为牛肠道病毒的致病机制和宿主抗病毒感染的研究及该病的防控奠定基础。
1 材料与方法
1.1 病毒株、细胞及试验动物E种肠道病毒HY12毒株分离于临床上呈现严重消化道与呼吸道症状的牛群[2],由本实验室保存。RAW264.7细胞(ASC基因缺失小鼠巨噬细胞系)由吉林大学动物医学学院微生物与免疫学教研室慧赠。NLRP3敲除鼠由吉林大学动物医学学院寄生虫实验室慧赠。ICR小鼠购买自辽宁长生生物技术有限公司。
1.2 主要试剂兔源ASC抗体、鼠源NLRP3抗体、鼠源GAPDH抗体、鼠源IL-1β抗体均购买至Affinity Biosciences公司。兔源HY12-VP1抗体和鼠源HY12-VP2抗体由本实验室制备保存。Q-PCR引物由上海生工生物工程有限公司合成。M-MLV反转录酶,Q-PCR酶混合物购自TaKaRa有限公司。ATP、LPS、PAGE凝胶制备试剂、PVDF膜购买自北京索莱宝科技有限公司。BCA试剂盒购自赛默飞世尔科技公司。IL-1β ELISA定量检测试剂盒购自Biolegend公司。1640培养液和血清购自HyClone公司。
1.3 细胞培养RAW264.7细胞与原代巨噬细胞培养于含有10%胎牛血清1640培养基中。原代腹腔巨噬细胞的分离参考文献[8]进行。细胞于37℃、5%CO2细胞培养箱中培养。
1.4 引物设计利用NCBI网站引物在线设计扩增NLRP3、IL-1β和Caspase-1基因的Q-PCR引物,引物序列如表1所示。
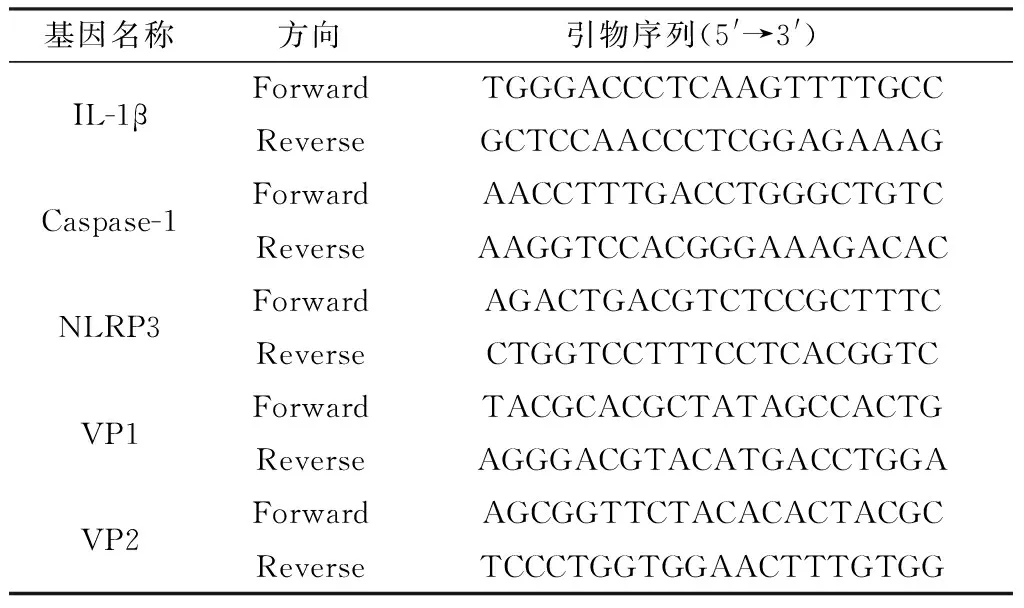
表1 Q-PCR的引物序列
1.5 Western blot检测目的蛋白将细胞上清弃掉,以Hanks缓冲液轻轻洗涤细胞2次后,加入1×Lysis Buffer 100 μL,轻轻晃动,充分裂解细胞。收集细胞液于4℃、12 000 r/min离心10 min,取上清,经过BCA试剂盒测定蛋白浓度并稀释后加入5×蛋白上样缓冲液,煮沸10 min,冷却至室温后进行SDS-凝胶电泳[9]。湿法电转至PVDF膜后,以新鲜配置的5%脱脂奶粉室温封闭1 h。洗涤后,将膜与相应抗体于4℃孵育过夜。充分洗涤,再与酶标二抗于室温感作45 min,应用ECL显色液进行显色。
1.6 Q-PCR样品RNA的提取和cDNA合成参考文献[10]介绍的方法进行,cDNA产物于-20℃保存备用,Q-PCR根据TaKaRa Q-PCR酶mix说明书进行。
1.7 巨噬细胞感染病毒后NLRP3通路激活的检测将原代小鼠巨噬细胞培养于24孔板,每孔5×105个细胞,37℃培养12 h后,分别以不同剂量病毒(10TCID50、100TCID50和1 000TCID50)HY12病毒进行感染。感染12 h后收集细胞,以Q-PCR和Western blot方法检测NLRP3、Caspase-1、IL-1β基因的mRNA和蛋白表达。
1.8 不同时间点NLRP3通路激活的检测24孔板培养原代小鼠巨噬细胞,5×105个/孔,37℃培养12 h 后,应用100TCID50HY12病毒感染细胞,并于感染后收集不同时间点(2,6,8,12,24 h)的细胞和上清,提取细胞总RNA,反转录合成cDNA,然后应用Q-PCR检测不同时间点细胞中NLRP3和Caspase-1的mRNA表达水平。同时,应用ELISA试剂盒检测细胞上清中IL-1β的表达量。
1.9 巨噬细胞感染病毒后IL-1β表达的检测24孔板培养原代小鼠巨噬细胞,5×105个/孔,37℃培养12 h后,分别以10TCID50、100TCID50和1 000TCID50HY12病毒感染巨噬细胞,感染12 h后,收集细胞上清,以IL-1β ELISA检测试剂盒检测上清中IL-1β的表达量。同时,应用100TCID50HY12病毒感染NLRP3基因敲除小鼠原代巨噬细胞、RAW264.7(ASC基因缺失细胞系)和小鼠原代巨噬细胞,12 h后收集细胞上清,以IL-1β ELISA检测试剂盒检测上清中IL-1β的表达量。
1.10 巨噬细胞分泌的IL-1β对HY12病毒复制的影响ATP和LPS刺激巨噬细胞,能够刺激NLRP3信号通路的激活及促进IL-1β分泌。将巨噬细胞以10%1640培养基培养于24孔板中,5×106个/孔。先使用1 mg/L LPS处理细胞6 h,再使用5 mmol/L ATP处理30 min,收集含有IL-1β的细胞上清,分别处理NLRP3基因敲除小鼠原代巨噬细胞、RAW264.7和小鼠原代巨噬细胞,12 h后,应用100TCID50HY12病毒感染细胞,并于感染12 h后收集细胞,以Q-PCR检测HY12病毒蛋白VP1和VP2的mRNA水平。同时将未经过含有IL-1β上清处理过的3种巨噬细胞设置为对照组。
1.11 小鼠感染HY12病毒后通路激活情况和对病毒的影响使用6×106TCID50HY12病毒感染ICR小鼠和NLRP3敲除小鼠,12 h后收集小鼠心脏、肝脏、脾脏和大脑,利用Q-PCR检测各组织中病毒结构蛋白VP1和VP2的mRNA表达水平,以及脾脏中NLRP3和IL-1β mRNA的表达。
2 结果
2.1 巨噬细胞感染HY12病毒激活了NLRP3炎性小体信号通路HY12病毒为本实验室从发病牛群分离获得到的国内首株E种肠道病毒,前期转录组分析结果发现NLRP3通路可能参与了机体抗HY12病毒感染免疫。为了解机体感染HY12病毒后NLRP3通路的激活情况,首先以HY12病毒感染小鼠原代腹腔巨噬细胞,结果发现巨噬细胞感染HY12病毒后,NLRP3通路中NLRP3、Caspase-1和IL-1β的mRNA表达升高,且随着病毒剂量的增加,mRNA表达水平逐渐增高,呈现病毒剂量的依耐性(图1A~C)。同时,应用Western blot检测上述基因的蛋白水平,结果NLRP3、Caspase-1和IL-1β的蛋白水平与mRNA表达的规律相似,表达均表现为升高(图1D)。上述结果表明巨噬细胞感染HY12病毒后,激活了NLRP3炎性小体信号通路相关基因的表达,且基因表达存在病毒剂量依赖性。

A.Caspase-1 mRNA相对表达水平;B.NLRP3 mRNA相对表达水平;C.IL-1β mRNA相对表达水平;D.Western blot检测不同剂量HY病毒感染后细胞中Caspase-1、NLRP3、IL-1β、VP1和VP2表达水平
2.2 NLRP3信号通路激活呈现时间依赖性为了进一步探究不同时间点病毒感染巨噬细胞对NLRP3通路相关蛋白表达的影响,检测了不同时间点NLRP3、Caspase-1和IL-1β的表达水平。结果显示,Caspase-1 mRNA表达水平随着时间推移逐渐升高,并于12 h达到峰值(图2A)。NLRP3 mRNA水平总体呈现时间依赖性,随时间增加而上升,但是在8 h出现下降趋势,提示该时间点NLRP3表达可能受到了抑制(图2B)。IL-1β在细胞上清中的表达水平随着时间增加逐渐上升,但是在6~8 h变化幅度不大,可能与NLRP3表达水平下降有关(图2C)。上述结果表明巨噬细胞感染HY12病毒后激活NLRP3信号通路呈现时间依赖性。
A.不同时间点Caspase-1 mRNA相对表达水平;B.不同时间点NLRP3 mRNA相对表达水平;C.不同时间点细胞上清IL-1β含量
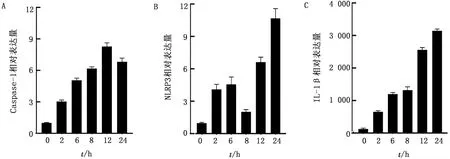
2.3 HY12感染促进巨噬细胞分泌IL-1β由于NLRP3通路激活后Caspase-1能够自身活化切割IL-1β前体蛋白使其激活介导机体免疫,应用HY12病毒感染正常细胞、NLRP3和ASC基因敲除细胞确定上述细胞感染病毒后NLRP3的激活是否促进IL-1β的活性。结果如图3A所示,不同剂量HY12病毒感染的巨噬细胞上清中,IL-1β的表达量随着病毒剂量的增加而升高。同时,与正常原代细胞对比,NLRP3和ASC基因缺失细胞(图3B)分泌的IL-1β表达量显著下降(图3C),表明巨噬细胞感染HY12病毒后确实通过激活NLRP3通路促进1L-1β分泌,并且1L-1β的表达量随着病毒剂量增加而升高,呈现病毒剂量的依赖性。
A.不同TCID50病毒感染小鼠原代巨噬细胞后上清IL-1β含量;B.Western blot检测ASC和NLRP3敲除细胞系敲除基因蛋白表达水平;C.HY12病毒感染NLRP3、ASC敲除细胞和正常细胞后上清中IL-1β mRNA水平
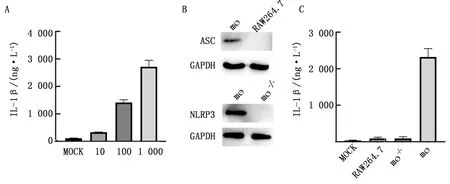
2.4 巨噬细胞分泌的IL-1β抑制HY12病毒复制上述结果显示巨噬细胞感染HY12病毒能够激活NLRP3通路并促进IL-1β的分泌,为了进一步探究NLRP3通路激活及分泌的IL-1β对病毒复制的影响,应用IL-1β处理正常巨噬细胞和基因缺失巨噬细胞,然后感染HY12病毒,并检测病毒蛋白VP1和VP2的表达水平。LPS和ATP处理原代巨噬细胞后上清中IL-1β表达量显著提高(图4A)。与未处理组(图4B)对比, IL-1β预处理细胞组(图4C)中病毒的VP1和VP2基因mRNA水平显著降低。而未处理的基因缺失细胞组相对于正常原代巨噬细胞VP1和VP2蛋白基因mRNA水平更高(图4B),说明巨噬细胞在HY12感染病毒后分泌的IL-1β抑制了病毒的复制。
A.LPS和ATP处理原代巨噬细胞后上清中IL-1β表达量;B.HY12病毒感染小鼠原代巨噬细胞、NLRP3敲除小鼠原代巨噬细胞和RAW264.7后病毒结构蛋白VP1和VP2 mRNA水平;C.HY12病毒感染小鼠原代巨噬细胞后病毒结构蛋白VP1和VP2 mRNA水平
2.5 小鼠体内NLRP3信号通路的激活抑制HY12病毒的复制为确证试验结果,进一步应用HY12病毒感染野生型小鼠和NLRP3敲除小鼠,确定NLRP3、IL-1β及病毒VP1的表达情况。结果如图5A所示,IL-1β和NLRP3的表达在机体感染病毒后升高,说明小鼠感染HY12病毒激活了NLRP3炎性小体信号通路。同时,检测小鼠感染病毒后各组织的病毒结构蛋白VP1和VP2 mRNA水平,结果显示正常小鼠感染HY12病毒后各组织的VP1和VP2表达水平明显下降,而NLRP3敲除小鼠感染HY12病毒后VP1和VP2表达水平上升(图5B),说明机体确实是通过激活NLRP3炎性小体抑制病毒的复制。
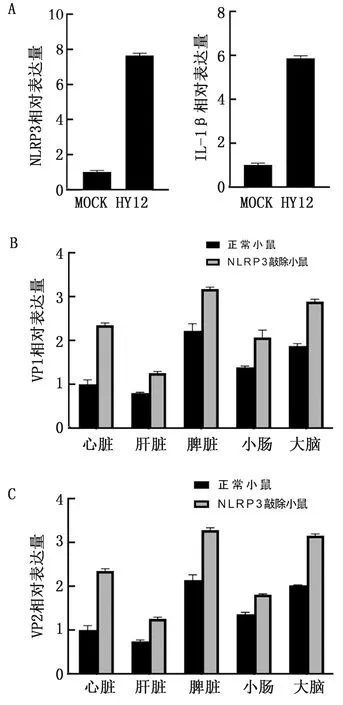
A.HY12感染正常小鼠脾脏中IL-1β和NLRP3 mRNA水平;B,C.HY12感染正常小鼠和NLRP3敲除小鼠各器官组织中病毒结构蛋白VP1和VP2相对表达水平
3 讨论
本试验应用细胞模型和小鼠模型确定出宿主感染HY12病毒后,通过激活NLRP3信号通路的相关蛋白NLRP3、IL-1β和Caspase-1的表达,进而抑制病毒的复制。HY12病毒属于小RNA病毒科肠道病毒属的E种肠道病毒,该病毒感染能够引起牛呈现消化系统和呼吸系统的临床症状,严重威胁养牛业的发展[3]。本试验结果显示,NLRP3信号通路的活化与HY12病毒感染有关。一般认为,宿主感染病毒后可通过细胞中内体膜上的模式识别受体如TLR3、TLR7和TLR9等识别病毒本身遗传物质和病毒遗传物质的转录中间体[11],激活核转录因子NF-κB(nuclear factor kappa-B),上调NLRP3和pro-IL-1β(IL-1β前体蛋白)mRNA表达,启动NLRP3炎性小体的活化[12]。本试验结果显示,细胞感染病毒后,NLRP3、IL-1β和Caspase-1表达水平总体呈现升高的趋势,且呈现病毒剂量依赖性。但是,IL-1β表达水平在6~8 h变化不显著,而NLRP3在相同时间段呈现下降的趋势,8 h后两者又表现出显著的上升趋势,提示NLRP3通路在这一时间段可能受到了抑制。能够引起NLRP3通路下调的原因有多种。据报道,细胞可以利用自噬控制NLRP3通路的激活,通过自噬清除损伤的细胞器,抑制炎性小体的激活,防止炎性小体过度激活导致的细胞的焦亡[13]。另据报道,病毒编码的部分蛋白能够与NLRP3通路部分蛋白结合抑制通路的激活[14]。本试验结果揭示出NLRP3激活的信号通路刺激IL-1β的分泌能够抑制宿主体内HY12病毒的复制。NLRP3炎性小体信号通路作为先天性免疫的一个重要组成成分,能够识别多种病原相关分子模式和危险相关分子模式,产生IL-1β等细胞因子,介导机体抗感染免疫反应[15]。IL-1β作为IL-1家族成员,在免疫应答早期由树突状细胞、单核细胞或巨噬细胞等分泌[16],能够诱导细胞因子分泌部位的血管通透性增强,并促进细胞向感染病灶迁移[17]。此外,IL-1β还可发挥全身调节作用,引起肝脏产生急性期蛋白,进一步诱导多种保护作用,破坏病毒RNA等[18]。本试验结果表明,机体感染HY12病毒后能够通过NLRP3炎性小体信号通路激活,刺激IL-1β的分泌,抑制病毒的复制,揭示了感染早期机体应对感染做出的免疫应答的部分机制,为今后病毒的防控和疫苗研发奠定了基础。宿主感染HY12病毒激活NLRP3通路后是否通过自噬促进病毒自身的复制,目前尚不清楚,将是今后研究的课题。
