牛星状病毒神经型与肠道型ORF2蛋白原核表达及间接ELISA的建立与初步应用
2022-10-24刘海峰罗宇航李明洋董覃婷吴翠兰钟舒红韦祖樟黄伟坚苏接瑜
刘海峰,罗宇航,李明洋,刘 腾,董覃婷,吴翠兰,彭 昊,钟舒红,韦祖樟,李 军,黄伟坚*,苏接瑜*
(1.广西大学 动物科学技术学院,广西 南宁 530005,2.广西兽医研究所 广西兽医生物科技重点实验室,广西 南宁 530001)
星状病毒(astronautics,AstV)是单股正链RNA,其长度为6.7~7.9 kb。通常包含几个连续且部分重叠的开放阅读框(ORF):ORF1a、ORF1b、ORF2、ORFX(ORF1b)[1]。ORF1a和ORF1b都是编码病毒的非结构蛋白,ORF2编码病毒的衣壳结构蛋白[2-3],并根据ORF2编码的衣壳结构蛋白的氨基酸序列的相似性与不同的基因型进行分类[4]。AstV通常被认为是儿童和其他免疫缺陷宿主腹泻的主要致病因子[5]。然而,近年来除了在哺乳动物粪便中发现AstV外,在人[6]及水貂[7]、牛[8-10]和禽类[11]等生物的不同组织里也发现新型AstV。据报道,新型AstV可引起胃肠道以外疾病,包括肝炎、肾炎、脑炎和脑膜炎以及人类和几种动物宿主的神经症状[12]。
1978年,在英国犊牛的粪便中首次检测到BoAstV[13]。1984年,研究者发现BoAstV感染牛后能引起更为严重的腹泻症状[14]。最近在美国、瑞士、日本、德国、意大利发现,脑膜和小脑中检测到了BoAstV,且已知神经型BoAstV引起的脑脊髓炎的主要表现为神经元变性和坏死、胶质增生[15]。近年来,BoAstV主要检测以逆转录(RT-PCR)检测为主。逆转录PCR优势是提供关于所发现的序列的细节,但不足以快速、快捷检测大量的样本,BoAstV现阶段没有建立新型的检测技术,其中在血清学上并没有新的突破,因此我们选择建立BoAstV间接ELISA来达到神经型与肠道型分型为临床大量检测提供精确与便捷。
1 材料与方法
1.1 细胞及质粒大肠杆菌DH5α感受态细胞和BL21(DE3)感受态细胞购买自康为世纪生物有限公司;原核表达载体pET-32a(+)载体由广西大学动物传染病与分子免疫学实验室保存。
1.2 主要试剂Primer Star Max DNA Polymerize、Quikcut BamHⅠ内切酶、Quikcut EcoRⅠ限制酶内切酶、DNA Marker均购自宝生物工程(大连)有限公司;ELISA包被液(10×)、TMB显色试剂盒均购买自索莱宝(Solar bio)生物试剂公司;凝胶琼脂粉购买自Inviting公司;Expression®ll One Step Cloning Kit、2×Rapid Taq Master Mix、彩色预染蛋白Marker均购买自诺唯赞生物科技股份有限公司(南京);HRP-标记山羊抗兔IgG、ADS-PAGE凝胶制备试剂盒、Ni-Agarose Resin NI琼脂糖凝胶购买自康为世纪生物公司;HRP-山羊抗牛lgG(H+L)赛默飞科技有限公司;质粒小提试剂盒、普通琼脂糖凝胶DNA回收试剂盒购买自天根生化科技(北京)有限公司。
1.3 引物设计与合成根据GenBank中登录的BoAstV神经型与肠道型ORF2全长基因序列,设计神经型与肠道型各1对引物,并在上、下游5′端引入限制内切酶Quikcut BamHⅠ和Quikcut EcoRⅠ的识别为点,送入北京擎科生物技术有限公司合成,引物序列信息见表1。
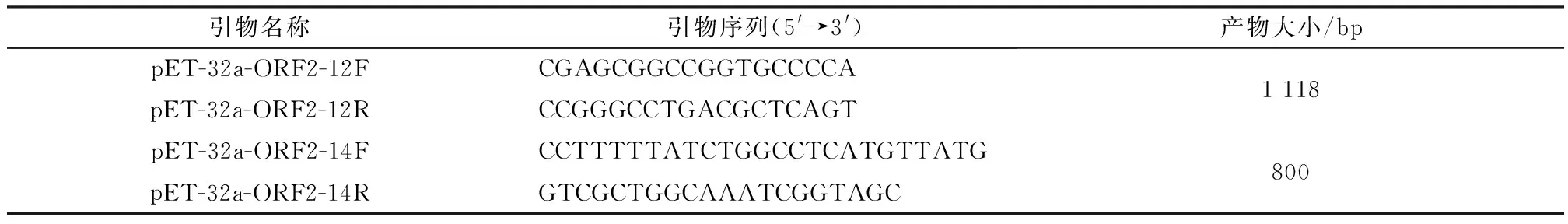
表1 引物序列
1.4 重组表达质粒的构建与鉴定利用已提取的BoAstV神经与肠道型 ORF2全长DNA为模板及设计好的上、下游引物进行PCR扩增,PCR体系:2×Rapid Taq Master Mix酶12.5 μL、ddH2O 8.5 μL、上游引物0.5 μL、下游引物0.5 μL。PCR反应条件:95℃预变性5 min;94℃变性4 min;55℃退火30 s;72℃延伸150 s共35个循环;经1%琼脂糖凝胶电泳鉴定为阳性的重组质粒送往生工基因测定。利用Quikcut BamHⅠ和Quikcut EcoRⅠ限制内切酶酶切pET-32a载体,根据同源重组反应体系:37℃ 30 min,经1%琼脂糖凝胶电泳鉴定为阳性的重组质粒送往生工基因测定将构建好的质粒命名为肠道型pET-32a-ORF2-12和神经型pET-32a-ORF2-14。
1.5 重组蛋白诱导与纯化利用鉴定正确的重组质粒进行转化BL21感受态细胞,挑取单个菌落进行菌液PCR。将阳性菌接种于LB培养基,37℃、200 r/min摇床培养10 h后得到原始菌液。按1∶100的比例将2 mL原始菌液加到200 mL LB培养基中,重新放入37℃摇床中培养4 h。将终浓度为0.5 mmol/L 的IPTG诱导剂加入到重新培养的菌液中,37℃重新振摇4 h。最后利用8 mL PBS重悬菌体,超声破碎菌体(300 W、破碎5 s、间歇4 s,170次),4℃、7 500×g离心10 min,收集上清和沉淀进行ADS-PAGE电泳胶进行分析,剩下蛋白存于-80℃ 冰箱。将超声好的重组蛋白负载上柱,用BCA蛋白定量试剂盒测定出纯化后重组蛋白的蛋白浓度,免疫新西兰大白兔,收集阳性血清。
1.6 多克隆抗体Western blot分析取40 μL蛋白上清和诱导的pET-32a(+)空载加入10 μL 5×Loading buffer混匀,沸水浴锅中煮10 min,取10 μL 进行ADS-PAGE电泳,根据蛋白条带大小剪取合适的PVDF膜,进行转膜,转膜后使用现配的TBST洗涤,5%BSA 37℃下封闭2 h,TBST洗涤3次,每次5 min,多克隆抗体用5%BSA 1∶2 000稀释,4℃过夜孵育,PBST洗涤3次,每次5 min,HRP-标记山羊抗兔IgG用5% BSA 1∶10 000稀释,37℃下孵育1 h,TBST洗涤3次,每次10 min。使用现配的DAB工作液显色30 s,使用Western blot 蛋白印迹成像仪进行拍照。
1.7 间接ELISA反应条件的优化
1.7.1抗原最佳包被量和最佳包被方式的确定 将重组蛋白的不同包被量(800,400,200,100 ng/孔)和不同的包被方式(4℃包被过夜、37℃包被1 h、37℃包被2 h、37℃包被3 h、37℃包被4 h)组成棋盘,采用方阵滴定法确定抗原的最佳包被量和包被方式。
1.7.2一抗最佳稀释度和最佳孵育时间的确定 一抗(阳性血清)的不同稀释度(1∶50,1∶100,1∶200,1∶400,1∶800,1∶1 600,1∶3 200,1∶6 400)和不同作用时间(30,60,90,120 min),采用方阵滴定法确定一抗的最佳稀释度和最佳孵育时间。
1.7.3二抗最佳稀释度和最佳孵育时间的确定 二抗(HRP标记抗牛IgG)的不同稀释度(1∶5 000,1∶10 000,1∶15 000,1∶20 000)和不同孵育时间(30,60,90,120 min)确定二抗的最佳稀释度和最佳孵育时间。
1.7.4最佳封闭液和最佳孵育时间的确定 使用不同的封闭液(5%脱脂奶粉、5%BSA)和不同孵育时间(60,90,120,180 min)确定最佳封闭液和最佳孵育时间。
1.9 特异性试验利用优化的间接ELISA最佳反应条件分别对BoAstV阳性与阴性血清、猪星状病毒(PAstV)阳性血清、牛轮状病毒(BRV)阳性血清、牛流行性腹泻病毒(BEDV)阳性血清、牛冠状病毒(BCOV)阳性血清进行检测,确定间接ELISA方法的特异性。
1.10 敏感性试验将优化好的间接ELISA最佳反应条件分别对不同的稀释倍数的BoAstV阳性血清进行检测,掌握间接ELISA方法对BoAstV阳性血清的最低检出效价,确定间接ELISA方法的敏感性。
1.11 符合率确定用建立的间接ELISA检测方法对已知的8份BoAstV阳性血清及8份阴性血清进行检测。测定D450 nm值,计算符合率。符合率=(检出阳性血清数+检出阴性血清数)/总检测样品数×100%。
1.13 临床应用应用建立的间接ELISA方法对广西地区2019-2021年间部分采集的712份牛血清进行BoAstV抗体检测,了解当前广西省部分地区BoAstV肠道型与神经型阳性病毒的流行情况,确定间接ELISA方法在临床血清样品检测中的临床应用情况。
2 结果
2.1 重组表达质粒的构建与鉴定以BoAstV流行毒株基因组DNA为模板,采用特异性引物对肠道型pET-32a-ORF2-12和神经型pET-32a-ORF2-14进行PCR扩增并对扩增结果进行Quikcut BamHⅠ和Quikcut EcoRⅠ双酶切鉴定,产物经1%琼脂糖凝胶电泳检测,结果显示与预期大小一致(图1)。
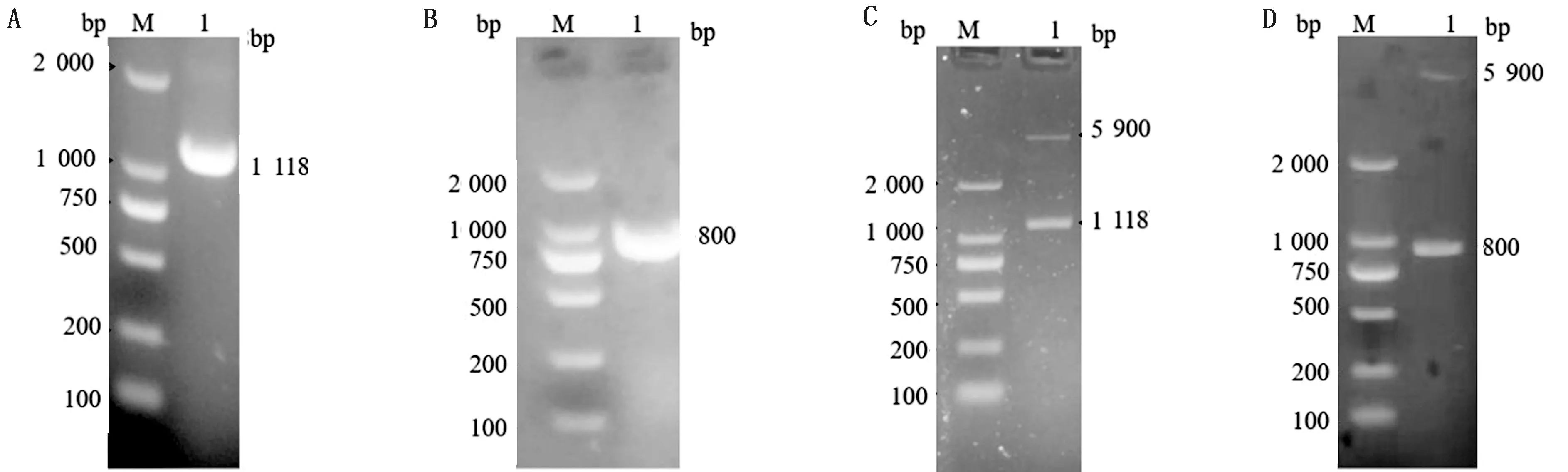
A.肠道型ORF2-12基因PCR扩增片段;A1.肠道型pET-32a-ORF2-12;B.神经型ORF2-14基因PCR扩增片段;B1.神经型pET-32a-ORF2-14;C,D.重组质粒双酶切鉴定;C1.肠道型pET-32a-ORF2-12;D1.神经型pET-32a-ORF2-14;M.DL2000 DNA Marker
2.2 重组蛋白诱导与纯化ADS-PAGE电泳结果显示,通过对菌体超声裂解液的上清和沉淀分析发现,重组肠道型pET-32a-ORF2-12、神经型pET-32a-ORF2-14蛋白在沉淀与上清中均有表达。利用Ni-NTA琼脂糖树脂对菌体裂解产物上清中的重组蛋白进行了纯化,ADS-PAGE分析纯化后的重组蛋白大小与预期条带一致(图2A,B)。
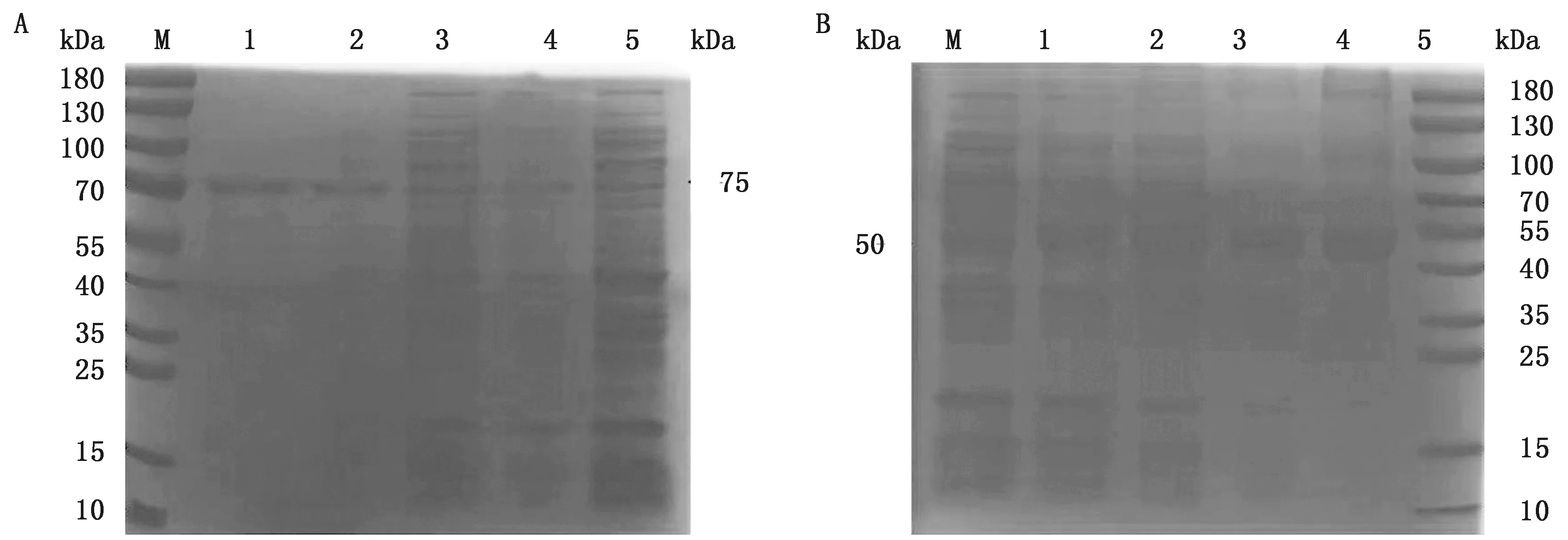
M.蛋白Marker;A1.纯化后肠道型pET-32a-ORF2-12;A2.超声后肠道型pET-32a-ORF2-12沉淀;A3.超声后肠道型pET-32a-ORF2-12上清;A4.小量诱导肠道型pET-32a-ORF2-12;A5.诱导的pET-32a(+);B1.诱导的pET-32a(+);B2.小量诱导神经型pET-32a-ORF2-14;B3.超声后神经型pET-32a-ORF2-14上清;B4.超声后神经型pET-32a-ORF2-14沉淀;B5.纯化后神经型pET-32a-ORF2-14
2.3 多克隆抗体Western blot重组肠道型pET-32a-ORF2-12、神经型pET-32a-ORF2-14蛋白多克隆抗体进行Western blot,结果显示多克隆抗体能与蛋白感染的新西兰大白兔阳性血清结合出现条带,条带大小与肠道型pET-32a-ORF2-12(图3A,75 kDa)、神经型pET-32a-ORF2-14(图3B,50 kDa)在ADS-PAGE表达大小一致。
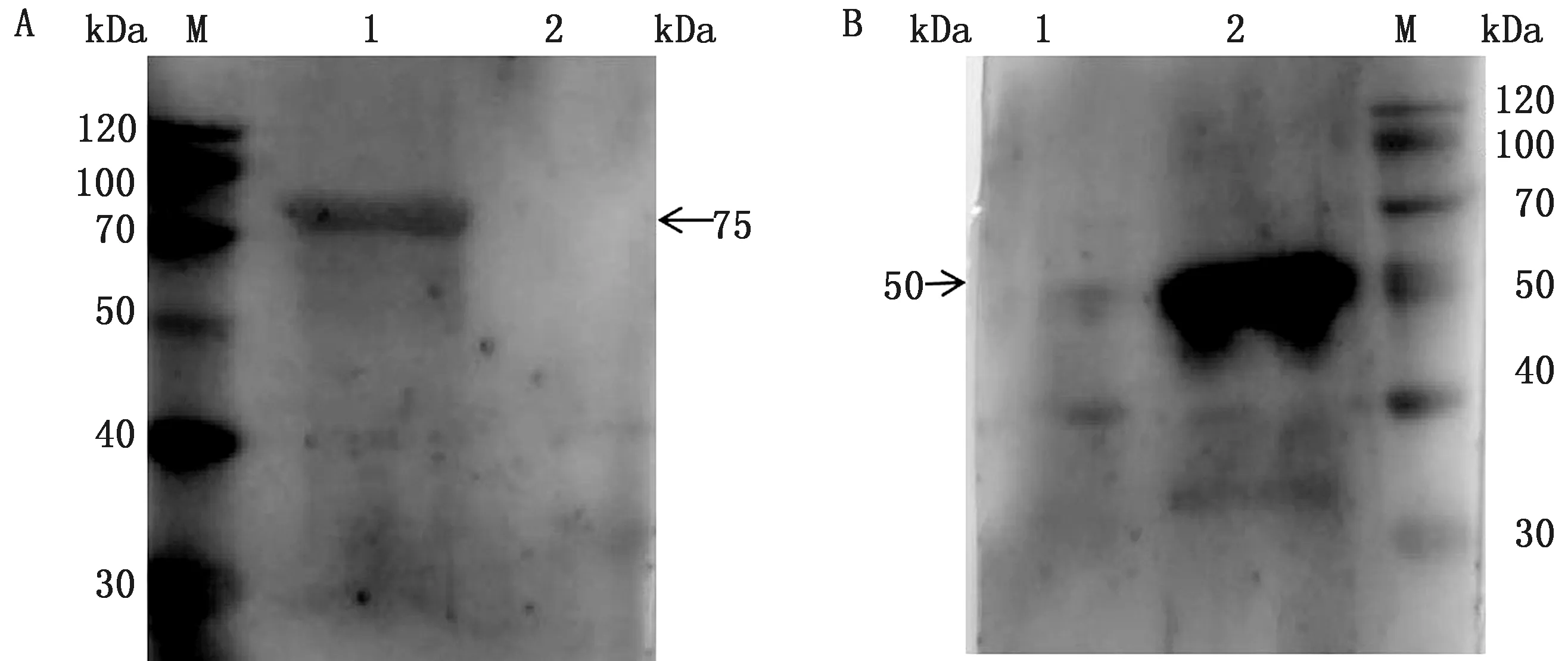
M.蛋白Marker;A1.肠道型pET-32a-ORF2-12蛋白(75 kDa);A2,B1.pET-32a(+);B2.神经型pET-32a-ORF2-14蛋白(50 kDa)
2.4 间接ELISA反应条件的优化经方阵图分析确定,重组间接ELISA反应条件中蛋白肠道型pET-32a-ORF2-12的最佳包被量为0.4 μg/孔,最佳包被方式为37℃ 3 h,一抗最佳稀释度为1∶100,最佳一抗孵育时间90 min;二抗最佳的稀释度为1∶10 000,最佳二抗孵育时间为30 min;最佳封闭液为5%脱脂奶粉,最佳封闭时间为2 h;最佳显色时间5 min。神经型pET-32a-ORF2-14的最佳包被量为0.2 μg/孔,最佳包被方式为4℃过夜;一抗最佳稀释度为1∶100,最佳一抗孵育时间2 h;二抗最佳的稀释度为1∶20 000,最佳二抗孵育时间为1 h;最佳封闭液为5%脱脂奶粉,最佳封闭时间为2 h;最佳显色时间10 min。
2.6 特异性交叉试验利用间接ELISA检测BoAstV神经型与肠道型阳性血清与、PAstV阳性血清、BRV阳性血清、BEDV阳性血清、BCOV阳性血清、结果如表2所示,两型之间间接ELISA检测BoAstV阳性血清各为阳性,而检测PAstV阳性血清、BRV阳性血清、BEDV阳性血清、BCOV阳性血清、阴性血清均为阴性,由此可见间接方法对牛的BoAstV阳性血清具有很好的特异性。
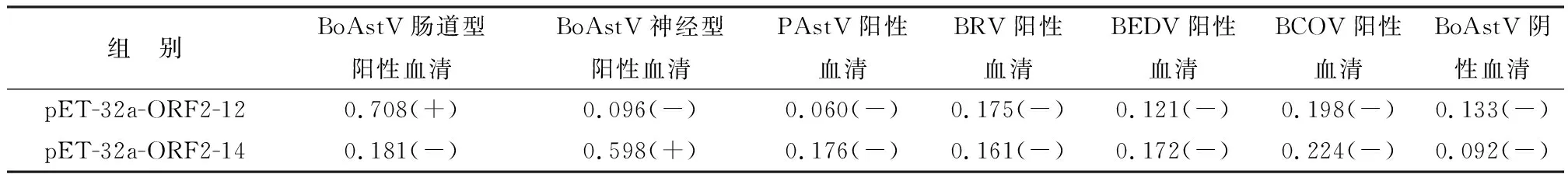
表2 特异性交叉试验(D450 nm值结果判定)
2.7 敏感性试验应用间接ELISA对不同稀释倍数的BoAstV阳性血清进行检测,结果如表3所示,间接ELISA检测肠道型pET-32a-ORF2-12的 1∶6 400倍数时阳性血清的D450 nm值为0.276,结果呈阳性,间接ELISA检测神经型pET-32a-ORF2-14的1∶6 400倍数时阳性血清的D450 nm值为0.394,结果呈阳性,即间接ELISA检测阳性血清的最低检出效价为1∶6 400,建立间接ELISA检测方法具有很好的敏感性。
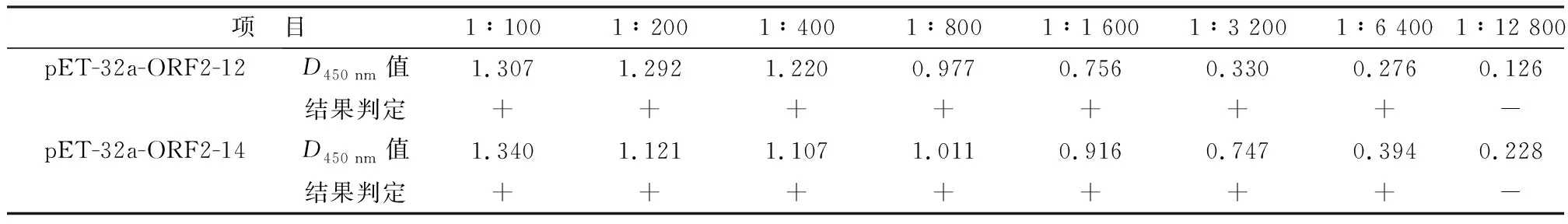
表3 敏感试验
3.8 重复性试验选取8份BoAstV阳性与阴性抗体水平不同的血清样品分别对其进行批内与批间重复性试验,每个样品检测3次,结果如表4所示,8份BoAstV抗体水平不同血清样品中,肠道型pET-32a-ORF2-12重组蛋白批内的变异系数在7.24%~3.02%之间,批间的变异系数在5.48%~0.89%之间;神经型pET-32a-ORF2-14重组蛋白批内的变异系数在5.93%~1.61%之间,批间的变异系数在7.63%~1.88%之间。批内和批间的变异系数均小于10%,表明间接ELISA检测方法具有很好的重复性。
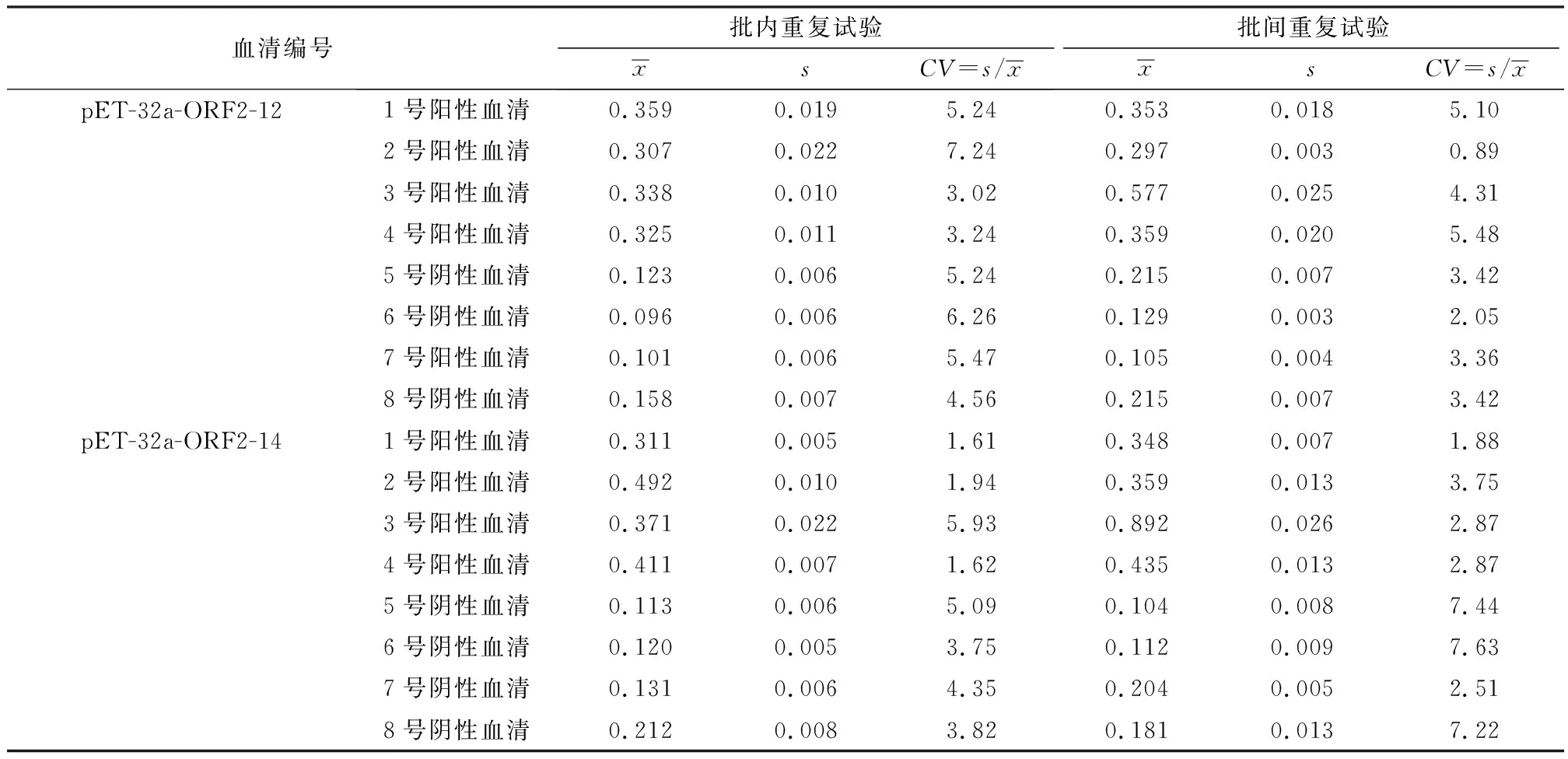
表4 重复性试验结果
2.9 临床应用用本试验建立的间接ELISA检测方法对2019-2020年广西省部分地区采集的712份牛血清进行BoAstV抗体的检测,结果如表5所示,肠道型共检出170份抗体阳性血清,BoAstV抗体阳性率为23%;神经型共检出124份抗体阳性血清,BoAstV抗体阳性率为17%。其中,2种型共同感染血清检出阳性77份占总份数10%。由此证明BoAstV的肠道型pET-32a-ORF2-12、神经型pET-32a-ORF2-14在2种型之间建立的间接ELISA检测方法在临床上血清有很好的实用性。

表5 临床应用试验结
3 讨论
近年来,不断有研究发现BoAstV毒株能够跨过肠道屏障进入血液和其他器官,特别是感染神经系统造成脑炎或脑膜炎,说明BoAstV的一些毒株的细胞嗜性可能发生改变并伴有潜在的全身性感染风险。2013年以来,国外学者利用高通量测序技术发现某些新型BoAstV毒株具有神经嗜性和较强的致病性[15]。由于现阶段BoAstV肠道型与神经型的检测主要是RT-PCR检测技术,但RT-PCR检测技术太过繁琐不适于大量应用。在血清学上并没有很好的更为精准便捷与分型检测技术,因此本试验根据临床需要建立一种对BoAstV肠道型与神经型分型与临床大量检测准确的检测方式。间接ELISA方法已成为血清学检测的一种常规技术,其准确性高,同时试验操作也迅速快捷,可以同时检测大批量待测样品,既节约时间又有效的节约成本。
本试验通过对BoAstV肠道型与神经型ORF2衣壳前体蛋白VP90保守区进行分析发现,VP90结构蛋白区域在300aa与750aa有2处抗原表位,这2处抗原表位是ORF2对于肠道型与神经型的分析区域同时也是ORF2的保守区,通过RT-PCR分别构建含有His-tag重组原核表达质粒,命名为肠道型pET-32a-ORF2-12与神经型pET-32a-ORF2-14。在原核表达系统中37℃诱导时效果最佳,重组表达蛋白肠道型pET-32a-ORF2-12与神经型pET-32a-ORF2-12都主要以可溶性形式表达,本试验通过大量表达获得较高的可溶性重组蛋白肠道型pET-32a-ORF2-12与神经型pET-32a-ORF2-14,对2种构建的重组表达蛋白进行纯化,经过BCA检测质量浓度达到免疫要求[16]。用纯化的重组表达蛋白对2只新兰大白兔进行免疫,得到2种重组蛋白抗体验证建立好的肠道型与神经型的免疫印迹法,对牛血清中BoAstV抗体进行筛选,得到BoAstV肠道型与神经型阳性与阴性血清,将纯化后具有生物活性的重组表达蛋白作为ELISA包被抗原,建立了BoAstV重组表达蛋白肠道型pET-32a-ORF2-12与神经型pET-32a-ORF2-14间接ELISA检测方法[17],通过对8份已知BoAstV肠道型与神经型阴性血清的检测,确定了阴性、阳性血清的临界值,为样品阴性与阳性判断提供依据。经过特异性交叉、敏感性和重复性分析,表明本试验建立的BoAstV肠道型与神经型间接ELISA检测方法具有较高的特异性与稳定性。为了对建立的间接ELISA加以验证,本试验应用建立的肠道型与神经型间接ELISA对临床牛血清检测,并通过结果分析发现BoAstV的流行情况与临床上RT-PCR检测粪便阳性率相似。
本试验通过分析肠道型和神经型ORF2结构蛋白抗原表位,建立BoAstV肠道型与神经型血清学抗体分型检测方法,为BoAstV临床上大量检测提供快捷、精确的检测方法,并为BoAstV净化与防控提供帮助。
