外源Ca(NO3)2对盐胁迫下大苞萱草氮代谢及相关基因表达的影响
2022-10-21王浩宇刘威郑瞾钰杜金雪张凤祥闫永庆
王浩宇,刘威,郑瞾钰,杜金雪,张凤祥,闫永庆
(东北农业大学园艺园林学院,黑龙江 哈尔滨 150030)
大苞萱草(Hemerocallis middendorfiiTrautv.et Mey.)系阿福花科(Asphodelaceae)萱草属(HemerocallisL.)多年生宿根花卉,在我国东北三省分布较广。大苞萱草春季萌发早,开花早,花大色艳,具芳香气味[1],耐寒性强;其根系比较发达,对土壤的要求不严格,具较强的耐旱和耐盐碱能力,在寒地城市园林绿化中具有很好的应用前景。
氮被称作是植物的“生命元素”,植物体内的氮形态和氮代谢相关酶活性能够直接反映氮代谢情况。盐胁迫下不同种植物由于生理特征存在较大差异,氮代谢途径和效率也存在差异。研究显示,黄瓜和番茄在盐胁迫下的氮素吸收能力、氮代谢能力以及对硝酸盐的吸收能力均会受到不同程度的抑制[2,3]。NaCl胁迫能够抑制番茄幼苗的硝酸还原酶(nitrate reductase,NR)、氨同化过程中的谷氨酰胺合成酶(glutamine synthetase,GS)以及谷氨酸合酶(glutamate synthase,GOGAT)活性,降低相关基因的表达水平[4];但使桑树幼苗中的GS与GOGAT活性显著上升[5],使鳗草(Zostera marina)的NR基因表达有所上调[6]。在盐胁迫下,耐盐荞麦的NO3-含量、NR活性显著高于盐敏感品种[7],不同品种抗性甜菜也具备这一特点[8]。这表明植物响应盐胁迫的氮代谢形式和机理非常复杂[9,10]。目前,关于盐胁迫影响植物氮代谢的研究不断增多,但有关盐胁迫下大苞萱草氮代谢及相关基因表达变化的报道甚少。
钙作为第二信使,在植物响应各种非生物胁迫中发挥着重要作用[11]。同时,植物能够将吸收的钙转化为膜保护剂,提高细胞壁的结构强度,稳定膜结合蛋白质量,平衡各种活性酶。研究证实,在植物遭受盐胁迫时,在根部施加一定浓度的外源钙,不仅能够补充植物生长发育所需的钙、加强植物矿质营养均衡性,而且能够提高质膜稳定性,使钙信号系统正常运行,维持细胞内离子的平衡状态[12]。魏翠果等[13]研究发现施加一定浓度的外源Ca2+可有效提高盐胁迫下马铃薯的NR和GS活性。外源Ca(NO3)2在为植物提供Ca2+和NO3-的同时,NO3-还可以通过抑制植物在盐胁迫下对Cl-的吸收而降低盐害[2]。外源钙缓解NaCl胁迫的机制研究在酸枣[14]、番茄幼苗[15]、甘薯幼苗[16]上已有报道,但在萱草上的研究还鲜见报道。
本研究以大苞萱草为试验材料,基于预试验结果,在300 mmol·L-1NaCl胁迫下研究施加10 mmol·L-1Ca(NO3)2对叶片中NR、GS、GOGAT活性及氮代谢相关基因表达的影响,探索大苞萱草耐盐性与氮代谢之间的关系,为其耐盐基因研究、耐盐品种培育提供参考。
1 材料与方法
1.1 试验材料
2021年4月,将大苞萱草幼苗定植于口径15 cm、深20 cm的塑料花盆中,以原土为培养基质,置于东北农业大学园艺试验站智能温室中,在25℃、光照12 h的条件下进行培养。2021年6月,待幼苗长出6~8片真叶后,从中选择生长发育状态较好、长势一致的幼苗作为样本,用净水反复清洗根部泥土,之后在相同花盆中装入纯净河沙作为基质,按照每盆一株定植幼苗,并每2 d使用1/2剂量Hoagland全营养液浇灌幼苗样本。待20 d缓苗期后,施加NaCl和Ca(NO3)2进行相关试验处理。
1.2 试验设计与处理方法
通过预试验,设计不同浓度(0、100、200、300、400 mmol·L-1)NaCl胁迫处理,筛选出300 mmol·L-1作为大苞萱草的重度盐害浓度用于后续试验。在此基础上,再设计施加不同浓度(0、10、15、20 mmol·L-1)Ca(NO3)处理,筛选出10 mmol·L-1为外施Ca(NO3)2缓解盐胁迫对大苞萱草伤害的最适浓度。
基于预试验结果设计本试验处理:①CK,不进行NaCl和Ca(NO3)2处理;②Ca,10 mmol·L-1Ca(NO3)2处理;③Na,300 mmol·L-1NaCl处理;④NCa,300 mmol·L-1NaCl+10 mmol·L-1Ca(NO3)2处理。每个处理5盆,每盆为一个重复。考虑到一次性加盐所致短时间高浓度胁迫会严重伤害植株,本研究以100 mmol·L-1作为NaCl胁迫的起始浓度,然后每天递增100 mmol·L-1,待达到预设浓度后再进行试验处理,连续处理5 d。为维持处理期间NaCl浓度不变,按照细沙持水量的2倍作为单次浇灌的基准量。处理结束后的第二天,采集大苞萱草叶片,用去离子水洗净、吸水纸吸干表面水分后,用锡纸包裹,在液氮中速冻,并置于-80℃冰箱中贮存,用于各指标测定。
1.3 测定指标及方法
硝态氮、铵态氮含量及硝酸还原酶、谷氨酰胺合成酶活性的测定均参考张以顺等[17]的方法;谷氨酸合酶活性的测定参考王小纯等[18]的方法。
氮代谢相关基因表达量:采用改良Trizol法提取总RNA,反转录cDNA,然后利用实时荧光定量PCR技术进行测定。qRT-PCR反应体系:SYBR GREEN 10 μL,Primer-F 1 μL,Primer-R 1 μL,cDNA 1 μL,ddH2O 7 μL。所测氮代谢相关基因及所用引物见表1。

表1 基因定量表达引物序列
1.4 数据处理与分析
采用Microsoft Excel 2010和SPSS 23.0软件进行数据处理和方差分析,利用GraphPad Prism 8软件制图。
2 结果与分析
2.1 外源Ca(NO3)2对盐胁迫下大苞萱草叶片中硝态氮和铵态氮含量的影响
由图1可知,与CK相比,外源Ca(NO3)2处理的大苞萱草叶片中NO3--N含量显著升高,是CK的1.61倍(P<0.05);NaCl胁迫显著降低了大苞萱草叶片中的NO3--N含量,为CK的72.7%(P<0.05);NaCl+Ca(NO3)2处理的NO3--N含量与CK相当,显著高于NaCl处理50%(P<0.05)。说明施加外源Ca(NO3)2可以提高大苞萱草叶片中的NO3--N含量,降低盐胁迫对其NO3--N吸收的抑制作用,促进硝酸盐同化,从而缓解盐胁迫对大苞萱草的伤害。

图1 外源Ca(NO3)2对盐胁迫下大苞萱草叶片中硝态氮和铵态氮含量的影响
与CK相比,NaCl胁迫处理的大苞萱草叶片中NH4+-N含量显著升高,是CK的1.21倍(P<0.05),而施加Ca(NO3)2可以显著降低NH4+-N含量,Ca(NO3)2和NaCl+Ca(NO3)2处理的NH4+-N含量分别是CK的85.2%和90.4%(P<0.05)。说明外源Ca(NO3)2能够促进盐胁迫下大苞萱草的NH4+-N代谢,减少NH4+-N积累,从而降低盐胁迫的毒害作用,改善大苞萱草的氮代谢效率。
2.2 外源Ca(NO3)2对盐胁迫下大苞萱草氮代谢关键酶活性的影响
由图2可知,与CK相比,NaCl胁迫下大苞萱草叶片中的NR活性显著下降,是CK的76.3%(P<0.05);而Ca(NO3)2处理、NaCl+Ca(NO3)2处理的NR活性则显著升高,分别是CK的1.63倍和1.31倍(P<0.05)。
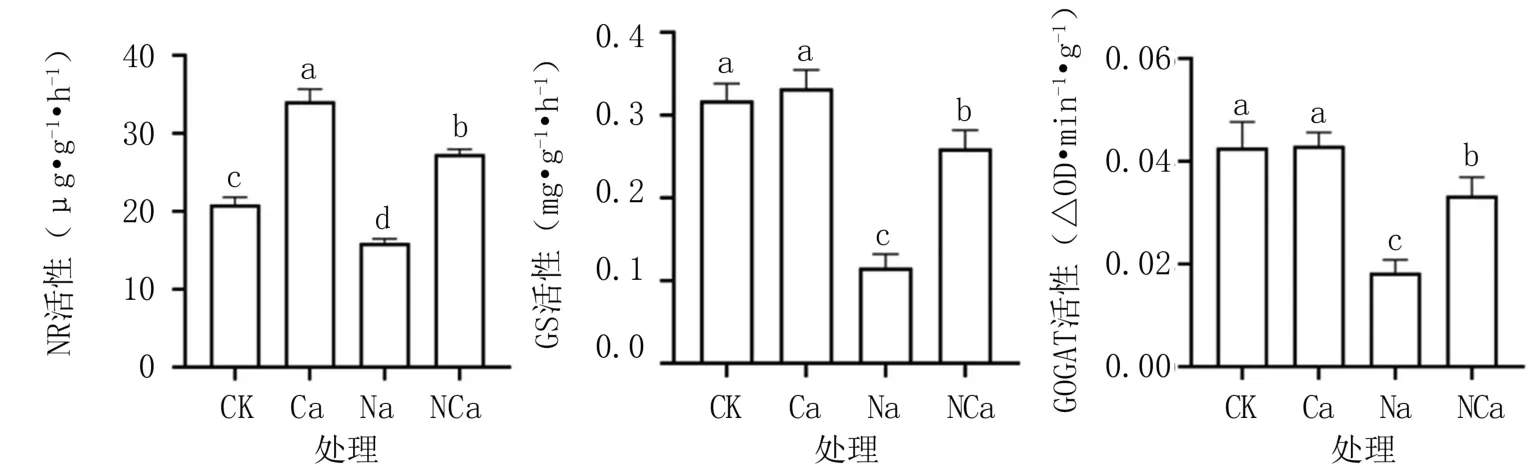
图2 外源Ca(NO3)2对盐胁迫下大苞萱草NR、GS、GOGAT活性的影响
与CK相比,外源Ca(NO3)2处理的GS活性无显著变化,而NaCl胁迫使其GS活性显著下降,是CK的36.6%(P<0.05);NaCl胁迫下增施Ca(NO3)2显著提高了GS活性,是NaCl胁迫的2.24倍(P<0.05),但仍显著低于CK。说明盐胁迫对大苞萱草叶片中的GS活性抑制较强,降低了铵代谢速度,而外源Ca(NO3)2可有效减轻这种抑制,提高植株对盐胁迫的抵抗能力。
与CK相比,外源Ca(NO3)2处理大苞萱草叶片中的GOGAT活性无显著变化,而NaCl处理下GOGAT活性显著下降57.1%(P<0.05);NaCl胁迫下增施Ca(NO3)2处理可显著提高GOGAT活性,是NaCl处理的1.82倍(P<0.05),但仍显著低于CK。说明外源Ca(NO3)2可以提升NaCl胁迫下大苞萱草叶片的NH4+同化能力。
2.3 外源Ca(NO3)2对盐胁迫下大苞萱草氮代谢相关基因表达的影响
AMT基因调控NH4+的吸收和转运,NR基因调控NR含量,NRT基因调控硝酸盐转运蛋白合成,Fd-GOGAT基因调控GOGAT含量,SUT基因调控蔗糖转运。由图3可见,NaCl胁迫下,大苞萱草中的AMT1;1、AMT1;2、Fd-GOGAT和SUT4表达量显著增加,NR1表达量显著降低,NRT1表达量与CK相当。与CK相比,Ca(NO3)2处理除显著降低NRT1的表达量外,均可诱导其他基因上调表达,尤其对NR1和SUT4表达的促进效果显著。与NaCl胁迫相比,增施Ca(NO3)2除略上调NR1的表达外,显著下调了其他基因的表达。说明NaCl胁迫下大苞萱草通过上调表达AMT1;1、AMT1;2、Fd-GOGAT、SUT4基因,加速铵态氮代谢,增强蔗糖代谢,提高氮同化效率,以应对盐胁迫;而施加外源Ca(NO3)2可使这些基因的表达量显著降低,表明其能够有效缓解盐胁迫造成的伤害,改善氮代谢水平。
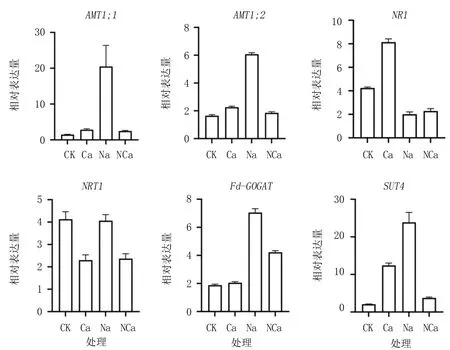
图3 外源Ca(NO3)2对盐胁迫下大苞萱草氮代谢相关基因表达量的影响
3 讨论与结论
氮素是植物生长发育所必需的大量元素,对作物生长和产量形成起决定性作用,逆境条件下氮素缺乏会造成植物的生长发育受到限制[19]。氮同化是植物吸收NO3-或NH4+合成氨基酸和蛋白质等含氮有机物的过程,需要多种酶协同作用。GS和GOGAT不仅参与植物氮代谢,还能够在多种生理代谢过程中发挥良性调节功能,有利于增强植株对多种有害物质的代谢能力[20]。张毅等[21]试验发现,盐碱胁迫能够降低番茄幼苗的GS和GOGAT活性,阻滞幼苗生长发育过程。谷氨酸合酶是参与NH4+同化过程的关键酶,如果谷氨酸合酶的活性受到抑制,NH4+同化过程也将受到阻滞。盐胁迫能够影响氮同化过程,使植物对无机氮的吸收和利用受到抑制,降低蛋白质和氨基酸的合成效率,进而对植物的生长发育造成危害。
研究表明,当盐浓度超过植物能够承受的范围后,可促使NO3--N含量下降,NH4+-N含量增加,对植株造成毒害作用[10,22,23]。本研究中,300 mmol·L-1NaCl胁迫使大苞萱草叶片中的NO3--N含量显著降低,NH4+-N含量显著升高,并显著降低NR、GS、GOGAT活性,对其造成明显的胁迫伤害;而施用10 mmol·L-1外源Ca(NO3)2后,NO3--N含量显著回升,NH4+-N含量显著下降,NR、GS、GOGAT活性显著上升,表明施加外源Ca(NO3)2能通过激活GS、NR、GOGAT等氮代谢相关酶的作用增强其NO3-还原与NH4+同化能力,促进GS/GOGAT循环,维持其正常的氮代谢过程,从而有效缓解盐胁迫对大苞萱草的伤害。
但外源Ca(NO3)2对盐胁迫下植物体内氮代谢影响的分子机制尚不明确。AMT1;1和AMT1;2基因的主要功能是促进NH4+转运[24]。蔗糖是糖在植物中的主要转运形式,而糖作为碳的主要存在形式,与氮同化密切相关,控制蔗糖转运的基因SUT4表达上调可能为生长发育提供更多能量物质[25]。Fd-GOGAT基因表达与GS和GOGAT两种氮代谢关键酶的活性有关,植物为应对盐胁迫,可通过上调该基因的表达来提升这两种酶的活性,从而维持氮代谢水平。本研究结果显示,在300 mmol·L-1NaCl胁迫下,上述4个基因在大苞萱草体内均显著上调表达,而施加外源Ca(NO3)2均能有效抑制其上调表达;同时,施加外源Ca(NO3)2能上调盐胁迫下大苞萱草体内NR1基因的表达,下调NRT1基因的表达。表明300 mmol·L-1NaCl胁迫下施加10 mmol·L-1外源Ca(NO3)2有助于维持大苞萱草体内的氮代谢水平,有效降低盐胁迫伤害。
综上所述,在盐胁迫下,外源Ca(NO3)2可通过提高氮代谢相关酶活性及调控相关基因表达,维持大苞萱草体内氮代谢水平,从而提高其对盐胁迫的抗性。
