冬小包脚菇菌基土壤微生物群落多样性与土壤理化性质相关性研究
2022-10-21李鹏熊雪向准和耀威黄静王晶刘忠玄
李鹏,熊雪,向准,和耀威,黄静,王晶,刘忠玄
(贵州省生物研究所,贵州 贵阳 550009)
冬小包脚菇(Volvariella brumalisHe sp.)俗称低温草菇、谷桩菌,隶属于光柄菇科(Pluteaceae)包脚菇属(Volvariella),是何绍昌先生在1987年发现的新种[1],全国仅贵州有分布,也是包脚菇属中唯一一个低温出菇种类,出菇温度4~17℃[2,3],填补了该属可食用种类均为中高温型的缺陷,对弥补草菇冬季市场缺口具有重要意义。该菇肉质鲜美可口,含有丰富的氨基酸和矿物元素,具有重要的市场价值和科研价值[4,5]。由于其野生资源较少、分离及培养难度大、驯化产量不稳定等原因,目前仅在野外生境、形态特征、仿生栽培等方面有研究[2,6],在高效栽培、耐低温机制等方面仍处于空白。
土壤微生物群落是土壤生态系统预警和敏感性的重要指标之一[7],其对食用菌菌塘的形成、养分调节和生态系统物质循环和能量流动具有重要意义[8]。研究表明,土壤微生物对食用菌菌丝体的生长、菌核的形成、子实体的发生均起着关键作用[9,10]。近年来,有关食用菌土壤微生物研究较少,主要集中在物种组成、结实相关性、连作障碍等方面,尚未见不同生长发育时期菌基土壤微生物研究的相关报道。因此,本试验以贵州特有的野生冬小包脚菇菌基土壤为材料,研究其微生物群落结构与组成、土壤理化性质,旨在了解冬小包脚菇不同生长发育时期土壤微生物群落组成和结构、理化性质,以期为冬小包脚菇人工驯化栽培、稳产高产及功能微生物菌群的开发提供理论依据。
1 材料与方法
1.1 样品采集
1.1.1 子实体的采集和培养基 供试菌株:野外采集的冬小包脚菇子实体,经组织分离培养后得到,现保藏于贵州省生物研究所。
分离培养基:马铃薯(去皮)200 g,稻草40 g(剪成2~3 cm段,沸水30 min),葡萄糖20 g,蛋白胨2 g,KH2PO40.5 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,维生素B110 mg,琼脂粉20 g,去离子水1 000 mL,pH自然。
1.1.2 土壤样品采集 冬小包脚菇菌基土壤于2020年12月底采集自贵州省遵义市汇川区板桥镇三衙庄、大沟村(海拔879~1 000 m,温度6.5℃)。野生冬小包脚菇主要生长在种植水稻后轮作种植小麦、油菜的农田。戴无菌手套和口罩,选择蛋形期(E1)、伸长期(L2)、成熟期(M3)和自溶期(A4)的冬小包脚菇各3株(图1),小心挖取子实体及菌托土壤,用无菌镊子刮取冬小包脚菇菌托表面的土壤后,置于灭菌离心管中,放入车载冰箱-20℃保存备用,共采集样品12个。去除土壤表面的杂草等杂物后,取子实体周边半径10 cm、深度0~10 cm的土壤,每个子实体采集1份,共12份,装入自封袋,用于土壤理化指标分析。

图1 野生冬小包脚菇不同生长发育期
1.2 试验方法
1.2.1 冬小包脚菇菌株的分离与鉴定 采用组织分离法对冬小包脚菇子实体进行分离,置于18℃培养箱中培养,将培养得到的菌丝体进一步纯化后进行分子鉴定。采用生工生物工程(上海)股份有限公司生产的Ezup柱式真菌基因组DNA抽提试剂盒提取真菌基因组DNA,并用真菌通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增,PCR反应体系(25 μL):基因组DNA(20~50 ng/μL)0.5 μL,10×buffer(含Mg2+)2.5 μL,dNTP(2.5 mmol/L)1 μL,Taq酶0.2 μL,正反向引物(10 μmol/L)各0.5 μL,加去离子水至25 μL。反应程序:94℃预变性4 min;94℃变性15 s,58℃退火15 s,72℃延伸1 min,共35个循环;72℃再延伸5 min,4℃终止反应保存。扩增产物经1.0%琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司测序。
1.2.2 土壤理化指标测定 土壤理化指标由贵州省农业科学院农业资源与环境检测中心进行测定。土壤全氮、全磷、全钾、碱解氮、有效磷、速效钾、有机质含量和pH值分别依据NY/T 53—1987、NY/T 88—1988、NY/T 87—1988、LY/T 1228—2015、NY/T 1121.7—2014、NY/T 889—2004、NY/T 1121.6—2006、NY/T 1377—2007测定。
1.2.3 土壤样品DNA提取和PCR扩增 采用Soil Genomic DNA Kit试剂盒提取菌基土壤DNA,用超微量分光光度计检测所提取DNA的浓度和质量。利用通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rDNA的V3~V4可变区,引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)扩增真菌ITS区域,PCR扩增体系和程序同1.2.1,PCR产物经1.0%琼脂糖凝胶电泳检测后纯化,送至上海美吉生物医药科技有限公司测序。
1.2.4 数据分析 利用FLASH和fastp软件,根据PE reads之间的overlap关系,对各样本数据进行优化和质控过滤,得到有效数据。按照97%相似水平下的OTU进行生物信息统计分析,将OTU与NCBI数据库比对并对OTU进行物种注释。利用交互式微生物多样性云分析平台(www.majorbio.com,上海美吉生物医药科技有限公司)进行Alpha多样性分析,包括Shannon指数、Simpson指数、ACE指数和Chao l指数;采用RDP classifier贝叶斯算法对OTU代表序列进行分类学分析,并统计各样本的物种组成和相对丰度,绘制柱状图和韦恩图。
2 结果与分析
2.1 冬小包脚菇子实体分子鉴定
经PCR扩增和序列测定,结果显示供试冬小包脚菇菌株rDNA ITS区段长度为640 bp,上传GenBank得到登录号为OM108495,经Blast比对,与Volvopluteus gloiocephalus和Volvariella gloiocephala相似性较高,下载相似序列20条,并结合托光柄菇属(Volvopluteus)、包脚菇属(Volvariella)及光柄菇科下光柄菇属(Pluteus)常见种序列,共同构建冬小包脚菇系统发育树。由图2可知,该系统发育关系可分为三大类群,包脚菇属、托光柄菇属和光柄菇属各为一个类群,且冬小包脚菇属于托光柄菇属类群;若分为两大类群,包脚菇属和托光柄菇属在同一类群,为传统定义的包脚菇属,光柄菇属单独为一个类群,既冬小包脚菇属于传统定义的Volvariella类群。

图2 基于ITS序列构建的冬小包脚菇系统发育树
2.2 菌基土壤理化性质分析
由表1可知,冬小包脚菇不同生长发育期菌基土壤全氮、全磷、全钾含量无显著差异(P>0.05)。土壤速效养分指标碱解氮、速效钾和有机质均表现为先增加后减少的趋势,伸长期(L2)最高,自溶期(A4)最低。有效磷含量表现为成熟期(M3)>伸长期(L2)>自溶期(A4)>蛋形期(E1),成熟期(M3)和伸长期(L2)的含量显著高于自溶期(A4)和蛋形期(E1)。冬小包脚菇菌基土壤显弱酸性,不同生长期pH值波动较小,在6.45~7.02之间。
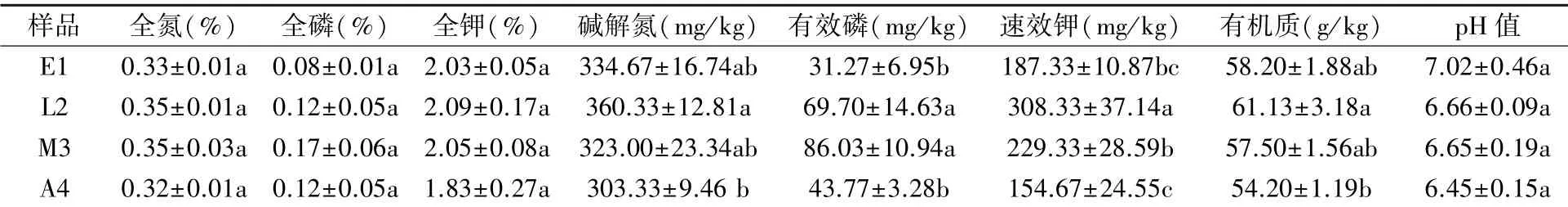
表1 冬小包脚菇土壤理化性质
2.3 野生冬小包脚菇菌基土壤微生物多样性分析
如图3A所示,冬小包脚菇菌基土壤中共获得2 645个细菌OTUs,4个生长阶段依次分别有2 590、2 579、2 579、2 578个OTUs。冬小包脚菇各生长阶段菌基土壤共有OTUs为2 462个,蛋形期(E1)特有14个OTUs,伸长期(L2)特有6个OTUs,成 熟 期(M3)和 自 溶 期(A4)特 有1个OTU。
如图3B所示,冬小包脚菇菌基土壤中共获得590个真菌OTUs,4个生长阶段依次分别有454、473、460、444个OTUs。冬小包脚菇不同生长阶段菌基土壤共有OTUs为309个,蛋形期(E1)特有18个OTUs,伸长期(L2)特有28个OTUs,成熟期(M3)特有8个OTUs,自溶期(A4)特有21个OTUs。
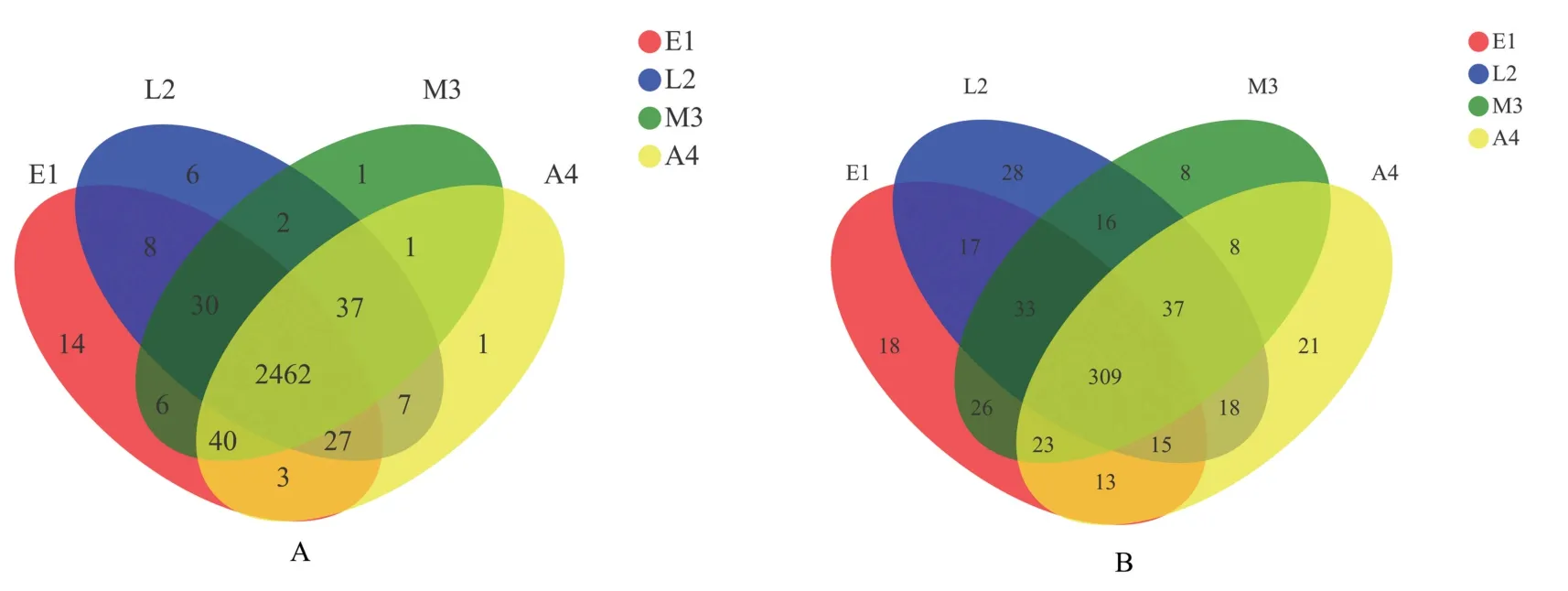
图3 细菌(A)、真菌(B)OTU样本分布韦恩图
如表2所示,各样品细菌的覆盖度均大于98.00%,真菌覆盖度均大于99.00%,能够代表相应样本中细菌和真菌的真实信息。细菌和真菌的Shannon指数和Simpson指数在冬小包脚菇不同生长发育阶段间差异不显著(P>0.05)。从丰富度指数可以看出,细菌的ACE指数和Chao 1指数在冬小包脚菇不同生长阶段间差异不显著(P>0.05);真菌的ACE指数和Chao 1指数在冬小包脚菇不同生长阶段间存在差异,整体表现为先增加后下降的趋势,均在成熟期(M3)达到最大值,说明成熟期冬小包脚菇菌基土壤真菌群落最为丰富。
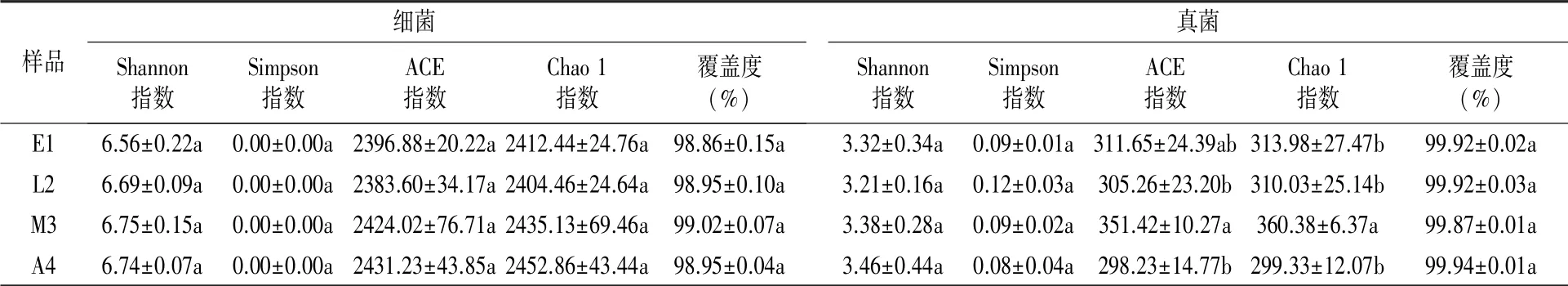
表2 冬小包脚菇菌基土壤微生物群落Alpha多样性分析
2.4 野生冬小包脚菇菌基土壤微生物群落结构分析
冬小包脚菇菌基土壤细菌共鉴定出22个纲,丰富度排名前十的纲按占比依次分别为α-变形菌纲(Alphaproteobacteria)13.36%(该值为各生长阶段平均值,下同)、低温丙型变形细菌纲(Gamma-proteobacteria)11.85%、放线菌纲Actinobacteria 11.24%、厌氧绳菌纲(Anaerolineae)7.54%、Vicinamibacteria 7.50%、嗜热油菌纲(Thermoleophilia)6.14%、酸微菌纲(Acidimicrobiia)3.15%、拟杆菌纲(Bacteroidia)2.74%、酸杆菌纲(Acidobacteriae)2.41%、芽单胞菌纲(Gemmatimonadetes)2.27%(图4A)。随着冬小包脚菇的生长发育,菌基土壤细菌中α-变形菌纲、低温丙型变形细菌纲、放线菌纲的占比整体表现为逐渐下降的趋势,不同生长发育期间其他细菌门相对丰度差异均较小。
如图4B所示,冬小包脚菇菌基土壤真菌共鉴定出11个纲,丰富度排名前十的纲占比依次分别为粪壳菌纲(Sordariomycetes)38.76%、盘菌纲(Pezizomycetes)18.97%、被孢霉纲(Mortierellomycetes)17.03%、座 囊 菌 纲(Dothideomycetes)6.19%、锤舌菌纲(Leotiomycetes)5.87%、伞菌纲(Agaricomycetes)4.90%、罗兹菌门未确定纲(unclassified_p_Rozellomycota)2.02%、油壶菌纲(Olpidiomycetes)1.60%、被孢霉门未确定纲(unclassified_p_Mortierellomycota)1.32%、散囊菌纲(Eurotiomycetes)1.16%。各生长阶段,粪壳菌纲为主要优势类群,盘菌纲和被孢霉纲在冬小包脚菇不同生长期的分布存在差异,具体表现为蛋形期(E1)和伸长期(L2)粪壳菌纲和被孢霉纲为优势纲,成熟期(M3)和自溶期(A4)粪壳菌纲和盘菌纲为优势纲。随着冬小包脚菇的生长发育,菌基土壤真菌中粪壳菌纲和被孢霉纲占比表现为下降趋势,盘菌纲整体表现为逐渐增加的趋势。

图4 土壤细菌(A)、真菌(B)纲水平上组成差异
如图5A,在属水平上,冬小包脚菇菌基土壤细菌群落中优势属为norank_f_norank_o_Vicinamibacterales(分类学谱系中未分类的科学名称,标记为unclassified;分类系统中无该类层级的科学名称,标记为norank),占比超过1.00%的属有16个。冬小包脚菇菌蛋形期(E1)土壤中norank_f_norank_o_Vicinamibacterales、norank_f_KD4-96、unclassified_f_Intrasporangiaceae、Gaiella为优势细菌群落(相对丰度>2.00%),伸长期(L2)土壤中norank_f_norank_o_Vicinamibacterales、norank_f_KD4-96、norank_f_Gemmatimonadaceae为优势细菌群落;成熟期(M3)菌基土壤中norank_f_norank_o_Vicinamibacterales、norank_f_Vicinamibacteraceae、norank_f_KD4-96、unclassified_f_Intrasporangiaceae为优势细菌群落;自溶期(A4)norank_f_norank_o_Vicinamibacterales、norank_f_67-14、Gaiella、norank_f_KD4-96为优势细菌群落。不同生长发育期其他细菌属相对丰度存在一定差异,norank_f_norank_o_Vicinamibacterales的相对丰度在冬小包脚菇不同生长发育期菌基土壤中都超过2.00%,为共有优势群落。但细菌群落相对丰度都低于6.00%,且在属水平上未知分类细菌在48.00%以上。
如图5B,冬小包脚菇菌基土壤真菌群落优势属为被孢霉属(Mortierella),占比超过2.00%的属有11个。蛋形期(E1)菌基土壤中被孢霉属、Pseudaleuria属、瓶毛壳属(Lophotrichus)为优势真菌群落(相对丰度>10%);伸长期(L2)菌基土壤中被孢霉属、Pseudaleuria属为优势真菌群落;成熟期(M3)菌基土壤中被孢霉属、Pseudaleuria属、瓶毛壳属为优势真菌群落;自溶期(A4)菌基土壤中被孢霉属、Pseudaleuria属为优势真菌群落。冬小包脚菇不同生长发育期属相对丰度存在一定差异,被孢霉属和Pseudaleuria属的相对丰度在菌基土壤中均超过10.00%,为共有优势群落。

图5 土壤细菌(A)、真菌(B)属水平上的热图分析
2.5 土壤真菌、细菌优势属与土壤理化因子相关性分析
选择在分类水平总丰度前8的门,评估冬小包脚菇菌基土壤细菌、真菌与环境变量之间的相关性。由表3可知,冬小包脚菇菌基土壤细菌中绿弯菌门与土壤pH值呈显著负相关;厚壁菌门与土壤全磷、有效磷含量呈显著正相关;拟杆菌门与土壤碱解氮含量呈显著正相关。其他细菌群落与土壤理化性质之间的相关性不显著。土壤真菌优势门与土壤理化因子相关性分析结果显示,罗兹菌门与土壤全氮、全钾含量呈显著或极显著正相关;油壶菌门与土壤全磷含量呈显著正相关;壶菌门与土壤全氮、全钾、有机质含量呈显著或极显著负相关;捕虫霉门与土壤有效磷含量呈显著正相关。
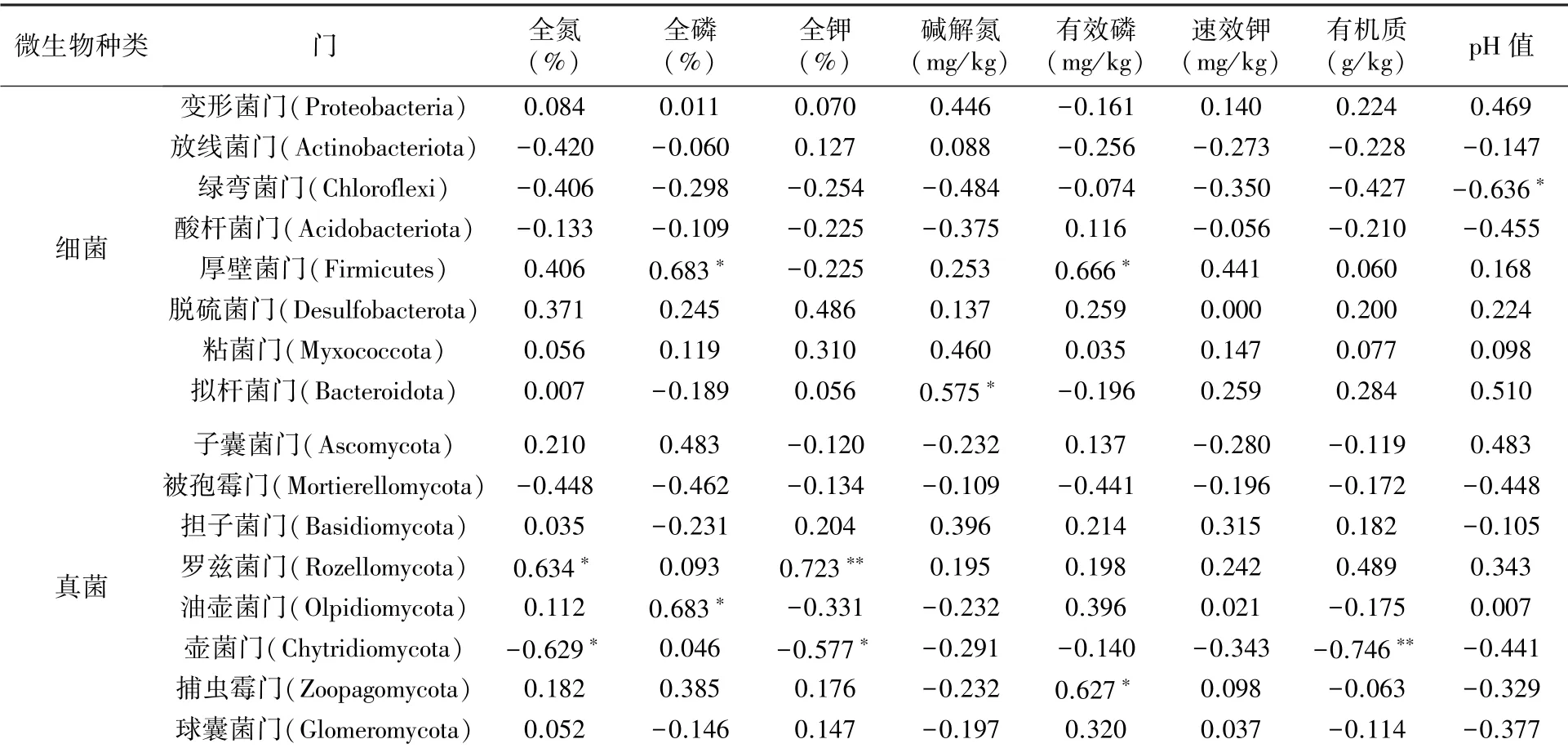
表3 土壤微生物优势门与土壤理化因子相关性分析

3 讨论与结论
对冬小包脚菇进行系统发育关系研究发现,其属于Volvopluteus类群,也可属于传统定义的Volvariella类群。Volvopluteus是2011年由Justo等[11,12]从传统Volvariella类群中分出来的新类群,而冬小包脚菇早在1987年就已被命名。在系统发育关系中,冬小包脚菇同粘盖草菇亲缘性较近,但两者在子实体菌盖颜色和发生季节等方面都存在明显差异[13]。在不同生长发育期的菌基土壤中也发现了一定量的Volvopluteus类群序列,这说明冬小包脚菇菌基土壤中含有大量自身菌丝,这也是冬小包脚菇出菇的前提。
微生物群落多样性研究表明,在冬小包脚菇不同生长发育阶段菌基土壤真菌物种丰富度ACE指数和Chao 1指数存在明显差异,整体表现为先增加后下降的趋势,均在成熟期(M3)达到最大值。土壤细菌类群中,变形菌门的α-变形菌纲和低温丙型变形细菌纲、放线菌门的放线菌纲和嗜热油菌纲、绿弯菌门的厌氧绳菌纲、酸杆菌门的Vicinamibacteria纲均占明显优势,与赵玉卉等[14]对野生羊肚菌Morchella vulgaris根际细菌类群的研究结果一致。变形菌门分布广泛,是土壤中丰度最大的细菌之一,也是土壤中多种化学循环的重要参与者[15],其可能在冬小包脚菇菌基土壤的化学循环过程具有一定的作用。真菌类群中,子囊菌门的粪壳菌纲、盘菌纲、座囊菌纲、锤舌菌纲,被孢霉门的被孢霉纲,担子菌门的伞菌纲占明显优势,主要是由于稻草还田造成农田土壤中木质纤维素的含量增加,促使子囊菌门和担子菌门成为土壤真菌的优势类群[16]。但是菌基土壤中未定义的纲仍占有一定比例,表明菌基土壤中仍存在大量的未知细菌和真菌。
冬小包脚菇不同生长发育期优势菌属有一定的差异,但存在一些共有的类群。已知共有细菌类群主要有分枝杆菌属(Mycobacterium)、棒状杆菌属(Rokubacteriales)、类诺卡氏菌属(Nocardioides)、间孢囊菌属(Intrasporangium)、鞘氨醇单胞菌属(Sphingomonas)、节杆菌属(Arthrobacter)、硫杆菌属(Thiobacillus)等。间孢囊菌属某些菌株可显著降低土壤中铬的毒性,能独特地产碱性纤维素酶降解稻草中纤维素供冬小包脚菇生长[17,18]。鞘氨醇单胞菌属中的鞘氨醇单胞菌(Pseudomonas paucimobil)在降解环境污染物、抗氧化衰老、与植物互作等领域发挥重要作用[19,20]。杨倩倩等[21]对褐环乳牛肝菌(Suillus luteus)根际土进行研究发现,节杆菌属的P6菌株能高效降解土壤中的有机磷,表明食用菌可以通过影响菌基解磷细菌的种类来改善磷营养状况。菌基土壤共有的主要真菌为被孢霉属、Pseudaleuria属、瓶毛壳属、绿核菌属(Ustilaginoidea)、翅孢壳属(Emericellopsis)、托光柄菇属、Pseudeurotium属等。被孢霉属为主要优势真菌,可能是由于该属大多数种类是嗜冷真菌,长期施肥能导致农田土壤被孢霉属的丰度大量增加[22,23]。被孢霉属某些类群是重要的解磷真菌,能够从土壤中释放磷、缓解土壤酸化、降解稳定且难分解的有机物,对促进养分循环和保持土壤肥力具有重要作用[24-26]。绿核菌属的稻绿核菌(Ustilaginoidea virens)能侵染水稻穗部引发稻曲病,稻曲病不仅影响水稻产量和质量,还可产生毒素威胁人畜健康[27,28]。
在冬小包脚菇生长的过程中,土壤pH值逐渐减低,全氮和全磷含量表现为先增加后减少的趋势,成熟期全氮和全磷含量最高,这与苏德伟等[29]研究棘托竹生长土壤养分的变化结果一致;土壤pH值逐渐减低可能与冬小包脚菇生长发育过程中的代谢产物有关。在冬小包脚菇不同生长阶段菌基土壤中细菌丰度较高的变形菌门和放线菌门与土壤理化因子间无显著相关性,这与李艳春等[30]对茶园间作灵芝中土壤、魏艳晨等[31]对珍珠猪毛菜根际土壤的研究结果一致。厚壁菌门与土壤全磷、有效磷含量呈显著正相关,表明其更适合生存于磷含量较高的土壤。子囊菌门、担子菌门与大部分土壤养分元素无明显相关性,说明这类菌群对外界环境适应性较好,可能与冬小包脚菇生长在收割完水稻轮作的农田里,水稻秸秆还田和追加农家肥提供了其充足的养分有关。
本研究明确了冬小包脚菇不同生长发育阶段菌基土壤细菌、真菌的多样性及群落结构,分析了土壤和主要微生物类群的关系。下一步研究中应选择更为系统和科学的方法,研究微生物群落、环境因子与冬小包脚菇出菇关系,探索影响冬小包脚菇人工栽培的关键因子。
