ACLY抑制剂脱氢弯孢霉菌素肝微粒体代谢
2022-10-20周富贵李玉兰蔡晓蓉邓张双
周富贵, 李玉兰, 蔡晓蓉, 薛 莲, 邓张双*
(1.三峡大学天然产物研究与利用湖北省重点实验室, 湖北 宜昌 443002;2.宜昌市中心人民医院三峡大学第一临床医学院, 湖北 宜昌 443003;3.三峡公共检验检测中心, 湖北 宜昌 443000; 4.宜昌东阳光制药有限公司, 湖北 宜昌 443311)
脱氢弯孢霉菌素(dehydrocurvularin,DCV)是一种天然来源的聚酮类化合物,结构上由一个间二羟基苯环与一个十二元内酯环相连,最初由Musgrave等[1]从弯孢属(Curvulariasp.)真菌的次级代谢产物中分离获得.DCV具有植物毒性[2]、抗菌[3]、抗炎[4]、抗线虫[5]以及广泛的抗肿瘤活性[6-7],应用前景广阔.课题组前期筛选获得了一株脱氢弯孢霉菌素的高产菌株曲霉Aspergillussp. WG4,经PDB摇瓶发酵后乙酸乙酯萃取和重结晶操作,能实现DCV的千克级制备(DCV产率30%)[8],同时对DCV的抗炎[9]、抗肿瘤靶点[10]进行了研究,利用化学探针结合蛋白质组学,确证了DCV作用靶点为ATP-柠檬酸裂解酶(ACLY)[11].目前文献研究主要涵盖了DCV的微生物来源、生物活性以及有机和生物合成研究[12],暂未见DCV代谢相关研究报道.本文以结构相似的弯孢霉菌素(curvularin,简称CV)作为内标,建立了HPLC检测方法用于检测DCV浓度,考察了DCV在不同种属来源肝微粒体中的代谢速率差异,并推测了可能的代谢产物,对DCV代谢特点做了初步探索,为DCV可药性开发提供一定参考.
1 仪器与材料
1.1 仪器
Ultimate 3000型高效液相色谱仪(美国Dionex公司);Synapt G2型UPLC-Q-TOF-MS仪(美国waster公司);Vortex genie 2漩涡仪(上海芃奇科学仪器有限公司);Centrifuge 5418 R高速冷冻离心机(Eppendorf中国有限公司);DK-8A型电热恒温水槽(上海精宏实验设备有限公司);FA2104B分析天平(上海越平科技有限公司).
1.2 药物与试剂
待测原型药脱氢弯孢霉菌素,实验室自制[8],HPLC检验纯度95%左右.内标化合物弯孢霉菌素,实验室自制[13],HPLC检测纯度95%左右.混合雄性SD大鼠、比格犬、恒河猴以及男性人肝微粒体酶(20 mg·mL-1);还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)再生系统(A 液和B 液);配套磷酸缓冲液(PBS)均购自北京汇智泰康医药技术有限公司,于-80°C保存.
2 实验方法
2.1 实验测定条件
2.1.1 高效液相测定条件 Ultimate 3000型高效液相色谱仪;YMC-Pack ODS-A型 C18色谱柱;检测波长:220 nm;流动相:水(A)/乙腈(B),梯度洗脱(0~35 min,5%~50%B体积比);体积流量:1 mL·min-1;进样体积10 μL.
2.1.2 质谱测定条件 UPLC-MS系统使用ESI离子源,负离子模式,采集范围为m/z100~1 200,毛细管电压为2.5 kV,喷雾电压4.5 kV,雾化气体为N2.流动相: 水(A)/乙腈(B),梯度洗脱(0~15 min,5%~50%B体积比).
2.2 DCV含量测定方法学考察
肝微粒孵育体系(500 μL): PBS溶液420 μL,NADPH体系A液25 μL和B液5 μL在冰水浴上临时混合后加入体系,再加入DCV工作液5 μL,37 °C预热5 min后加入混合肝微粒体酶溶液,37 °C水浴孵育.温孵后处理:向适量温孵液中加入等体积含内标的冰乙腈溶液,旋涡混匀,12 000 r·min-1离心10 min,取上清液分析,每组平行3次分析结果取平均值.
2.2.1 专属性及线性关系考察 专属性:取相同浓度DCV工作液5 μL分别加入各500 μL的流动相溶剂、空白肝微粒体孵育液以及空白血清中,按上述温孵后处理方式处理,考察DCV和CV在2.1.1分析条件下是否受空白肝微粒体孵育液中基质干扰.
检测限和定量限:经预实验确定DCV能检出的浓度范围,然后准确称取DCV溶解,依次稀释成不同浓度的样品溶液并检验,经分析HPLC谱图中DCV峰面积与其保留时间附近的噪音峰比值确定该方法下待测化合物DCV的检测限(信噪比≥3)和定量限(信噪比≥10),每组重复检验3次.
标准曲线:精确称取DCV,依次稀释配制成浓度分别为1、2、4、8、16 mg·mL-1的DCV标曲工作液,各取5 μL加入500 μL的肝微粒空白温孵体系(孵育体系中加入失活的肝微粒体酶),即DCV理论浓度相应为10、20、40、80、160 μg·mL-1,按照孵育后处理,HPLC分析,以DCV理论浓度为横坐标,所检测的DCV与CV的峰面积比值为纵坐标进行线性拟合.
2.2.2 准确度和精密度考察 另外配制高、中、低(100、50、10 μg·mL-1)三种质量浓度(下同)的DCV质控工作液按上述处理方法分析,带入上述标准曲线获得测定浓度,每个浓度平行3~5份, 计算各质控样品的回收率以及各组相对标准偏差(%)来考察准确度和精确度.
2.3 脱氢弯孢霉菌素体外肝微粒体孵育条件筛选
2.3.1 温孵时长对DCV代谢的影响 温孵体系暂选用DCV工作液浓度为8 mg·mL-1,暂定体系中肝微粒体酶浓度为2 mg·mL-1.于0、30、60、90、120、150 min从体系中取出温孵液100 μL,立刻加入等体积的内标溶液混匀,离心取上清液分析.将孵育0 min的DCV浓度作为100%,其他各时间点的底物剩余浓度相应转化为剩余百分数,获得底物剩余量百分数与孵育时间的关系.
2.3.2 肝微粒体酶浓度对DCV代谢的影响 向500 μL体系中分别添加20 mg·mL-1的肝微粒体酶 0、10、 20、 30、 40、 50 μL,即混合肝微粒体酶在体系中的理论浓度分别为:0.4、0.8、1.2、1.6、2.0 mg·mL-1,温孵后同上述温孵后处理取样分析,获得底物剩余量百分数与肝微粒体酶浓度的关系.
2.3.3 初始DCV浓度对其代谢的影响 向500 μL体系中分别加入5 μL不同浓度的 DCV工作液(1、2、4、8、16 mg·mL-1)温孵,即体系中DCV初始理论浓度分别为10、20、40、80、160 μg·mL-1,温孵时长和肝微粒体浓度取2.3.1及2.3.2项下相应合适条件实验.温孵后同上述方式处理,获得底物剩余量百分数与DCV初始浓度的关系.
2.4 DCV肝微粒体代谢速率种属差异性研究
在最佳体外肝微粒体温孵条件下,考察DCV在不同来源肝微粒体酶中的代谢稳定性,每30 min从温孵体系中取样分析.将孵育0 min的DCV浓度作为100%,其他各时间点的底物剩余浓度与其对比转化为剩余百分数,获得不同种属肝微粒体酶与DCV的剩余百分数随时间的变化关系.将各个时间点DCV剩余百分数的自然对数与孵育时间经线性回归,获得斜率k,然后按下述公式计算半衰期t1/2和清除率CLint.
t1/2=0.693/k,
2.5 DCV肝微粒体代谢产物研究
将所得四种肝微粒体孵育处理液在2.1.2质谱条件下进行检测,用软件MassLynx 5.1分析数据,并推测可能的代谢产物和代谢位点.
3 结果与分析
3.1 DCV含量测定方法学考察
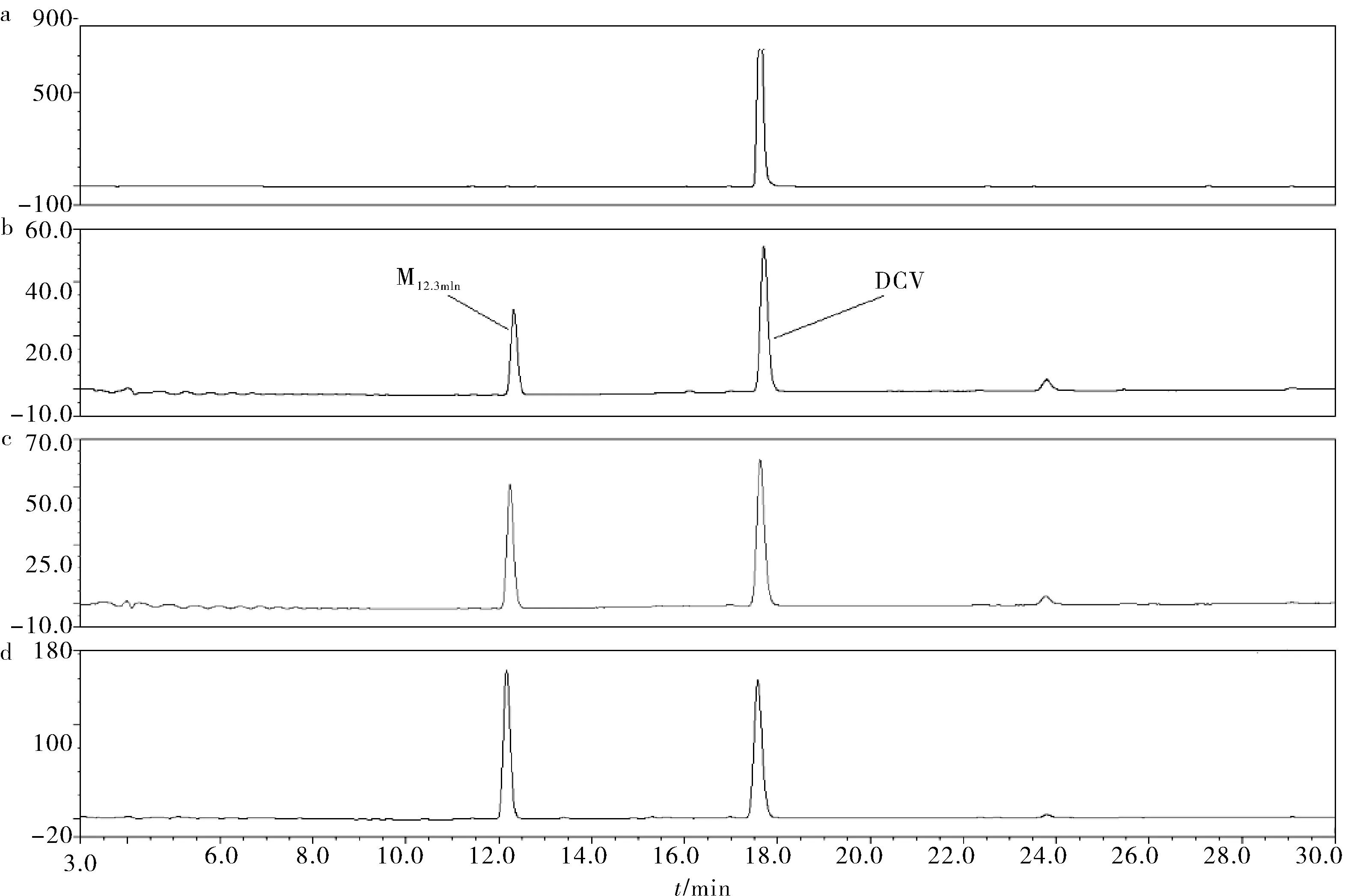
在2.1.1分析条件下,经过稀释重复进样,考察了HPLC数据中DCV与其附近噪音峰的峰面积比值并重复检验确定DCV的检测限为0.625 μg·mL-1,定量限为1.25 μg·mL-1(图1),且该检测条件下DCV与CV能达到基线分离(图2),出峰时间分别为33.36和35.33 min.检测不受包括空白肝微粒体孵育体系中各基质干扰,可用于各样品中DCV含量测定.利用GraphPad Prism 7.0软件数据处理求得直线回归方程为y=0.05194x+0.3458 (R2=0.9948).各质控样品的平均回收率分别为108.12%、102.44%和98.74%,高、中、低浓度工作液组内RSD分别为7.63%、9.02%和9.24%,即样品DCV浓度在10~160 μg·mL-1范围内该检测方法可行.
a. 空白对照;b. 浓度为10 μg·mL-1的DCV样品;c. 稀释浓度为5 μg·mL-1的DCV样品;d. 稀释浓度为1.25 μg·mL-1的DCV样品;e.浓度为0.625 μg·mL-1的DVC样品图1 DCV的定量限和检测限Fig.1 Detection limit and quantitative limit of DCV

图2 DCV与内标CV的HPLC分离示意图Fig.2 Resolution of DCV and CV
3.2 体外肝微粒体孵育条件优化
以SD大鼠来源肝微粒体酶为例,考察在孵育体系中孵育时长、酶浓度和底物浓度孵育时长对底物剩余百分数的影响,各关系曲线如图3所示.选择底物消耗基本不再增加的孵育时长(150 min左右),以及与底物剩余百分数呈线性关系的体系酶浓度(1.6 mg·mL-1)和底物初始浓度(80 μg·mL-1)进行后续试验.

图3 DCV剩余百分率与孵育时长(a)肝微粒体酶浓度(b)及底物浓度(c)的关系Fig.3 Correlation between residual percentage of DCV and incubation duration (a), liver microsomal enzyme concentration (b) and substrate concentration (c)
3.3 DCV肝微粒体代谢种属性差异
如图4所示,以孵育时间为横轴,以底物剩余百分比的自然对数为纵轴,GraphPad Prism 7.0软件数据处理获得相应的线性关系为人(H):y=-0.006076x+4.472 (R2=0.9243);恒河猴(M):y=-0.009819x+4.605 (R2=0.9767);比格犬(D):y=-0.003133x+4.573 (R2=0.9671);SD大鼠(R):y=-0.003743x+4.479 (R2=0.8425).利用上述曲线斜率k值求得DCV在各种属肝微粒体酶中相应的半衰期t1/2和肝微粒体固有清除率CLint,数据结果见表1.

图4 不同肝微粒体中DCV剩余百分数的 自然对数与孵育时间的线性关系Fig.4 Metabolism rate differences of DCV during incubation with different liver microsomes
3.4 体外肝微粒体代谢产物推测
3.4.1 UPLC-MS推测产物 如图5所示,四组样品UPLC-MS结果相近,负离子模式下除了DCV(289 [M-1]-)和内标CV (291 [M-1]-)的离子峰,出现了与底物DCV离子峰质荷比一样的另一个M2: 289 [M-1]-离子峰以及M1: 305 [M-1]-和M3: 339 [M+H2O-1]-离子峰,其中M3为主要代谢产物.根据DCV的结构特点,双键可能是最主要的代谢位点.其中,离子峰289 [M-1]-的形成推测有两种可能机制:一种是DCV的α,β不饱和双键因烯醇互变在水溶液中以DCV和M2两种结构存在(图6途径A1);另一种可能是双键先被羟基进攻形成11-羟基弯胞霉菌素中间体,然后该结构中的11位羟基与7位的羟基经分子内脱水缩合成六元环结构M2′,即化合物curvulopyran (图6途径A2).此外,DCV的双键也可能先发生环氧化反应生成epoxycurvularin,给出305 [M-1]-离子峰M1,然后进一步被羟基进攻开环生成10,11-邻羟基弯胞霉菌素,在质谱中脱去一分子水形成339 [M-1]-离子峰M3(图6途径B).

表1 DCV在不同种属肝微粒体中的半衰期(t1/2)和 体内固有清除率(CLint)Tab.1 t1/2 and CLint of DCV incubation with different hepatic microsomes
3.4.2 DCV稳定性探讨 文献调研发现,DCV的11位羟基加成产物在众多产DCV真菌的次级代谢产物中均有发现[4,7,14],但Vederas等[15]认为11位羟基的生成为一种化学反应过程而非真菌代谢产生.为进一步考察DCV的稳定性,本实验建立了DCV的稳定性试验,考察溶液pH值对其结构稳定性的影响.配制pH值分别为6、7、8的磷酸缓冲液(PBS),各取5 mL,分别加入脱氢弯孢霉菌素标准品5 mg,涡旋使尽量分散均匀,超声2~3 h后室温静置24 h.过滤后各取20 μL样品用于HPLC分析,并设置乙腈溶解的DCV作为对照分析,流动相:水(A)/乙腈(B),全梯度洗脱(0~30 min,体积分数10%~100%B).液相分析结果如图5所示,DCV的保留时间为17.5 min,在各缓冲液中有明显区别于DCV的峰,其保留时间为12.3 min(将该峰记为M12.3min).M12.3min与DCV峰的峰面积比值由0.53 (pH=6)上升到0.91(pH=8),与缓冲液pH值呈正相关.表明在PBS中DCV可能发生了非酶催化的化学转变,形成烯醇异构或与水的加成产物,且该转变程度与溶液OH-浓度正相关.

图5 DCV肝微粒体代谢UPLC-MS离子流Fig.5 UPLC-MS results of hepatic microsomal metabolism of DCV

图6 DCV肝微粒体代谢历程推测Fig.6 Speculative route of DCV in liver microsomal metabolism
4 结论
DCV是一种活性优异的真菌次级代谢产物,有望成为临床抗肿瘤候选药物,本文为首次报道的对该类化合物代谢研究,对DCV的可药性开发提供了一定参考.实验表明DCV在不同的体外肝微粒体孵育体系中表现出了种属性速率差异,其代谢产物可能与结构中α、β不饱和双键密切相关.可能的代谢产物curvulopyran[16]和epoxycurvularin[17]也见于产DCV的真菌次级代谢产物中,这表明肝微粒体和真菌发酵液中可能同时具有起类似作用的氧化酶和缩合酶.而DCV在PBS中的稳定性试验则暗示在水溶液中DCV存在非酶催化的稀醇互变异构体或者羟基取代衍生物,后者或在孵育条件下进一步分子内脱水形成curvulopyran,这也可能是肝微粒代谢结果中出现两处289 [M-1]-离子峰的原因.
a. 乙腈溶解的DCV样品; b. pH值为6的PBS中溶解的DCV样品; c. pH值为7的PBS中溶解的DCV样品; d. pH值为8的PBS中溶解的DCV样品图7 DCV在PBS中的稳定性Fig.7 Instability of DCV in PBS
DCV结构中的α、β不饱和双键是良好的Michael加成位点,也是DCV活性的重要结构,其还原及取代产物所表现出的抗肿瘤活性都明显低于DCV,有必要对双键采取一定的保护措施以维持DCV的活性和控制药效时长.化合物roseopurpurin[18]的活性研究报道为保护α、β不饱和双键活性部位提供了重要的思路,即通过可逆向的Michael加成反应使前体化合物在适宜的条件下转变成真正的活性化合物脱氢弯孢霉菌素进而发挥药用.
