微反应器中他达拉非的高效合成及其动力学研究
2022-10-20李军峰杨红军毛志鹏宋青明
李军峰,杨红军,毛志鹏,李 闯,宋青明,许 蓉,陈 建
(武汉理工大学化学化工与生命科学学院, 武汉 430070)
近年来,他达拉非的合成受到越来越多的化学家的关注,因为其被广泛应用于男性功能性勃起障碍和心血管疾病[1-2],是一种重要的医药原料.与西地那非相比,它的副作用减少,持续时间更长,有效时间更长,疗效更好,是首次获批上式的5型磷酸二酯酶(PDE5)抑制剂[3].2018年他达拉非销售额达到25亿美元,占同类药市场的一半,具有广阔前景.
他达拉非的合成采用Orem路线[4],如图1所示,用四氢呋喃作溶剂,以四氢咔啉衍生物与甲胺乙醇溶液为原料,他达拉非产率可达70%.Zhang等[5]对此方法做了改进,以氯仿作为溶剂,产率可达80%.但氯仿具有低毒性且为管制品,这限制了此种方法的应用.而蔡明德等[6]将Orem路线中甲胺乙醇溶液改为甲胺水溶液,产率可达84%.甲胺水溶液比甲胺乙醇溶液更加易得和安全,适合工业生产.
然而,目前这些合成方法都是在间歇反应釜中完成,耗时长,产品稳定性差,需要复杂的后处理来处理副产物,因此造成能耗高和生产成本高.因此,有必要开发一种高效的合成工艺来提高他达拉非生产效率.
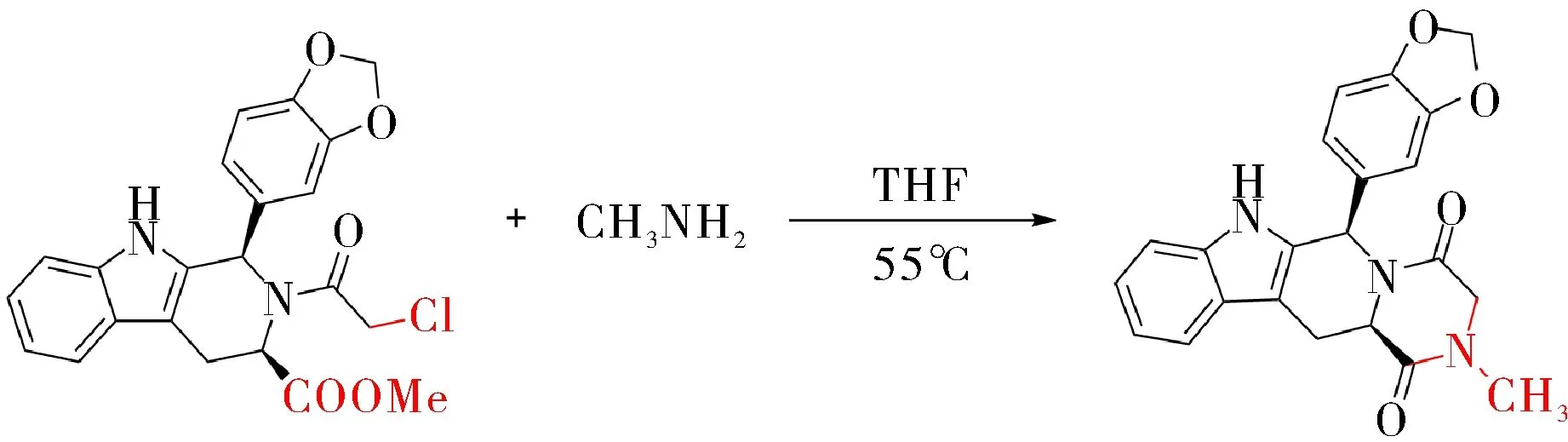
图1 他达拉非合成路线Fig.1 Synthesis of tadalafil
在有机合成中引入连续流合成技术代表了一种在有机化学中非常有用的方法[7-9].凭借微结构的特征,不仅操作安全,而且快速混合,传质和传热效率高,并且能精确的控制停留时间.与传统间歇式反应器相比,微通道反应器具有更大的表面积比、更高的传热传质速率和更高的安全性.微反应器目前已成为各种反应过程强化的有力平台,使间歇处理向连续流处理的方向发展[10-12].已经有许多优秀的研究人员选择了新兴的微反应器技术来合成有机化合物,并取得了良好的效果[13-14].因此,建立这样的微型化工厂可以克服市场对他达拉非的巨大需求.同时在微反应器中连续合成他达拉非未见报道.此外,在接近工业流程的操作条件下,他达拉非环合反应动力学至今未见报道.这种反应动力学的研究对于工艺优化和进一步了解反应机理具有重要意义.
本文建立了他达拉非的连续流合成方法,系统考察了总流量、反应温度、底物浓度、反应物物质的量的比和停留时间等因素对反应性能的影响.在实验数据的基础上,建立了反应动力学模型,以更好地理解这一环合过程.通过实验结果与计算结果的比较,验证了该方程的合理性.
1 实验部分
1.1 试剂与仪器
试剂:四氢咔啉衍生物,工业级,药明康德有限公司;甲胺水溶液(质量分数为40%),化学纯,国药集团化学试剂有限公司;四氢呋喃、乙腈、甲醇,色谱级,阿拉丁试剂有限公司.
仪器:1260 Infinity II型高效液相色谱仪(HPLC),美国Agilent公司;MPF1002C型平流泵,上海三为科学仪器有限公司;2 mm × 3 mm型聚乙烯四氟管,上海简流流体有限公司;RBG钛合金背压阀,上海析钛流体有限公司.
1.2 微反应器中他达拉非的连续流合成
他达拉非的间歇合成方法在文献中已有报道[6],本文采用四氢呋喃作溶剂,以四氢咔啉衍生物与甲胺水溶液为原料,在微反应器中合成他达拉非,如图2所示.在这项工作中,微反应器系统主要由T型微混合器和聚四氟乙烯毛细管组成.将四氢咔啉衍生物溶解在四氢呋喃中,四氢咔啉衍生物溶液和甲胺水溶液以一定的流量比通过两个恒流泵输送到微反应器系统中.通过改变毛细管长度来控制停留时间.将微反应器系统浸入水浴中以维持恒定温度.特别地,为了防止甲胺气化,在管道尾部装有背压阀,反应压力控制在1 MPa.

图2 微反应器合成他达拉非装置示意图Fig.2 Schematic diagram of synthesis of tadalafil using microreactor
1.3 分析
当微反应器系统达到稳定状态时,直接从出口采集样品,用高效液相色谱仪测量样品含量.高效液相色谱条件:C18色谱柱(5 μm,4.6×150 mm),流动相为70%乙腈和30%三氟乙酸水溶液,三氟乙酸含量为0.2%,流动相流速为1 mL·min-1,检测波长为254 nm.产率由下列方程计算:
(1)
式中,cT(mmol·mL-1)是采集样品中他达拉非的浓度;Ft(mL·min-1)是溶液总流量;cS(mmol·mL-1)是四氢咔啉衍生物的初始浓度;FS(mL·min-1)是四氢咔啉衍生物溶液的流量;所有实验在相同条件下重复反应3次,实验数据是3次测量的平均值.
2 结果与讨论
2.1 微通道反应器性能
反应过程需要确定总流量以确保在反应过程中有效的传质性能.图3显示了他达拉非产率随总流量的不同而变化图,其中四氢咔啉衍生物溶液和甲胺水溶液流量相等.如图所示,他达拉非产率随着流量的增加而急剧增加,这表明低流量下的混合性能极大地控制了反应结果.当体积流量增加时,在微反应器中两种进料溶液之间的传质得到了改善.当总体积流量达到10 mL·min-1时,他达拉非产率不会继续增加,表明此时传质不再是该反应过程的限制因素.为了研究反应动力学,必须确保有效的混合性能,因此以下所有实验均在10 mL·min-1的总体积流速进行.
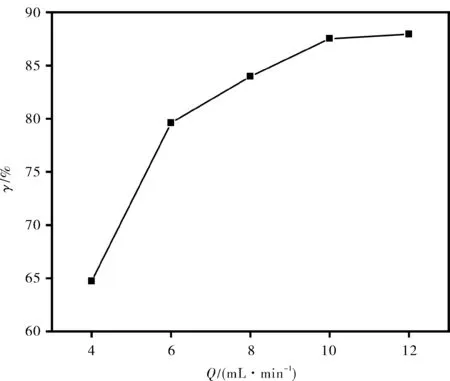
T=55 ℃,cS=2.0 mmol·mL-1,n=4,t=20 min图3 总流量对产率的影响Fig.3 Effect of total flow on yield of tadalafil
2.2 温度对他达拉非产率的影响
反应速率常数通常随温度的升高而增大,反应温度对反应速率有重要影响.如图4所示,在两种不同反应物溶液的总体积流量恒定的情况下,研究了微反应器中反应温度对产率的影响.结果表明,反应温度的升高显著加快了反应速率,反应温度对他达拉非的产率具有明显的积极影响.对于20 min的停留时间,当反应温度从35 ℃升高到65 ℃时,产率从50.2%提高到82.3%.温度的升高不仅加快了反应动力学,而且随着流体性质的改善,也增加了质量传递.但随着温度的进一步升高,温度对他达拉非产率促进作用不明显.

Q=10 mL·min-1,cS=2.0 mmol·mL-1,n=4图4 温度对他达拉非产率的影响Fig.4 Effect of temperature on the yield of tadalafil
2.3 底物浓度对他达拉非产率的影响
图5显示了在微反应器系统中四氢咔啉衍生物浓度对反应性能的影响.当底物浓度从1 mmol·mL-1增至2.5 mmol·mL-1,他达拉非产率迅速上升,进一步增加底物浓度只会使产物产率略有上升.四氢咔啉衍生物浓度从1 mmol·mL-1增加至1.5 mmol·mL-1时,他达拉非产率从62.8%增加至72.3%,而四氢咔啉衍生物浓度从2 mmol·mL-1增加至2.5 mmol·mL-1时,他达拉非产率从82.3%增加至84%.

Q=10 mL·min-1,T=65 ℃,n=4图5 底物浓度对他达拉非产率的影响Fig.5 Effect of substrate concentration on the yield of tadalafil
2.4 物质的量的比对他达拉非产率的影响
当甲胺供应不足时,一些副反应的选择性会增加.但过多的甲胺会增加后续分离段的负荷.因此,高效、经济地利用甲胺具有重要的现实意义.研究了环合过程中甲胺与四氢咔啉衍生物物质的量的比(n=nS/nN)对他达拉非产率的影响.如图6所示,他达拉非产率随着n的增加而增加.当n从2增大到5时,在20 min的停留时间内,他达拉非的产率从70.2%增加到88.3%,进一步增大n对产率提升不明显,因此n=5是合适的.

Q=10 mL·min-1,T=65 ℃,cS=2.5 mmol·mL-1图6 物质的量的比对他达拉非产率的影响Fig.6 Effect of molar ratio on the yield of tadalafil
2.5 与间歇反应对比
如表1所示,比较了不同工艺条件下他达拉非的产率.65 ℃条件下,在连续流动微反应器中进行反应,可在较短的时间内(20 min)获得较高的他达拉非产率(88.3%).在本课题组前期研究中,在相同下条件,在间歇反应器中反应2 h,产率为79.7%.这是因为微反应器的小空隙体积缩短了流体的扩散路径,导致反应物快速混合并且受热均匀,从而在短时间内获得较高的他达拉非产率.

表1 连续反应与间歇反应对比Tab.1 Contrast between continuous reaction and batch reaction
2.6 动力学研究
微反应器技术为反应动力学研究提供了有效的平台,基于微反应器提供的快速传热和传质,可以获得较准确的反应动力学参数.他达拉非合成动力学可以用式(2)表示
(2)
其中,cS、cN、cT分别是四氢咔啉衍生物.甲胺和他达拉非的浓度,α和β分别是四氢咔啉衍生物和甲胺的反应级数,k是反应速率常数.
2.6.1 反应级数的确定 为了确定反应物的反应级数,由图4和图5分别可得一组不同浓度的初始时刻的反应速率R0,此时另一组分的浓度是不变的,因此式(2)可以改为:
(3)
(4)
(5)
(6)
R0是初始时刻的反应速率,cS0,cN0是初始时刻四氢咔啉衍生物和甲胺的浓度.
对式(3)和式(4)两边取对数得:
lnR0=αlncS0+lnk1,
(7)
lnR0=βlncN0+lnk2.
(8)
绘制不同的lnR0-lncS和lnR0-lncN,如图7(a)和(b)所示.拟合曲线的相关系数分别为0.989 77和0.998 53,可近似的认为α=1和β=1,因此该反应的总级数为2.

图7 反应级数拟合结果Fig.7 Fitting results of reaction order
2.6.2 反应速率常数和活化能 反应活化能和指前因子可根据Arrhenius方程计算,如方程式(9)和方程式(10)所示:
(9)
(10)
其中,A为指前因子,Ea为活化能,R为气体常数,T为开尔文温度.
通过绘制不同温度下的lnk和1/T的关系,如图8所示,线性曲线拟合参数表明,反应活化能Ea=38.92 kJ·mol-1和指前因子A=6.27×1011mL·mol-1·s-1.
2.6.3 动力学模型检验 应用该动力学模型对不同反应条件(温度、停留时间、初始浓度)下他达拉非的产率进行了预测,以考察该模型的有效性,结果如表2所示.对实验值和计算值作图,如图9 所示,他达拉非产率的实验值与上述动力学模型的计算值进行了比较.图中显示了实验值和计算值之间的极好一致性,证实了该动力学模型能有效地描述他达拉非的合成过程.实验结果与预测结果之间的偏差可能是由于微反应器中并非理想流动.

图8 Arrhenius方程拟合结果Fig.8 Fitting results of Arrhenius equation

表2 不同条件下它达拉非产率实验值和计算值
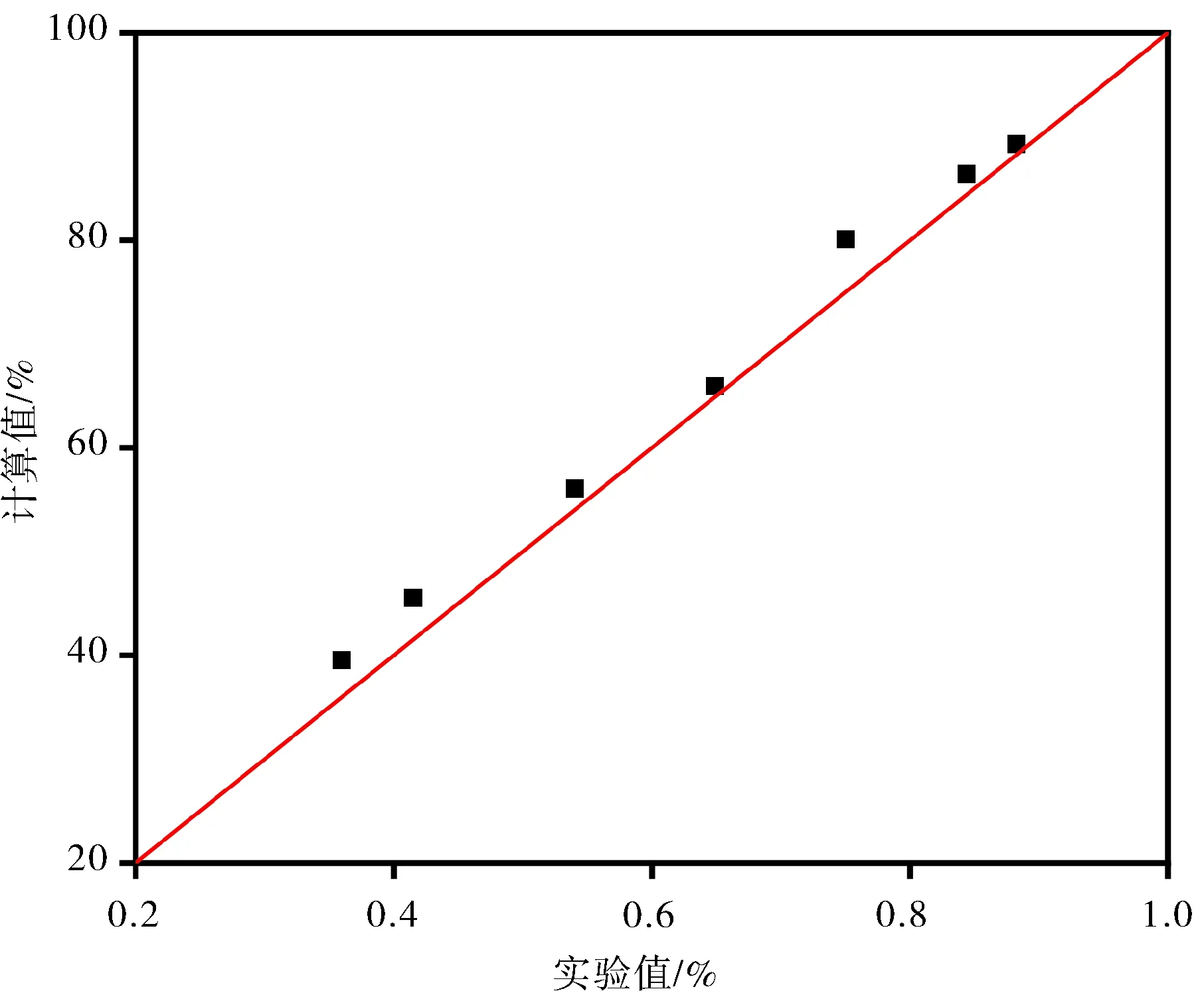
图9 实验值和计算值的比较Fig.9 Comparison between experimental values and predicted values
3 结论
在这项工作中,开发了一套连续流微反应器系统,以四氢咔啉衍生物和甲胺高效的合成了他达拉非.他达拉非的产率随反应温度、四氢咔啉衍生物物浓度、甲胺与四氢咔啉衍生物物质的量的比、停留时间的增加而增加.在65 ℃下,仅用20 min即可获得较高的他达拉非产率(88.3%).与传统间歇反应装置相比,微反应器采用连续化操作可以显著提高他达拉非生产效率.建立了反应幂律动力学模型,根据大量不同操作条件下的实验数据,得到了动力学参数,总的反应级数为2,指前因子为6.27×1011mL·mol-1·s-1,活化能为38.92 kJ·mol-1.此外,该动力学模型可以很好地预测产物浓度实验结果,表明该模型的合理性以及微反应器在动力学测量方面的广阔应用前景.
