胰腺癌患者术后静脉血栓栓塞症的发生率及其危险因素分析
2022-10-20崔松平李立详汪志忠星军华金中奎
王 明,崔松平,汪 京,李立详,汪志忠,星军华,金中奎
静脉血栓栓塞症(venous thromboembolism,VTE)包括深静脉血栓形成(deep vein thrombosis,DVT)和肺栓塞(pulmonary thromboembolism,PE),是静脉系统内血液凝固形成血栓所致的一类疾病,而癌症患者血栓形成的高发病率日益受到重视。近年来,有报道指出VTE是癌症患者的第二大死因[1]。胰腺癌目前的全球死亡率高居第六位[2],约17%~32%的患者在确诊时就已经发生门静脉系统侵犯[3-4]。由于肿瘤本身恶性程度高、易发生局部血管侵犯和远处转移等原因,5年生存率不到10%[5]。近期欧美国家的研究发现,胰腺癌患者中VTE的患病率为12%~36%[6-7],已逐步成为急诊科和肝胆外科术后的常见并发症。VTE一旦发生,不仅延长了患者的住院时间,也将影响患者的长期生存状况。相关指南推荐对于VTE中高危患者应进行围手术期预防,建议除使用弹性长袜或间歇性充气加压装置进行机械预防外,还应适当给予抗凝剂[8]。因此,明确该人群患者发生VTE的高危因素,对VTE高危人群的筛选具有重要意义。
1 资料与方法
1.1 一般资料 选取于安徽省庐江县人民医院121例及北京朝阳医院225例接受根治性胰十二指肠切除术的346例胰腺癌患者为研究对象。纳入标准:1)两个2017年6月—2021年12月收治的胰腺癌患者;2)术前影像学检查提示有门静脉系统侵犯;3)术中完整切除肿瘤及受侵血管;4)术前排除存在VTE;5)术后均行下肢多普勒超声明确有无DVT;6)手术方式和治疗策略获得患者及其家属知情同意;7)术中所涉及血管置换技术经过北京朝阳医院新技术及伦理委员会审批,符合伦理学规定。排除标准:1)术前影像学检查提示有远处转移:2)术前影像学检查提示有腹腔重要动脉侵犯;3)围手术期死亡;4)术后随访数据缺失。本研究取得首都医科大学附属北京朝阳医院伦理委员会批准(审批号:2017-科-303),所有参与研究的患者均于试验开始前签署知情同意书。
1.2 资料收集 采用统一的表格收集研究对象的一般资料,包括患者的基本信息(年龄、性别、身高、体质量等)、实验室检查(白细胞计数、淋巴细胞计数、血小板计数、D-二聚体、组织因子等)、手术的相关信息(血管重建方式、手术时长、出血量等)、肿瘤病理资料(肿瘤类型、分化程度等)。
VTE相关检查:入组患者手术前及术后均行下肢多普勒超声检查,如存在以下任一情况,还需行肺动脉造影(computer tomography pulmonary angiography,CTPA)证实有无新发PE:1)出现PE典型症状(胸痛、咯血或无法解释的低氧血症和呼吸困难);2)Caprini评分≥9分;3)术后新发的DVT。据此标准将本组346例患者分为VTE组(n=41)、无VTE组(n=305)。
1.3 围手术期处理 所有患者均实施根治性胰十二指肠切除术:依据静脉侵犯的具体形式采用不同的血管切除重建方式(静脉侵犯<180°,切除后直接缝合;静脉侵犯≥180°,切除后依据吻合张力行端端吻合或血管置换,本研究采用的血管均为同种异体血管,依据肿瘤具体位置决定手术方式,依据肿瘤侵犯静脉的类型和位置选用不同种类的异体血管进行置换。对于单独侵犯一支血管的患者,置换血管选用异体相匹配血管;对于侵犯静脉汇合部的患者,置换血管选用异体髂静脉分叉“Y”形血管),见图1。
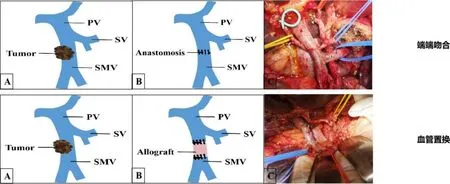
图1 不同血管重建方式模式图及术中图
1.4 诊断依据及标准 胰腺癌的诊断以肿瘤病理学结果为依据;DVT经彩色多普勒超声检查诊断,PE经CT肺动脉造影诊断。术后VTE事件定义为术前明确无VTE的患者,术后经下肢静脉超声诊断为DVT或经CTPA诊断为PE。
1.5 统计学方法 所有数据均应用SPSS 21.0软件进行统计分析,呈正态分布计量资料用均数±标准差(±s)表示,组间比较采用t检验;计数资料以例(%)表示,组间比较用χ2检验。采用多因素Logistic回归分析胰腺癌患者术后新发VTE的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者围手术期基线资料比较 VTE组年龄明显大于无VTE组,差异有统计学意义(P<0.05),两组其余因素差异无统计学意义,见表1。
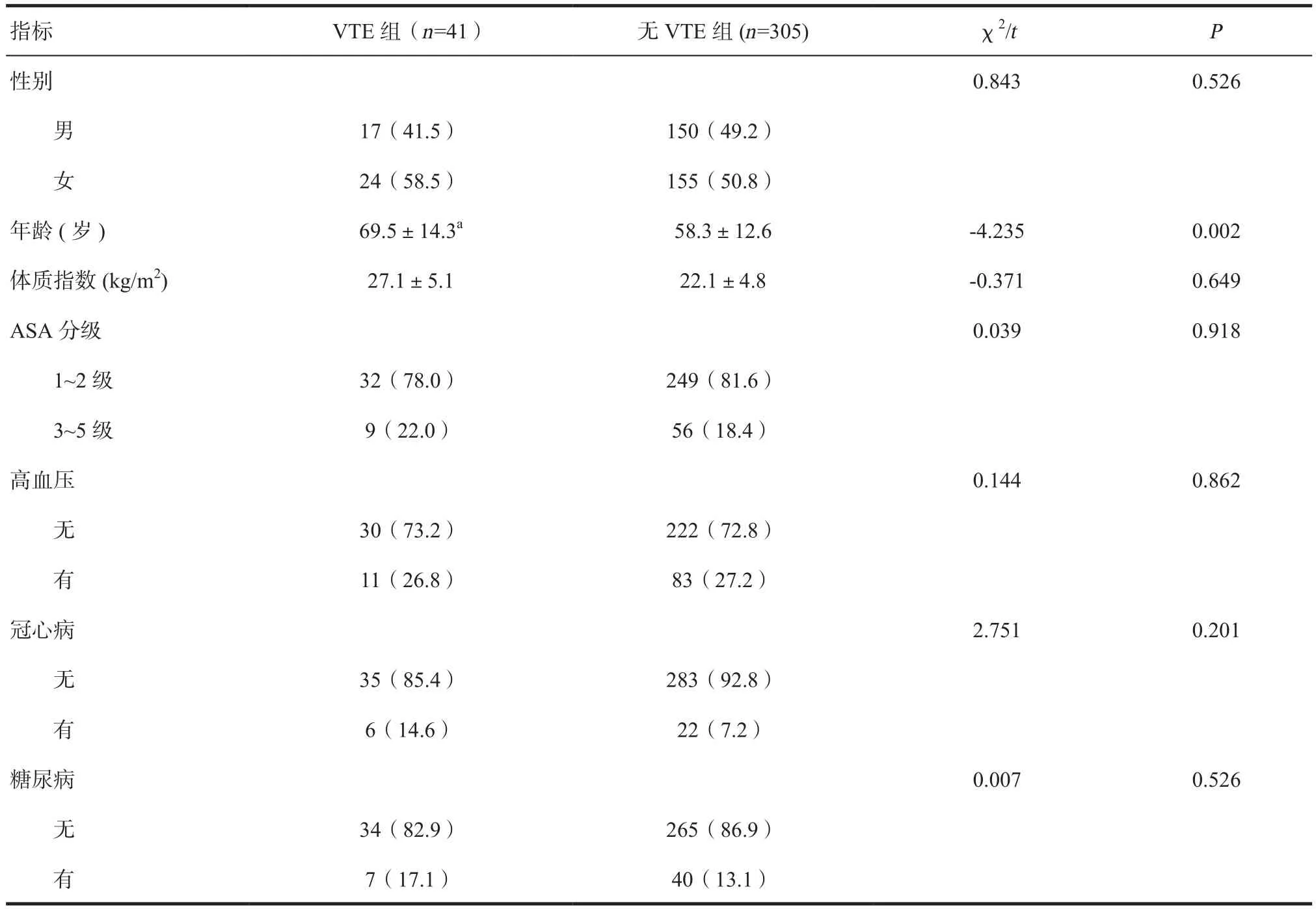
表1 两组患者围手术期基线资料比较
2.2 两组患者围手术期辅助检查资料比较 VTE组淋巴细胞计数,组织因子,术前、术后第1天、第3天D-二聚体水平与无VTE组比较差异有统计学意义(P<0.05),见表2。

表2 两组患者围手术期辅助检查资料比较
2.3 两组患者手术相关指标比较 两组患者血管重建方式的差异有统计学意义(P<0.05)。VTE组手术时长大于无VTE组,差异有统计学意义(P<0.05),两组其余指标差异无统计学意义(P>0.05),见表3。

表3 两组患者手术相关指标比较
2.4 两组患者病理相关指标比较 本组所有患者术后病理结果均为胰腺导管腺癌,其中,中、高分化217例,低分化129例,两组的分化程度差异有统计学意义(P<0.05),两组其余病理指标差异无统计学意义,见表4。
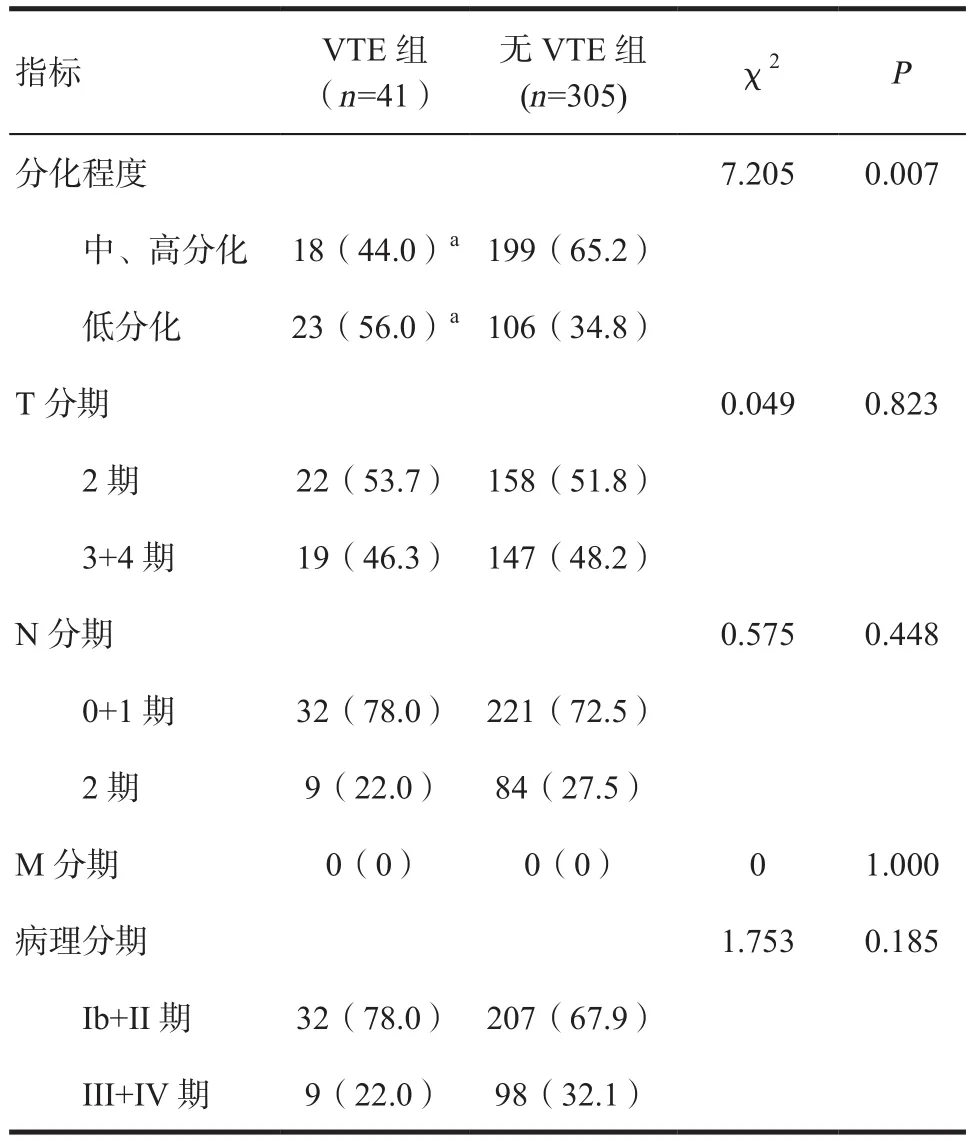
表4 两组患者病理相关指标比较
2.5 多因素Logistic回归分析 将上述单因素分析中有统计学意义的因素纳入多因素Logistic回归分析,结果显示:年龄大、淋巴细胞计数降低、组织因子升高、D-二聚体(术后第1天)升高及进行同种异体血管置换是胰腺癌术后发生VTE的独立危险因素(P<0.05),见表5。
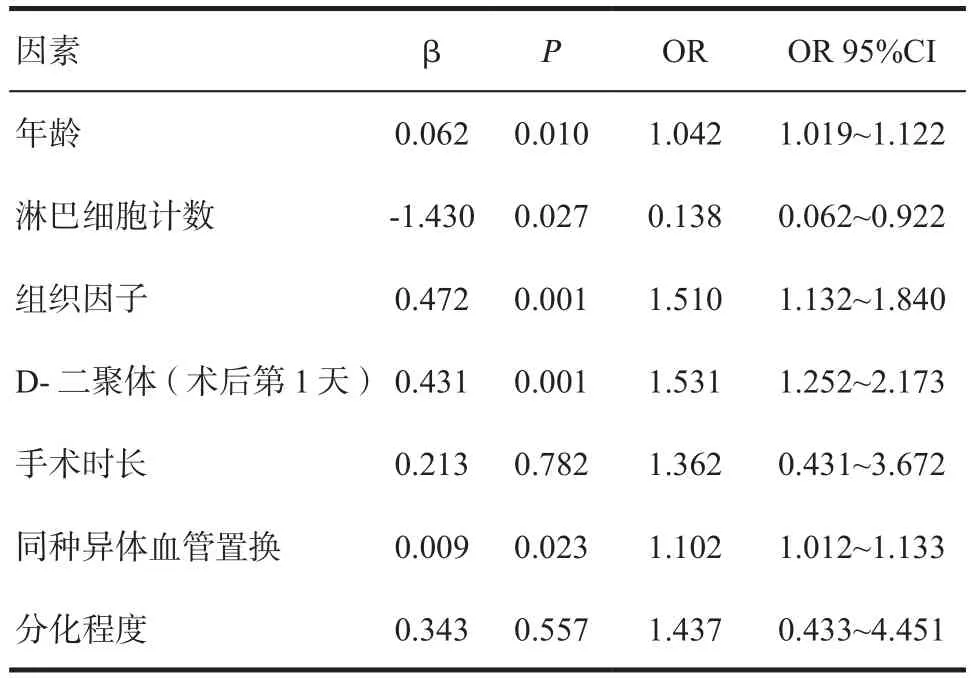
表5 胰腺癌患者术后新发VTE的Logistic回归分析
3 讨论
近期美国的一项研究中指出,20.79%的胰腺癌患者发生了VTE,从胰腺癌诊断到VTE发病的中位时间为4.49个月,随访期间发生VTE患者的总生存期(overall survival, OS)较短(9.13个月vs 14.55个月)[9]。本研究中表明,我国胰腺癌患者VTE发生率比西方国家更高,特别是对于伴随门静脉侵犯接受血管重建的患者。多项研究推荐胰腺癌术后使用低剂量普通肝素或低分子肝素(1B级证据)[10-11]。
在胰腺癌中,VTE发生率较高可能与胰腺肿瘤本身的生物学活性及促瘤机制相关,其中介导高凝状态产生的最重要的凝血因素是组织因子,是一种启动外源性凝血途径的跨膜受体。近期体内研究证据表明,血管内组织因子不仅可引发动脉血栓形成,还可引发静脉血栓形成[12],血管内皮细胞破坏导致内皮下组织因子暴露于血液。暴露的组织因子因此可以与VII因子结合来激活形成VIIa因子(FVIIa)。组织因子/FVIIa复合物将X因子转化为Xa因子(FXa),反过来激活凝血酶原形成凝血酶(IIa因子)。同时,组织因子不仅在恶性转化的胰腺外分泌细胞中表达,也在肿瘤微环境中的炎性细胞和间质细胞中表达[13-14]。FVIIa结合组织因子不仅启动凝血级联反应,而且在β1-整合素连接后激活蛋白酶激活的受体2(PAR2)信号,从而促进血管生成、肿瘤细胞增殖和迁移[15]。本研究结果提示血浆组织因子水平升高是胰腺癌患者术后新发VTE的危险因素。
肿瘤细胞诱导的血小板聚集也是胰腺癌中促血栓形成状态的关键因素。Shao等[16]研究发现,向小鼠注射高度纯化的黏蛋白导致富含血小板的微血栓快速产生,并且在黏蛋白受体、P-选择素或L-选择素缺陷的小鼠中血栓形成显著减少。本研究结果显示胰腺癌患者术后VTE组与无VTE组的血小板计数无明显差异,与文献报道不一致,可能是因为本研究入组的患者均伴有不同程度的血管侵犯,与之前研究报道的不伴有血管侵犯的可切除胰腺癌数据略有偏倚,进一步的多中心研究会逐步扩大样本量及细化入组条件,观察这一指标的变化。
由于胰腺癌在老年人群中更常见,因此年龄对VTE发生的影响也存在一定的争议。随着年龄的增长,许多合并症和VTE风险因素变得更加频繁,相关风险因素如血管壁与年龄的相关变化等也可能导致VTE风险增加。因此,年龄对VTE的发生具有重要意义,这也与本研究结果一致。D-二聚体是一种纤维蛋白降解产物,在血栓形成事件中增加,表明纤维蛋白溶解。本研究发现术后第1天的D-二聚体水平是胰腺癌患者术后新发VTE的影响因素。对患者D-二聚体水平进行密切追踪有利于临床医生更早地识别VTE高危人群。
本研究结果显示,在伴随门静脉系统侵犯的胰腺癌患者中,同种异体血管置换技术是胰腺癌患者发生VTE的影响因素。在手术过程中,肢体的血液流速缓慢,同时异体血管置换引起的免疫排斥反应以及血流动力学的改变,增加了VTE发生的几率。在术中合理地应用相关机械预防措施将有助于促进下肢血液循环,降低VTE的发生率。
炎症可影响凝血途径的各个阶段,而促炎细胞因子是炎症诱导凝血激活的主要介质。一些生物标志物,如白细胞介素6、白细胞介素8和肿瘤坏死因子-α等可能与静脉血栓形成有关[17-18]。中性粒细胞数量的增加和淋巴细胞的减少是未来心血管事件的独立危险因素[19],淋巴细胞减少是淋巴细胞在淋巴系统中边际化和重新分布的结果,往往伴随着加速的凋亡[20-21],围术期淋巴细胞计数水平的减少意味着炎症因子水平一定程度上出现了紊乱,这些生物标志物或许不仅可以解释血栓形成的发病机制,还可以作为有用的诊断标志物。然而到目前为止,人们对免疫细胞与止血和凝血过程的相互作用知之甚少。关于淋巴细胞与VTE发生的机制仍需进一步研究探索。
综上所述,胰腺癌术后VTE发生率较高,高龄、组织因子升高、D-二聚体(术后第1天)升高及进行同种异体血管置换是胰腺癌术后发生VTE的独立危险因素,而较高的淋巴细胞计数是胰腺癌术后发生VTE的保护因素。
