月桂酸钠诱导建立三种冠状动脉微循环障碍大鼠模型的比较
2022-10-20朱瑾娴范雅雯龚胜兰庄园妃刘春贵唐新征
朱瑾娴 范雅雯 龚胜兰 庄园妃 刘春贵 唐新征
广州中医药大学第六临床医学院 广州中医药大学深圳医院(福田)心血管病科,广东深圳 518034
冠状动脉微循环障碍(coronary microvascular dysfunction,CMVD)是指多种病理因素导致的血管内径小于0.5 mm 的微血管结构和/或功能异常,临床多表现为存在劳力性心绞痛症状或存在心肌缺血客观证据[1-2]。研究表明,CMVD 与未来主要不良心脏事件有关,同时也被认为是射血分数保留的心力衰竭发生的相关因素,并与死亡风险增加及心脏术后器官功能障碍相关[3-6]。
近年来,CMVD 的临床检出率逐渐升高,对于CMVD 的研究也愈渐深入。目前对于CMVD 大鼠模型的建立方法主要是开胸注射法、经颈动脉导管介入法[7-8],后者存在操作复杂且介入导管成本较高的缺点,故前者更为常见。月桂酸钠作为开胸注射法最常用的化学诱导药物,其诱导建立的大鼠CMVD 模型广泛应用于CMVD 发病机制及药物治疗的研究中,但目前对于月桂酸钠致大鼠CMVD 模型的给药剂量及给药方式尚未有定论。故本研究通过3 种不同给药方案造模的比较,优选出合理的月桂酸钠造模给药方案。
1 材料与方法
1.1 实验动物
选取SPF 级SD 雄性大鼠50 只,6~8 周龄,体重(200±20)g,购自珠海百试通动物中心,实验动物生产许可证号:SCXK(粤)2020-0051,实验动物使用许可证号:SYXK(粤)2020-0230。饲养及手术操作于深圳拓普生物科技有限公司SPF 实验动物中心进行;饲养条件:每笼2~3 只,自由饮食,通风、照明良好,室温22~24℃,相对湿度67%。实验动物使用符合3R 原则。本研究通过实验室伦理委员会审批(TOP-IACUC-2021-0104)。
1.2 药物与试剂
2%异氟烷(深圳市瑞沃德生命科技有限公司,批号:R510-22-16);月桂酸钠(美国Sigma 公司,货号:L9755);HE 染色试剂盒(武汉谷歌生物科技有限公司,批号:G1006);Heidenhain 染色液(Solarbio,批号:G4480);GENMED 石蜡切片纤维蛋白(fibrin)卡斯塔莱斯(carstairs)染色试剂盒(美国GENMED 公司,批号:GMS80128.1)。
1.3 仪器及器械
外科手术器械;小动物气体麻醉机(美国Matrx公司,7025);U-40 胰岛素注射器(上海康德莱企业发展集团股份有限公司);HS-B7126-B 型石蜡包埋机(沈阳恒松科技有限公司);ART-300 型自动脱水机(湖北安立信医疗实业有限公司);QPJ-1C 生物病理切片机(天津爱华医疗器械有限公司);BX-53F 型光学显微镜(日本Olympus 公司);vevo2100 型彩色多普勒超声仪(美国Visualsonics 公司)。
1.4 研究方法
1.4.1 模型的建立与分组 大鼠适应性饲养7 d 后,使用随机数字表法将其分为空白组、假手术组和模型组1~3,每组10 只。空白组:未行任何干预;模型组采取经心尖部注入月桂酸钠的方法建立CMVD 模型[9],根据造模方法不同分为三组,即模型组1 采用扩张肋间后挤出心脏+心尖注入月桂酸钠(1 mg/kg)1 次、模型组2 采用扩张肋间后挤出心脏+心尖注入月桂酸钠(1 mg/kg)2 次、模型组3 采用扩张肋间后挤出心脏+夹闭主动脉根部+心尖注入月桂酸钠(1 mg/kg)1 次,见图1。假手术组操作同模型组2,注入等量生理盐水。术后连续72 h 肌肉注射4 万单位青霉素预防感染。
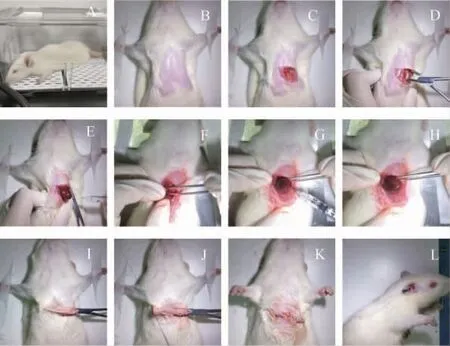
图1 大鼠CMVD 模型建立
1.4.2 超声心动图检测 术后72 h 将各组大鼠以异氟烷吸入麻醉后仰卧位固定,取胸骨短轴观切面,M 型超声模式下连续计算3 个心动周期的左室射血分数(left ventricular ejection fraction,LVEF)的平均值。
1.4.3 形态学及病理学分析 术后72 h 完成超声心动图后禁食12 h,各组大鼠生理盐水灌注后取出心脏,固定包埋,切片进行HE、Heidenhain 及Carstairs 染色观察心肌组织变化,以见到心肌缺血、微血管内血栓形成且大血管未见损伤为模型成功。
1.5 统计学方法
采用SPSS 25.0 软件进行数据分析。计量资料用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验;两组间比较采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 大鼠存活情况
空白组大鼠存活率为100%(10/10);手术大鼠死亡率为17.5%(7/40),死亡原因为器械误触破血管(1 只)、进针过深穿破心脏(1 只)、操作时间过久(4 只)、麻醉过量(1 只)。
2.2 各组大鼠LVEF 比较
假手术组与空白组LVEF 比较,差异无统计学意义(P>0.05)。与假手术组比较,模型组1~3 LVEF 均降低(P<0.05);与模型组2 比较,模型组1、3 LVEF升高(P<0.05)。见表1、图2。
表1 各组大鼠LVEF 比较(%,)
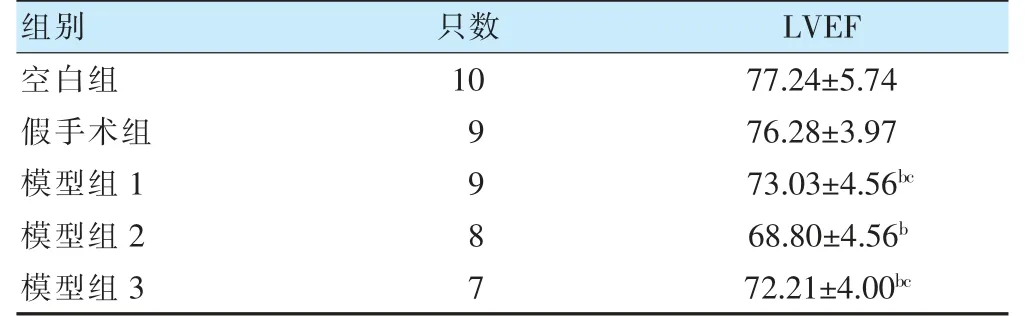
表1 各组大鼠LVEF 比较(%,)
注 与假手术组比较,bP<0.05;与模型组2 比较,cP<0.05。LVEF:左室射血分数
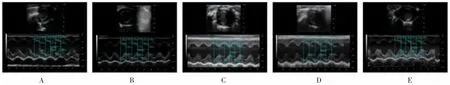
图2 各组大鼠左室射血分数
2.3 心肌组织病理形态学检测结果
2.3.1 HE 染色 空白组及假手术组大鼠心肌排列整齐,细胞核形态规则,冠状动脉微血管内未见明显血栓形成。模型组1~3 均可见不同程度冠状动脉微血管内血栓形成,周边可见不同程度的炎症细胞浸润,心肌纤维排列紊乱,组织水肿,大血管无明显血栓形成。见图3。
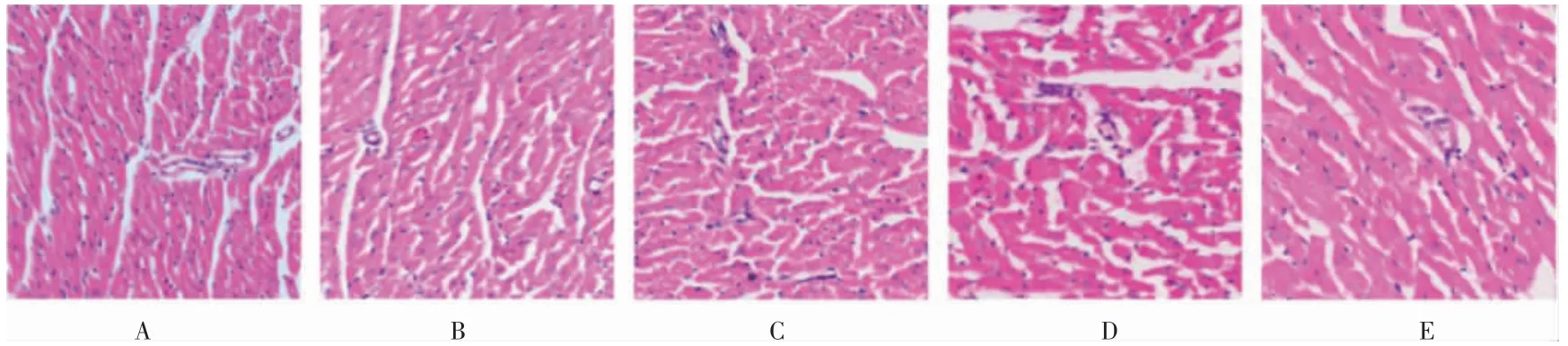
图3 各组大鼠心肌病理变化(HE 染色,400×)
2.3.2 Heidenhain 染色 空白组及假手术组心肌组织结构完整,心肌纤维组织呈红色,细胞核呈黑色;模型组1~3 均可见不同程度的点状、片状及团块状心肌纤维黑染缺血灶。见图4。
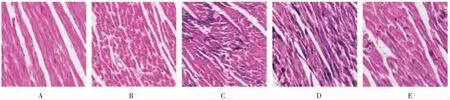
图4 各组大鼠心肌缺血情况(Heidenhain 染色,400×)
2.3.3 Carstairs 染色 空白组及假手术组大鼠微血管及心肌较大动脉血管内无明显血栓形成;模型组1~3 均可见微血管中存在血小板与纤维蛋白重叠的紫色血栓形成。见图5。
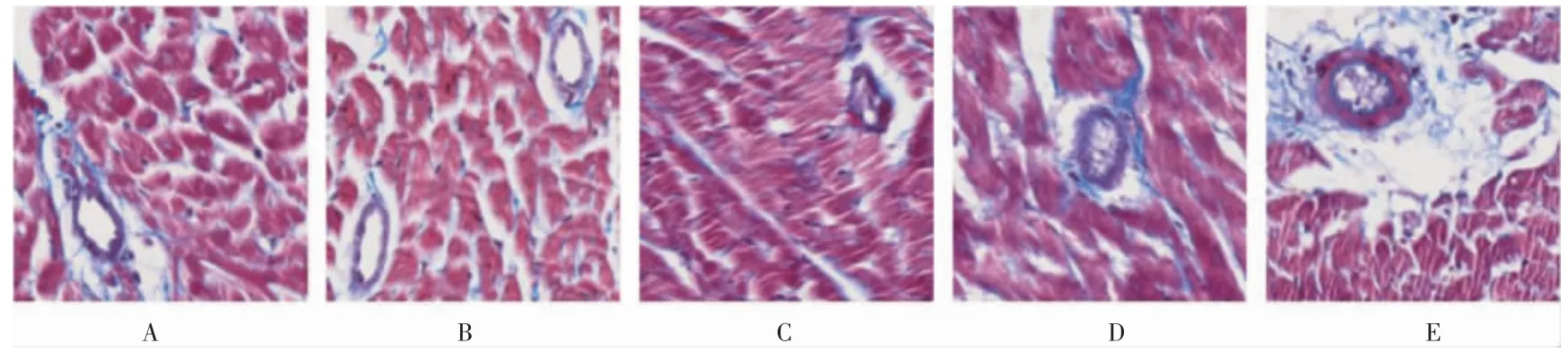
图5 各组大鼠微血管内血栓情况(Carstairs 染色,400×)
3 讨论
CMVD 存在于多种心脏或全身疾病中,如心肌病、动脉粥样硬化、自身免疫病、高血压等,是远期心血管事件的独立预测因子,因其发病机制较为复杂,目前对其研究尚不确切[10-11]。动物实验有助于理解CMVD的病理生理学机制并探索更好的治疗方法,故建立一种可靠、可复制性强且经济快速的动物模型很有必要。
现阶段CMVD 大鼠动物模型的建立方法[12-14]中导管介入法对操作者及建模工具要求较高,且导管费用昂贵,不易掌握,故开胸注射法仍是目前主流的造模方法。传统开胸注射法均采取经心尖部或主动脉根部注射,技术相对简单,但手术过程中的创伤程度大,造模流程需要约1 h,且开胸需要气管插管通气,腹腔麻醉所用水合氯醛易导致大鼠室性心律失常,戊巴比妥钠可导致大鼠呼吸抑制[15],术中及术后死亡风险较高。为提高生存率,本研究手术操作在传统方法基础上进行优化,改为采取异氟烷气体诱导麻醉。
开胸注射法通常可选择注入塑料微球、自体微血栓、月桂酸钠[16-17]。在微循环障碍的病理过程中,血管内皮细胞功能和结构的异常具有重要地位[18-19],而月桂酸钠有强烈的内皮损伤作用,可造成血管内皮脱落、穿孔,形成血栓[9]。塑料微球通过物理方式导致冠状动脉微血管栓塞,自体血栓通过模拟冠状动脉内斑块破裂导致微血栓形成,这二者虽均可诱发心肌缺血及炎症反应,但无法模拟内皮功能受损过程,故月桂酸钠造成的化学损伤更符合CMVD 的发病机制[20-21],更贴近临床。
研究证实,微血栓的形成与月桂酸钠的剂量有关[22],目前实验常用剂量为1 mg/kg 或2 mg/kg[23-25]。考虑存在药物剂量不足及未夹闭主动脉导致药物未完全进入冠状动脉致血管内皮损伤较轻的可能性,故同时设置模型组2(二次损伤)和模型组3(夹闭主动脉根部)。本研究结果显示,模型组1~3 均不会导致大血管病变,且模型组1 和模型组3 微血管堵塞程度及心功能受损程度均较模型组2 轻。此外,假手术组与空白组间心功能及心肌组织比较,差异无统计学意义(P>0.05),故挤出心脏所致损伤并不会导致心功能下降及微血栓形成。
需要注意的是,模型组2 的实验方法对于操作者有如下要求:①需提高熟练度,以便在短时间内完成操作;②术中需密切关注大鼠状况,避免大鼠因长时间通气功能障碍而死亡;③术中需根据大鼠情况及时调整麻醉药物浓度,避免大鼠因在操作途中苏醒挣扎或因心律失常、呼吸抑制而死亡;④术中心尖部注射药物要求匀速、轻柔及缓慢,避免药物作用时间过短,同时严格控制穿刺力度及深度。
本研究中3 种造模方法平均需要约10 min,较常规方法快捷,且均可成功导致微循环障碍,其中模型组2 微血管损伤及心功能受损最明显,且造模时间短,死亡率低,成模稳定,与常规方法结果基本一致,是较优的一种造模方案,可广泛应用于CMVD 方面的研究,极大地提高实验进程。研究者可根据所需微循环功能障碍的严重程度酌情调整给药量。
本研究不足之处在于样本量偏小,仅探索了加倍剂量的造模方案,且未尝试更高浓度月桂酸钠配比对微血管及冠状动脉的损伤程度,因而未明确当剂量增加至何种水平时会导致大鼠的死亡率升高或损伤到大血管,后续实验可在此基础上进一步探索。另外,月桂酸钠可能会导致全身微循环障碍,本研究未进行相关评估,后续实验中应注意观察。
