黄芩苷对多重耐药铜绿假单胞菌慢性肺部感染大鼠的影响
2022-10-20李磊王静崔兰凤吕思缘郭雨菲秦欣欣王成祥
李磊 王静 崔兰凤 吕思缘 郭雨菲 秦欣欣 王成祥
1.北京中医药大学第三附属医院呼吸科,北京 100029;2.北京中医药大学教务处,北京 100029;3.清华大学附属北京清华长庚医院中医科,北京 102218
近年来,铜绿假单胞菌(Pseudomonas aeruginosa,PA)的多重耐药性显著增加使得抗生素选择受限,导致多重耐药PA(multidrug resistantPseudomonas aeruginosa,MDRPA)慢性肺部感染患者死亡率升高[1-2]。而PA 可过度激活Toll 样受体4(Toll-like receptor 4,TLR4)/核因子κB(nuclear factor-κB,NF-κB)通路,导致促炎性细胞因子与抗炎细胞因子失衡,激发炎症“瀑布样效应”,导致肺组织损伤[3],这也是导致慢性肺部感染患者死亡率高的重要病理机制。黄芩苷是从黄芩中分离出来的黄芩主要活性成分,被应用于多种炎症疾病的治疗[4-5]。基于此,本研究探讨黄芩苷对MDRPA慢性肺部感染大鼠的影响。
1 材料与方法
1.1 实验用菌
实验菌株由北京中医药大学东直门医院检验科微生物室提供,菌株编号1607106。
1.2 实验动物
选取SPF 级SD 大鼠32 只,雄性,6~8 周龄,体重180~220 g,实验动物由北京维通利华实验动物技术有限公司提供,实验动物质量合格证号:1100112011099 12348;实验动物生产许可证号:SCXK(京)2016-0006,动物实验在中国中医科学院中药研究所生物安全实验室进行,经过实验动物伦理委员会审批(2020D30)。
1.3 实验药物
黄芩苷(批号110715-200514)购自中国食品药品监督管理局,纯度≥98%;哌拉西林他唑巴坦钠(Wyeth Lederle S.R.L,批号:AKGD/11)由北京中医药大学东直门医院药剂科提供。
1.4 主要试剂与仪器
大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(enzyme-linked immunoadsordent assay,ELISA)试剂盒(厦门仑昌硕生物科技有限公司,货号:31063)、大鼠白细胞介素-10(interleukin-10,IL-10)ELISA 试剂盒(厦门仑昌硕生物科技有限公司,货号:30194)、TLR4 抗体(Proteintech,货号:19811-1-AP)、NF-κB(p65 亚基)(NF-κB p65 subanit,NF-κB p65)抗体(Proteintech,货号:66535-1-Ig)。全自动多功能酶标仪(Multiskan MK3,Thermo)、电泳仪(JY300C,北京君意东方电泳设备有限公司)、实时定量聚合酶链式反应仪(polymerase chain reaction,PCR)(CFX-96,Bio-RAD 公司)。
1.5 实验方法
1.5.1 动物分组 将大鼠按照随机数字表法分为空白组、模型组、西药组和黄芩苷组,每组8 只。
1.5.2 模型建立 将MDRPA 菌液浓度设为1.5×108CFU/ml;采用1 ml 胰岛素注射器滴入法制备MDRPA藻酸盐包被体。使用1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,采用经口气管插管法将MDRPA藻酸盐包被体混悬液(0.1 ml/200 g)快速注入大鼠气管中。造模成功标准:大鼠肺组织匀浆培养出PA;感染慢性期可见肺组织实变、纤维增生、淋巴细胞浸润[6]。
1.5.3 干预措施 按直接折算法计算大鼠与人的临床等效剂量[7]。黄芩苷组给予0.8 g/(kg·d)黄芩苷灌胃(该浓度经预实验确定);西药组给予0.8 g/(kg·d)哌拉西林他唑巴坦钠肌肉注射;空白组、模型组均给予与黄芩苷组等量的生理盐水灌胃。四组均连续给药14 d。
1.5.4 取材 给药结束后,麻醉大鼠,腹主动脉取血,离心(3500 r/min,10 min,离心半径10 cm),取血清,-80℃冻存备用。取右肺组织于-80℃冻存,左肺组织置于4%的多聚甲醛中固定。
1.5.5 苏木精-伊红染色 将肺组织依次进行脱水,透明,浸蜡,包埋,切片,染色。
1.5.6 ELISA 检测四组血清细胞因子TNF-α、IL-10每组随机取5 只大鼠的血清样本进行TNF-α、IL-10检测,具体实验操作步骤按照ELISA 试剂盒说明书进行。
1.5.7 qPCR 检测四组肺组织TLR4、NF-κB p65 mRNA表达 每组随机取3 只大鼠的肺组织,使用TRIzol 法提取肺组织总RNA;按照逆转录试剂盒说明书进行逆转录;进行RT-PCR 反应,应用BIO-RAD CFX96 荧光定量PCR 仪记录数据,反应体系:PCR 上游引物2.0 μl、PCR 下游引物2.0 μl、cDNA2.0 μl、50×Rox参比染料0.4 μl、ddH2O 3.6 μl。反应条件:95℃预变性10 min,95℃变性10 s,59℃退火/延伸60 s,共45个循环。以GAPDH 为内参,采用2-ΔΔCt法进行数据的相对定量分析。引物序列见表1。

表1 引物序列
1.6 统计学方法
采用SPSS 22.0 对所得数据进行统计学分析。计量资料采用均数±标准差()表示,比较采用t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 四组肺组织病理
空白组肺组织形态结构正常。模型组可见大量炎症细胞浸润,肺泡壁显著增厚。黄芩苷组浸润的炎症细胞较少,肺泡壁较薄。见图1。
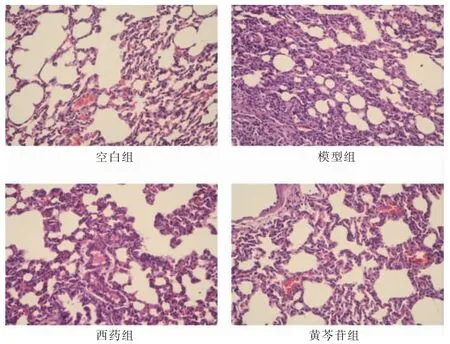
图1 四组肺组织病理(苏木精-伊红染色,200×)
2.2 四组血清TNF-α 和IL-10 比较
模型组血清TNF-α 高于空白组,IL-10 低于空白组,差异有统计学意义(P<0.05)。黄芩苷组血清TNF-α 低于模型组,IL-10 高于模型组,差异有统计学意义(P<0.05)。见表2。
表2 四组血清TNF-α 和IL-10 比较(pg/ml,)
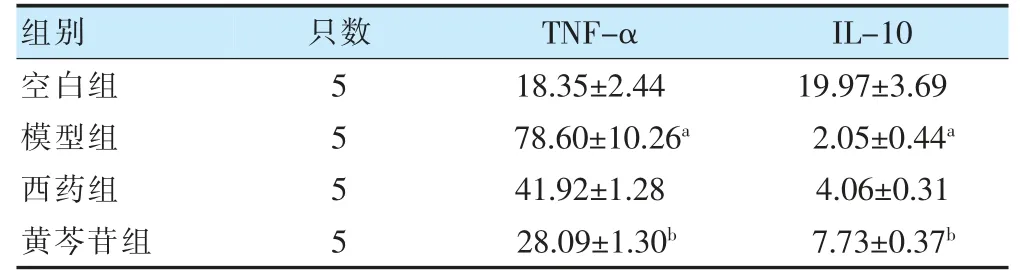
表2 四组血清TNF-α 和IL-10 比较(pg/ml,)
注 与空白组比较,aP<0.05;与模型组比较,bP<0.05。TNF-α:肿瘤坏死因子-α;IL-10:白细胞介素-10
2.3 四组肺组织TLR4、NF-κB p65 mRNA 水平比较
模型组TLR4、NF-κB p65 mRNA 水平高于空白组,差异有统计学意义(P<0.05)。黄芩苷组TLR4、NF-κB p65 mRNA 水平均低于模型组,差异有统计学意义(P<0.05)。见表3。
表3 四组肺组织TLR4、NF-κB p65 mRNA 水平比较()
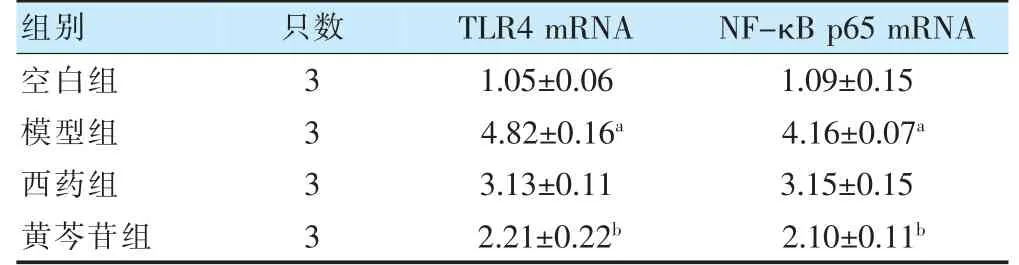
表3 四组肺组织TLR4、NF-κB p65 mRNA 水平比较()
注 与空白组比较,aP<0.05;与模型组比较,bP<0.05。TLR4:Toll 样受体4;NF-κB p65:核因子κB(p65 亚基)
3 讨论
在囊性纤维化、慢性阻塞性肺疾病等患者中,PA可引起慢性肺部感染[8-11]。TLR4 是一类在固有免疫中起关键作用的膜结合模式识别受体[12-14]。PA 的内毒素脂多糖被TLR4 识别并结合后,使磷酸化核因子抑制因子与NF-κB 分离,NF-κB p65 进入细胞核与DNA结合从而使促炎性细胞因子大量表达,激发炎症“瀑布样效应”,导致组织损伤[15-16]。TNF-α 是促炎性细胞因子,促进NF-κB 的活化,并诱导其他促炎性细胞因子释放[17]。IL-10 是抗炎细胞因子,具有抗炎作用[18-19]。近年来研究证实,抑制TLR4/NF-κB 通路能够减轻肺组织损伤[20-21]。
中药具有直接抑菌杀菌及调节机体平衡等作用[22-23]。有研究显示,中药对革兰氏阴性菌的直接抑菌、杀菌作用较弱[24-25]。本研究显示,黄芩苷可以减轻MDRPA慢性肺部感染大鼠肺组织炎性损伤,其抗炎机制可能与抑制TLR4/NF-κB 通路相关,值的临床进一步深入探索。
