纳米银在池塘微宇宙模型中的动态分布研究
2022-10-19张泽玉张丽罗人杰孙迎松周高翔丁路明姜瑞雪刘仲秋
张泽玉,张丽,罗人杰,孙迎松,周高翔,丁路明,姜瑞雪**,刘仲秋**
纳米银在池塘微宇宙模型中的动态分布研究
张泽玉1,张丽2*,罗人杰3,孙迎松1,周高翔3,丁路明3,姜瑞雪3**,刘仲秋3**
1. 山东省调水工程运行维护中心, 山东 济南 250100 2. 泰山职业技术学院 建筑工程系, 山东 泰安 271000 3. 山东农业大学 水利土木工程学院, 山东 泰安 271018
纳米银(Ag-NPs)因其优越的理化性能而被广泛应用,但其不同方式排入水环境后的动态分布研究尚不多见。本研究构建了含有底泥、水体、黑藻、螺类和鱼类等元素的池塘微宇宙模型水生态系统,通过对比单次投加0.1、0.3和0.5 mg/L Ag-NPs和模拟废水连续排放的分次投加0.1 mg/L Ag-NPs模式,探究Ag-NPs在池塘微宇宙模型中的动态分布。研究结果表明,上覆水中Ag-NPs的浓度随投加方式不同而不同,但均可在投加10 d后趋于稳定并在第40 d时基本相同。两种投加模式中,水生生物因其生活习性的不同对Ag-NPs的富集量也不同,均是螺类>鱼类>黑藻。除微宇宙四壁等其他去处外,上层底泥是微宇宙中Ag-NPs主要汇集地,单次投加时对Ag-NPs的富集占比分别为45.34%、57.16%、25.53%,分次投加至0.3和0.5 mg/L时对Ag-NPs的富集占比分别为29.74%和25.84%。
纳米银; 微宇宙模型; 动态分布
纳米银(Ag-NPs)材料具有导电率高、抗菌性强、化学性质稳定等小尺寸效应特点[1],被应用到健康传感器及广谱抗菌剂等众多领域[2,3],但其过度使用和排放会对水环境安全构成一定威胁[4,5],成为国内外研究热点。多项研究表明Ag-NPs对单细胞和多细胞等多种生物有机体具有急性毒性或亚致死效应[6-9],但多数开展的仅是实验室小尺度研究,针对Ag-NPs在生态系统中的迁移、转化、动态分布及生态风险的研究还远远滞后于Ag-NPs的应用。
本研究拟构建含有底泥、水体、黑藻、螺类和鱼类等元素的池塘微宇宙模型水生态系统,通过对比单次投加0.1、0.3和0.5 mg/L Ag-NPs和模拟废水连续排放的分次投加0.1 mg/L Ag-NPs至0.3和0.5 mg/L Ag-NPs模式,探究Ag-NPs在池塘微宇宙模型中的动态分布,旨在较真实的模拟自然水生态环境,为后续开展Ag-NPs的环境生态效应提供重要科学依据。
1 材料与方法
1.1 微宇宙模型构建
微宇宙实验水族箱尺寸为72 cm×53 cm×42 cm,由日光灯提供光照,内设循环泵充氧和添加扰动,如图1所示。每组加入水样70 L(河水20 L及暴晒后的自来水50 L),厚约10 cm的塘泥,黑藻10支,螺类20个,驯养过的鱼苗15条。塘泥、黑藻均取自山东省泰安市泰山区奈河上游段(东经117.12°,北纬36.20°)。

图 1 微宇宙模型
1.2 纳米银投加方式
单次投加模式是将浓度梯度为0.1、0.3和0.5 mg/L的Ag-NPs一次性分别投加到池塘微宇宙中(共分一、二、三组)。分次投加模式即在第1 d将0.1 mg/L的Ag-NPs投加到第一组池塘微宇宙中(与单次投加0.1 mg/L Ag-NPs相同),在第1 d、7 d和13 d每次将0.1 mg/L的Ag-NPs投加到第四组池塘微宇宙中,在第1 d、7 d、13 d、19 d和25 d每次将0.1 mg/L的Ag-NPs投加到第五组池塘微宇宙中。
1.3 样品收集及处理
本研究共持续40 d,实验过程中每隔3 d取1次水样,检测水中Ag-NPs浓度。黑藻在取样后用超纯水清洗3~5遍后放入烘箱烘干备用,鱼类和螺类取样后用超纯水清洗3~5遍后放入冷冻干燥机干燥备用,利用有机玻璃管取上、下层底泥各直径约3 cm的底泥柱,其中以底泥上表面为基准,1~5 cm为上层底泥,6~10 cm为下层底泥,并将样品放入冷冻干燥机干燥备用。
1.4 检测指标及方法
检测指标包括水体中、底泥及生物体内的Ag-NPs浓度等。样品经消解后利用原子吸收分光光度计TAS-990测量银含量。
2 结果与讨论
2.1 Ag-NPs在微宇宙模型上覆水中的变化趋势
将浓度为0.1、0.3和0.5 mg/L的纳米银(Ag-NPs)分别单次投加入微宇宙模型后,上覆水中Ag-NPs浓度变化如图2所示。由图2可知,1 d时,水中Ag-NPs浓度分别为1.26、7.21和8.60 μg/L,占投加总量的1.26%、2.40%和1.72%,这主要是因为Ag-NPs在投加后会迅速发生团聚现象,多数沉降到底泥、附着在微宇宙的动植物表面及内壁等。在第1 d~4 d,Ag-NPs的沉降速度分别为0.35、1.87和2.28 μg/L·d,表明Ag-NPs投加浓度越大,团聚沉降速度越大。至第10 d时,水中Ag-NPs浓度分别为0.08、0.21和0.08 μg/L,整体趋于稳定。
高素娟等[10]研究了Ag-NPs在上覆水中的沉降、在沉积物中的迁移和形态分布、以及扰动释放过程,结果表明Ag-NPs进入水体后120 h内大部分沉入沉积物中,60 d后主要分布在表层沉积物中,与本研究结论一致。Furtado LM等[11]、Bradford A等[12]和Echavarri-Bravo V等[13]等分别针对北寒带湖泊、河口微宇宙和自然河口生态系统中Ag-NPs在水体中的变化趋势研究,得出了类似结论。
分次投加后微宇宙模型上覆水中Ag-NPs浓度变化如图3所示。由图3可知,第1 d时,上覆水中Ag-NPs浓度分别为1.26、1.45和1.68 μg/L,至第4 d时,Ag-NPs浓度分别下降到0.21、0.38和0.25 μg/L。在第7 d、13 d、19 d和25 d观察发现,每次投加0.1 mg/L Ag-NPs后水体中Ag-NPs的浓度均呈上升趋势,但会迅速回落到低浓度的状态,且后一次的Ag-NPs的浓度略高于上一次,这主要可能与Ag-NPs在水中会有Ag+析出有关。
总体来看,上覆水中Ag-NPs的浓度变化随投加方式不同而不同,但均可在投加10 d后趋于稳定状态并在第40 d时基本相同。

图 2 单次投加后微宇宙模型上覆水中Ag-NPs变化趋势

图 3 分次投加后微宇宙模型上覆水中Ag-NPs变化趋势
2.2 Ag-NPs在螺类、黑藻、鱼类等生物体内的动态分布
单位质量螺类、黑藻、鱼类对Ag-NPs单次投加40 d时的富集量如图4所示。由图4可知,Ag-NPs投加量为0.1、0.3和0.5 mg/L时,螺体内Ag-NPs约是鱼类的1.27、1.57、1.22倍,是水生植物黑藻的2.53、2.99、2.35倍。单位质量螺类、黑藻、鱼类对Ag-NPs分次投加40 d时的富集量如图5所示。由图5可知,分次投加至总量为0.1、0.3和0.5 mg/L时,螺体内Ag-NPs约是鱼类的1.27、2.16、2.12倍,是黑藻的2.53、3.65、3.14倍。两种投加模式下,Ag-NPs在水生动物体内的富集均明显高于其在水生植物体内的富集,螺体内Ag-NPs的富集量明显高于鱼类,总体对Ag-NPs的富集量均呈现螺类>鱼类>黑藻的规律,且Ag-NPs在生物体中的富集与投加量基本呈正相关,这主要因为水生生物生活习性的不同从而表现出不同的富集量。
不同投加模式下,Ag-NPs在生物体内的富集量对比表明,分次投加组均低于单次投加组,其原因可能是与有效累积暴露时间差异有关。两种投加模式下,对Ag-NPs富集量差异最小的是田螺,最大的是鱼类。Asharani PV等[14]研究了Ag-NPs对鱼类的影响,结果表明肝脏是Ag-NPs的主要富集器官,其次是鱼鳃组织。David D等[15]研究发现,Ag-NPs可能在藻细胞表面吸附并聚集,导致藻类细胞膜或骨架结构的破坏以及细胞器功能的损伤,进而抑制藻细胞的物质代谢和光合作用。

图 4 单次投加后微宇宙模型生物体内Ag-NPs变化趋势

图 5 分次投加后微宇宙模型生物体内Ag-NPs变化趋势
2.3 Ag-NPs在底泥中的动态分布
Ag-NPs在底泥中的动态分布如图6所示。当Ag-NPs单次投加量为0.1、0.3和0.5 mg/L和分次投加至0.3和0.5 mg/L时,上层底泥(1~5 cm)对Ag-NPs的富集分别占总投加量的45.34%、57.16%、25.53%和29.74%、25.84%,下层底泥(6~10 cm)对Ag-NPs的富集分别占总投加量的4.40%、3.60%、3.47%和1.46%、2.20%。研究表明,上层底泥Ag-NPs分别占底泥总富集量的90.30%、93.70%、86.40%和95.10%、91.50%。两种投加模式下上层底泥均是Ag-NPs主要汇集地,这除了与Ag-NPs自身特性快速凝聚并沉积外,还与微宇宙模型中田螺活动强度低、活动范围小,底泥因黑藻扎根而不易被扰动有关。

图 6 Ag-NPs在微宇宙模型底泥中的动态分布
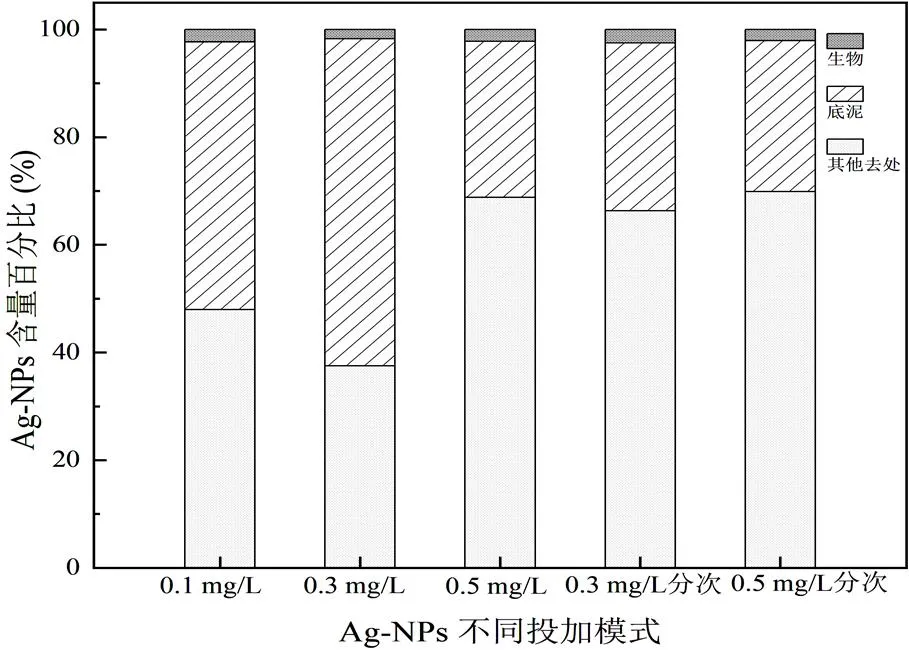
图 7 Ag-NPs在微宇宙模型中的总体分布
2.4 Ag-NPs在微宇宙模型中的平衡性分析
Ag-NPs在微宇宙模型中的去处主要有微宇宙四壁、底泥、动植物表面吸附及体内富集等,如图7所示。当Ag-NPs单次投加量为0.1、0.3、0.5 mg/L和分次投加至0.3和0.5 mg/L时,生物体内Ag-NPs的富集占比分别为2.3%、1.7%、2.2%和2.5%、2.1%;底泥对Ag-NPs的富集占比分别为49.74%、60.76%、29.00%和31.20%、28.04%。除底泥、动植物表面及体内以外的Ag-NPs富集统称为其他去处,该部分占比主要通过计算得出。其他去处Ag-NPs占比分别为47.96%、37.53%、68.80%和66.31%、69.87%,其他去处主要有Ag-NPs不均匀沉降造成微宇宙四壁粘连、间隔取样时水体、生物体或底泥带出等。Kaegi R等[16]研究发现大部分的Ag-NPs会被污泥吸附,只有约2.5%~5% Ag-NPs在水中检出,与本研究结论一致。
3 结论
本研究构建了含有水体、底泥、黑藻、螺类和鱼类等的池塘微宇宙模型水生态系统,通过单次投加和分次投加的方式模拟含Ag-NPs废水的不同排放工况,探究Ag-NPs在近自然复杂环境下的动态分布。主要结论如下:
(1)上覆水中Ag-NPs的浓度随投加方式不同而不同,但均可在投加10 d后趋于稳定并在第40 d时基本相同,占投加总量比例不到0.1%。分次投加时,后一次的Ag-NPs的浓度略高于上一次,可能与Ag-NPs在水中会有Ag+析出有关;
(2)水生生物因其生活习性的不同对Ag-NPs的富集量也不同,两种投加模式均是螺类>鱼类>黑藻。单次投加模式下,螺体内Ag-NPs约是鱼类的1.27、1.57、1.22倍,是水生植物黑藻的2.53、2.99、2.35倍;分次投加至总量为0.3和0.5 mg/L时,螺体内Ag-NPs约是鱼类的2.16和2.12倍,是黑藻的3.65和3.14倍;
(3)Ag-NPs的凝聚沉降特性决定了底泥(尤其是上层底泥)是微宇宙模型中其主要汇集地。单次投加时,上层底泥对Ag-NPs的富集占投加总量比例分别为45.34%、57.16%、25.53%;分次投加至0.3和0.5 mg/L时,上层底泥对Ag-NPs的富集占比分别为29.74%和25.84%。
[1] Xu LM, Zhao ZL, Yan Z,. Defense pathways ofunder silver nanoparticle stress: extracellular biosorption, internalization and antioxidant gene [J]. Chemosphere, 2022,291:132764
[2] Sharma VK, Siskova KM, Zboril R,. Organic-coated silver nanoparticles in biological and environmental conditions: Fate, stability and toxicity [J]. Advances in Colloid and Interface Science, 2014, 204:15-34
[3] Zhang CQ, Hu ZQ, Deng BL. Silver nanoparticles in aquatic environments: Physiochemical behavior and antimicrobial mechanisms [J]. Water Research, 2016,88:403-427
[4] Hao ZN, Li FS, Liu R,. Reduction of ionic silver by sulfur dioxide as a source of silver nanoparticles in the environment [J]. Environmental Science & Technology, 2021,55(8):5569-5578
[5] Sharma VK, Filip J, Zboril R,. Natural inorganic nanoparticles-formation, fate, and toxicity in the environment [J]. Chemical Society Reviews, 2015,44(23):8410-8423
[6] 陈姝颖,李海毅,李昭阳.纳米银对水体中硝化细菌活性的影响[J].东北师大学报(自然科学版),2018,50(2):151-155
[7] 蒲高忠,王柯懿,陈霞霞,等.水环境中人工合成纳米银颗粒的来源、转化和生态毒性研究进展[J].广西科学,2021,28(4):363-372
[8] 于朋飞,刘晖,牟之健,等.纳米银和银离子对2种微藻的急性毒性效应[J].生态毒理学报,2017,12(6):188-198
[9] Lee KJ, Browning LB, Nallathamby P,. Silver nanoparticles induce developmental stage-specific embryonic phenotypes in Zebrafish [J]., 2013,5(23):11625-11636
[10] 高素娟,方涛,王广召,等.纳米银在水-沉积物中的迁移机制研究[J].水生生物学报,2015,39(2):375-381
[11] Furtado LM, Norman BC, Xenopoulos MA,. Environmental fate of silver nanoparticles in boreal lake ecosystems [J]. Environmental Science & Technology, 2015,49(14):8441-8450
[12] Bradford A, Handy RD, Readman JW,. Impact of silver nanoparticle contamination on the genetic diversity of natural bacterial assemblages in estuarine sediments [J]. Environmental Science & Technology, 2009,43:4530-4536
[13] Echavarri-Bravo V, Paterson L, Aspray TJ,. Shifts in the metabolic function of a benthic estuarine microbial community following a single pulse exposure to silver nanoparticles [J]. Environmental Pollution, 2015,201:91-99
[14] Asharani PV, Lian WY, Gong Z,. Toxicity of silver nanoparticles in zebrafish models [J]. Nanotechnology, 2008,19(25):711-717
[15] David D, Abdallah O. Silver nanoparticles toxicity effect on photosystem II photochemistry of the green alga treated in light and dark conditions [J]. Toxicological & Environmental Chemistry, 2012,94(8):1536-1546
[16] Kaegi R, Voegelin A, Sinnet B,. Behavior of metallic silver nanoparticles in a pilot wastewater treatment plant [J]. Environmental Science & Technology, 2011,45(9):3902-3908
Study on the Dynamic Distribution of Silver Nanoparticles in a Pond Microcosmic Model
ZHANG Ze-yu1, ZHANG Li2*, LUO Ren-jie3, SUN Ying-song1, ZHOU Gao-xiang3, DING Lu-ming3, JIANG Rui-xue3**, LIU Zhong-qiu3**
1.250100,2.271000,3.271018,
Silver nanoparticles (Ag-NPs) have been widely used due to their excellent physical and chemical properties. However, the dynamic distribution of Ag-NPs in water environment after use and discharge is rarely studied. In this study, a pond microcosmic model aquatic ecosystem has been constructed, which contained sediment, water, black algae, snails and fish. The dynamic distribution of Ag-NPs in the pond microcosmic model was investigated by comparing the single addition of 0.1, 0.3 and 0.5 mg/L Ag-NPs with the separate addition of 0.1 mg/L Ag-NPs. The results showed that Ag-NPs concentrations in upper water were different with different adding methods, but tended to be stable after 10 days and basically the same on the 40th day. The enrichment of Ag-NPs by aquatic organisms in the two modes was different due to their different living habits, which was snails> fish> black algae. In addition to the walls of the microcosmic model, the sediment surface is the main accumulation site of Ag-NPs. The Ag-NPs enrichment ratios are 45.34%, 57.16% and 25.53% for a single addition, and 29.74% and 25.84% for a separate addition when the total amount was 0.3 and 0.5 mg/L, respectively.
Silver nanoparticle; microcosmic model; dynamic distribution
P342+.4
A
1000-2324(2022)04-0624-05
10.3969/j.issn.1000-2324.2022.04.019
2021-11-24
2022-01-07
国家自然科学基金项目(41771502)
张泽玉(1980-),女,硕士研究生,高级工程师,主要研究方向为调水工程规划建设、管理及运行. E-mail:jinyuwz@163.com
张丽(1980-),女,硕士,副教授,研究方向为水处理理论与技术. E-mail:50723491@qq.com
Author for correspondence. E-mail:34491783@qq.com; zqliu08@sdau.edu.cn
