钻喙兰快速繁殖技术体系优化
2022-10-19郑秋桦郑翼泽刘博婷刘羽佳曾松荣黎栋然李德有吴京圩
郑秋桦,郑翼泽,刘博婷,刘羽佳,曾松荣,黎栋然,李德有,吴京圩
钻喙兰快速繁殖技术体系优化
郑秋桦1,郑翼泽2,刘博婷1,刘羽佳1,曾松荣1,黎栋然1,李德有1,吴京圩2
1. 韶关学院英东生物与农业学院, 广东 韶关 512005 2. 韶关市绿沃农业科技有限公司, 广东 韶关 512005
本文通过钻喙兰((L.) Bl.)的快速繁殖技术体系优化,以期提高钻喙兰的繁殖效率。分别考察初代培养、继代培养和生根培养中培养基和植物生长调节剂的浓度和配比对培养效果的影响,考察移栽炼苗遮光率对组培苗成活率的影响。结果表明:适宜钻喙兰种子外植体组培快繁体系为初代培养采用1/2MS培养基中添加6-苄氨基嘌呤(0.9 mg·L-1)和萘乙酸(0.1 mg·L-1)获得愈伤组织的诱导率较高,可达96.8%;继代培养采用1/2MS继代培养基并添加6-苄氨基嘌呤(2.5 mg·L-1)和萘乙酸(1.4 mg·L-1)诱导率较高,可达96.4%;生根培养采用1/2MS培养基并添加萘乙酸(1.6 mg·L-1)钻喙兰生根率较高,可达95.1%;移栽练苗采用50%遮光率组培苗成活率最高,可达97.4%。通过钻喙兰的组培快繁技术体系的优化,可为钻喙兰的栽培生产提供可借鉴的参考。
钻喙兰; 组培培养; 技术优化
附生兰钻喙兰((L.) Bl.)为兰科钻喙兰属的多年生草本植物,其株型紧凑,花繁色艳,花序悬垂,芳香怡人,花朵较小(直径约为2 cm),唇尖不裂且向上翘起,颇具观赏价值。钻喙兰花期在5~6月,花序纤长,花瓣和花萼片纸质,多白色,常具不规则排列的紫红色斑点,唇瓣肉质(多呈紫红色),距白色,两侧压扁,底端钝圆[1-3]。在没有人工控制的自然条件下,钻喙兰的种子不容易萌发,故而常用的繁殖方法是通过分株进行繁殖,但常规方法效率较低,成为限制钻喙兰规模化生产的瓶颈,故而通过繁殖系数较高,繁殖速度较快的组培快繁技术来获得较高的繁殖效率,是解决海南钻喙兰栽培生产中种苗繁育效率问题的有效举措[4-6]。
植物组织培养技术广泛应用于植物的脱毒和快繁方面,对植物种质资源保护和转基因育种也有重要作用[7-10]。但植物的组织培养快速繁殖技术常因植物品种的不同和外植体部位的不同而差异较大。前人对蝴蝶兰组织培养技术的研究结果表明,外植体诱导类原球茎可以采用种子(或胚),营养体包括叶片、茎尖和根尖,以及花梗腋芽、花葶节间、花梗节等,进而再增殖培养和生根培养产生分生苗,最终移栽成活实现快速繁殖[11,12]。前人采用文心兰的花梗腋芽为外植体进行组培的实验结果指明,以幼茎花梗腋芽为外植体能够直接诱导产生丛生芽[13]。在兰花的组织培养过程中,经常采用的培养基中包含无机盐类、植物生长调节剂等营养组分,以促进愈伤组织的诱导和胚状体的分化。其中植物生长调节剂的种类和用量,以及不同植物生长调节剂的配比组合常常对外植体的诱导和分化效果以及原球茎和胚状体的形成影响较大。有研究者指出,NAA和BA组合对多数兰科植物的组培快繁诱导效果较好[14]。
本研究采用钻喙兰未成熟的种子为外植体,通过优化钻喙兰的组培快繁技术体系,明确适宜的培养基和植物生长调节剂浓度和配比,提高诱导率和增殖率,以期为钻喙兰的工厂化育苗和规模化栽培生产,提供必要的技术支持。
1 材料与方法
1.1 试验材料
以钻喙兰授粉后95 d的未成熟种子为材料,试验采用的基础培养基为MS和VW培养基,1/2MS培养基为MS培养基中大量营养元素成分含量减半的培养基。试验采用的植物生长调节剂(NAA和6-BA)均为北京康倍斯科技有限公司生产分装生产。
1.2 试验方法
1.2.1 初代培养将清水冲洗后的钻喙兰种子,用75.0%乙醇表面消毒3~5次,待乙醇挥发后剖开蒴果取出种子作为外植体进行初代培养。取200粒种子接种在诱导培养基上,在室温(25 ℃)下,每天12 h光照(光照强度为1000~1500 lx)+12 h黑暗条件下培养60 d。采用L9(33)正交试验设计方法,探究不同培养基(MS培养基,1/2MS培养和VW培养基),0.1,0.5,0.9 mg·L-16-BA以及0,0.10,0.20 mg·L-1NAA的不同组合,对钻喙兰种子外植体分化出愈伤组织的诱导率的影响。
1.2.2 继代培养分别考察1/2MS继代培养基中不同浓度的6-BA和NAA对指状胚状体(类原球茎)的诱导率的影响,设置1/2MS继代培养基中6-BA浓度分别为0,0.5,1.0,1.5,2.0,2.5,3.0 mg·L-1,NAA浓度分别为 0,0.2,0.8,1.4,2.0 mg·L-1,培养60 d后计算诱导率。
1.2.3 生根培养将胚状体转移至生根培养基,培养62 d后调查组培苗的生根率。向1/2MS生根培养基中加入0,0.40,0.80,1.20和1.60 mg·L-1的NAA,考察不同浓度对组培苗生根率的影响。
1.2.4 移苗锻炼将叶片长约2 cm,并有2~3条粗壮的根(约1 cm长),且生长较为健壮的完整植株,转移至阴凉处炼苗,7 d后将幼苗转移至事先准备好的砂床(粗椰糠:河沙为1:1)上,保持砂床湿度为80%~90%,在不同遮阴条件下(遮光30%,50%,70%)培养14 d,调查移栽成活率。
1.3 数据分析方法
试验获得的数据结果为3次重复的平均值,数据处理和差异显著性分析应用SPSS软件进行。诱导率和生根率的计算公式如下:
愈伤组织诱导率(%)=(产生愈伤组织的外植体数/外植体总数)×100
组培苗生根率(%)=(生根苗数/培养苗总数)×100
2 结果与分析
2.1 钻喙兰初代培养条件的优化
由表1可以看出,初代培养以MS培养基中添加0.9 mg·L-16-BA和0.2 mg·L-1NAA的处理愈伤组织诱导率最高,达96.8%。正交试验设计的最佳组合为A2B3C2,即在1/2MS+0.9 mg·L-16-BA+0.1 mg·L-1NAA条件下以种子为外植体的钻喙兰初代培养,外植体的诱导率最高。三个因素中培养基对愈伤组织诱导率的影响最大,极差为8.6。

表 1 钻喙兰初代培养条件的正交试验优化
2.2 钻喙兰继续代培养条件的优化
2.2.1 不同6-BA浓度对钻喙兰继代培养诱导率的影响由图1中的数据结果可以看出,随着继代培养基中植物生长调节剂6-BA浓度的增加,钻喙兰继代培养的胚状体诱导率先升高后降低,当培养基中添加6-BA的浓度为2.5 mg·L-1时,继代培养钻喙兰胚状体诱导率最高,可达96.4%。当培养基中添加6-BA的浓度为2.0 mg·L-1和3.0 mg·L-1时,钻喙兰继代培养胚状体诱导率略低于2.5 mg·L-1处理,均超过92%。不添加植物生长调节剂6-BA时,胚状体的诱导率最低。

图 1 不同6-BA浓度对钻喙兰继代培养诱导率的影响
2.2.2 不同NAA浓度对钻喙兰继代培养诱导率的影响

图 2 不同NAA浓度对钻喙兰继代培养诱导率的影响
由图2可知看出,培养基中添加NAA后,钻喙兰继代培养胚状体诱导率逐渐增加,但当NAA浓度高于1.4 mg·L-1后,钻喙兰胚状体诱导率不再继续增加,反而呈降低趋势。可见,当NAA浓度为1.4 mg·L-1时,诱导率最高,达93.1%,比不添加NAA的处理诱导率升高了13.4%。
2.3 不同浓度NAA对钻喙兰生根的影响
由图3可知,钻喙兰组培苗的生根率随生根培养基中NAA浓度的增加而升高。当生根培养基中不添加NAA(0 mg·L-1)时,钻喙兰组培苗的生根率仅为81.3%;随着钻喙兰组织培养生根培养基中添加的NAA浓度升高,钻喙兰组培苗的生根率也随之升高,当生根培养基中添加NAA的浓度为1.60 mg·L-1时,钻喙兰组培苗的生根率达到最高,为95.1%,比未添加NAA的处理生根率提高17%。可见,向钻喙兰组织培养生根培养基中添加NAA,可以起到显著促进钻喙兰组培苗生根的作用。

图 3 不同浓度NAA对钻喙兰组培苗生根的影响
2.4 不同遮阴处理对钻喙兰组培苗移栽成活率的影响
由图4可以看出,随着遮光率的增加,钻喙兰组培苗移栽成活率呈先增加后降低的变化趋势,各遮光处理组培苗的移栽成活率均高于90%。当遮光率为50%时,组培苗成活率达到最高,为97.4%,分别较遮光率为30%和70%的处理成活率升高了6.8%和1.7%,可见,半遮光即可有效增加组培苗的移栽成活率,继续遮光对成活率产生负面影响。
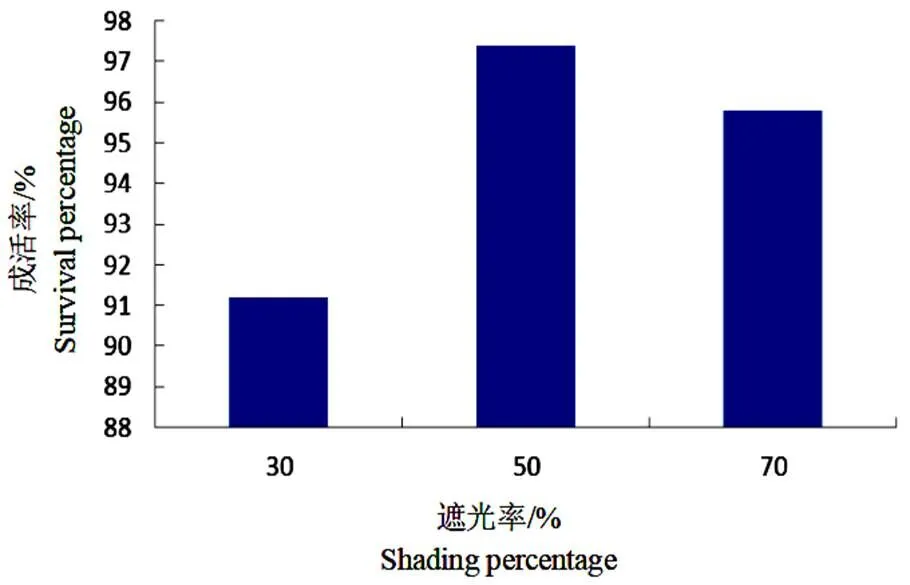
图 4 不同遮阴处理对钻喙兰组培苗移栽成活率的影响
3 讨论与结论
由于兰花种子不适合自然条件下培育成苗,并且繁殖过程中存在繁殖周期长以及繁殖效率低等问题,严重制约了钻喙兰栽培产业化的发展。兰科植物的人工栽培生产中,常常将优良单株通过组织培养的技术手段在短期内进行大批量的扩繁,这样不仅能获得品种一致性较好的优良群体,还能大大增加繁殖效率[15-18]。
植物器官的分化通常受内源激素的影响,因此可以通过外源施加植物生长调节剂处理来改变内源激素的平衡而产生影响器官分化的作用[19]。植物生长调节剂不仅在愈伤组织诱导中起到重要作用,而且在愈伤组织的生长和分化中作用关键。前人研究结果表明,植物生长调节剂6-BA在诱导芽的萌发与不定芽增殖的过程中常常能起到促进作用,另外,在低浓度下6-BA还能起到促进茎的伸长的作用。6-BA和NAA的组合经常用在植物组织培养技术的优化体系中[20]。
不管用哪个部位的外植体,在兰科观赏植物的组织培养过程通常都是按照从外植体先经过分化形成原球茎,再形成丛生原球茎,最后生根发芽发育成苗[21]。本试验研究以钻喙兰未成熟种子为外植体进行组织培养,通过优化组织培养条件参数,达到提高繁殖效率的目的,最终获得了能够显著提高繁殖效率的较优培养条件。
本研究结果表明,以钻喙兰未成熟种子为外植体,较优的初代培养条件为1/2MS培养基中添加0.9 mg·L-16-BA和0.1 mg·L-1NAA,在此条件下愈伤组织诱导率较高;继代培养采用1/2MS继代培养基中加入2.5 mg·L-16-BA和1.4 mg·L-1NAA;生根培养中采用1/2MS+1.6 mg·L-1NAA培养基能获得较高的生根率;移栽炼苗采用50%遮光率组培苗成活率最高,可达97.4%。通过钻喙兰的组培快繁技术体系的优化,可为钻喙兰的栽培生产提供可借鉴的参考。
[1] 李志英,徐立.海南钻喙兰离体繁殖及植株再生[J].园艺学报,2006,33(3):674
[2] 文慧婷,张翠玲.海南钻喙兰原球茎的形态建成和快速繁殖[J].安徽农业科学,2008,36(34):14971-14972
[3] 黄卫昌,SUNITHA Nagaraj.不同贮藏温度和时间对钻喙兰人工种子萌发及其幼苗成活的影响[J].植物资源与环境 学报,2005(3):63-64
[4] 谢佩吾,许传辉.钻喙兰属的原生种及主要栽培品种[J].花木盆景(花卉园艺),2017(10):30-33
[5] 张蕊,石娜,孙玲凌,等.楸树无糖组织培养快繁技术初探[J].江苏农业科学,2022,50(1):45-50
[6] 卢思聪.万带兰类及其栽培[J].植物杂志,1996(6):15-16
[7] 林志强,张桂兴,王育城.钻喙兰不同成熟度的胚培养研究[J].热带农业工程,2010,34(5):43-45
[8] 谢佩吾,马锞,江南,等.钻喙兰花粉活力测定及储藏研究[J].花卉,2018(20):2-5
[9] 陈和明,吕复兵,李佐,等.蝴蝶兰(spp.)与钻喙兰()远缘杂交种子无菌播种及 后代表型分析[J].中国农业大学学报,2021,26(3):28-37
[10] 黄丹,陈和明,吕复兵.蝴蝶兰丛生芽组织培养研究进展[J].广东农业科学,2017,44(10):19-24
[11] 刘玉石.蝴蝶兰的组织培养技术[J].现代农业,2017(5):14-15
[12] 周利利.蝴蝶兰组培快繁体系的建立[D].杭州:浙江农林大学,2017
[13] 夏朝水,胡启灿,陈芝华,华树妹.文心兰组培快繁技术研究[J].福建农业科技,2010(4):76-78
[14] 王艳芳,常德昌.热带兰组培快繁中类原球茎分切大小与增殖率的关系[J].中国园艺文摘,2016,32(9):45,62
[15] 张新平,张芳芳,王飞,等.植株成熟度与细胞分裂素对三种兰科植物试管开花与组培增殖的影响[J].南方园艺,2017,28(4):5-10
[16] 魏光平.兰花组培技术研究[J].花卉,2017(24):4-5
[17] 杨澜,王爱华,石乐娟,等.不同基因型兰花组培苗对植物生长调节剂的响应[J].分子植物育种,2019,17(2):593-599
[18] 景袭俊,胡凤荣.兰科植物研究进展[J].分子植物育种,2018,16(15):5080-5092
[19] 李孟南,戴秋月,黄永芳,等.油茶花芽分化形态结构及内源激素变化[J].亚热带植物科学,2021,50(6):478-484
[20] 林贵美,李小泉,李朝生,等.6-BA对麝香百合组培继代苗的影响[J].中国农业科技导报,2007(2):66-68
[21] 席会鹏,葛奇,李佳蔚.热带芳香观赏兰花香花毛兰的组培快繁技术[J].热带农业科学,2020,40(2):54-64
Optimization for the Rapid Propagation Techological System of(L.) Bl.
ZHENG Qiu-hua1, ZHENG Yi-ze2, LIU Bo-ting1, LIU Yu-jia1, ZENG Song-rong1, LI Dong-ran1, LI De-you1, WU Jing-xu2
1.512005,2.512005,
The division propagation method which was commonly used in usual was inefficient and hard to satisfy production requirements. The efficiency of propagation could be raised by optimization of tissue culture system for rapid propagation of(L.) Bl.. The substrates and plant growth regulators in primary culture, subculture and root induction culture were investigated in order to promote tissue culture, and the shading coefficient was observed after transplanting in order to promote propagation. The research results showed that the optimized tissue culture system for rapid propagation ofwere 1/2Ms+6-BA0.9 mg·L-1+ NAA 0.1 mg·L-1in primary culture with the frequency of callus induction of 96.8%, 1/2MS+6-BA 2.5 mg·L-1+NAA 1.4 mg·L-1in subculture with the frequency of induction of 96.4% and 1/2MS+NAA1.6 mg·L-1in root induction culture with the rooting percentage of 95.1%. The 50% of shading coefficient had the highest survival rate of 97.4% after transplanting. The research results could provide references for. cultivation and production with higher efficiency.
(L.) Bl.; tissue culture; techological optimization
S682.31
A
1000-2324(2022)04-0548-05
10.3969/j.issn.1000-2324.2022.04.008
2022-01-11
2022-02-31
广东省韶关市科技计划项目(200810224537589);广东省韶关市科技计划项目(200812154532904);广东省韶关市科技计划项目(200811114531461);韶关学院2020年度国家级大学生创新创业训练计划项目(202010576003X)
郑秋桦(1980-),男,硕士,高级实验师,主要从事植物组织培养、兰花产业化等方面的研究. E-mail:55y55@126.com
