高产虾青素红法夫酵母的代谢工程育种研究进展
2022-10-19张晴龙李曦月倪孟祥
王 军,张晴龙,李曦月,倪孟祥
(中国药科大学,江苏 南京 210000)
20世纪30年代,在虾、螃蟹等水生动物中萃取出一类浅紫红色晶体物质,后经确认为一类与虾红素有密切联系的类胡萝卜素,命名为虾青素,又称虾黄素、虾黄质。虾青素广泛存在于虾、蟹、鱼、鸟以及多种微生物中,是一种双环类胡萝卜素,具有极强的抗氧化能力,其淬灭单线态氧和捕捉自由基的能力比β-胡萝卜素高约10倍,比维生素E高500多倍,被称为“超级维生素E”[1-2]。虾青素还具有抗癌[3]、提高免疫力[4]、护肝[5]等作用以及良好的着色功效[6]。红法夫酵母(Xanthophyllomycesdendrorhous)是美国科学家Phaff等在日本和北美发现的一种天然合成虾青素的酵母,是目前报道的自然界中唯一天然合成3R,3′R右旋构型虾青素的酵母类菌株[7]。红法夫酵母生命周期短,合成虾青素速率较快,不要求强烈光线,可以使用各种葡萄糖作为碳源实现迅速异养新陈代谢,还可以在发酵罐中进行高密度发酵,已成为目前工业化生产虾青素的优质菌株。为提高虾青素产量,研究人员通常采用随机诱变方法选育高产虾青素红法夫酵母菌株;随着分子生物学手段的不断进步,在分子水平对红法夫酵母进行基因改造以选育高产虾青素菌株具有更大的应用潜力。因此,作者在分析虾青素结构及代谢途径的基础上,对红法夫酵母中虾青素合成限速酶及高产虾青素红法夫酵母的代谢工程育种方法的研究进展进行综述,为天然虾青素的产业化提供帮助。
1 虾青素的结构
从结构上看,虾青素是一种萜烯类化合物,也是类胡萝卜素的一种。虾青素的结构比较特殊,除了具有类胡萝卜素拥有的由多个共轭双键组成的疏水性碳链外,其两端还具有2个极性的β-紫罗酮环,每个紫罗酮环上都有1个羟基和1个羰基[8],这种特殊的结构使得虾青素能横跨细胞膜,在细胞膜内外两侧起到传递氧自由基中高能电子的作用,使得虾青素的抗氧化活性高于普通的类胡萝卜素[9]。
虾青素的天然构型主要分为3R,3′R右旋构型、3S,3′S左旋构型、3R,3′S内消旋构型等3类旋光异构体(图1)。其中,3R,3′R右旋构型和3S,3′S左旋构型的抗氧化活性较高,而3R,3′S内消旋构型的抗氧化活性极低。一般来说,人工合成的虾青素包括上述3种构型[10];天然虾青素主要以单一的全反式构型存在,主要来源于菌类、藻类以及一些浮游生物。如雨生红球藻产虾青素为3S,3′S左旋构型,产量达到了细胞干重的4%;红法夫酵母产虾青素大多是3R,3′R右旋构型,与南极磷虾中虾青素构型基本相同,被认为是最适于水生动物利用的虾青素。

图1 虾青素的3类旋光异构体Fig.1 Three kinds of optical isomers of astaxanthin
2 红法夫酵母中虾青素的代谢途径
红法夫酵母中虾青素的合成主要依赖双环途径(图2)。首先,乙酰辅酶A(AcCoA)在3-羟基-3-甲基戊二酰辅酶A合成酶(HMG-CoA synthase)的作用下合成HMG-CoA;接着,在HMG-CoA还原酶(HMG-CoA reductase)的催化下生成甲羟戊酸(MVA);MVA通过一系列的酶催化反应生成异戊二烯焦磷酸(IPP);IPP是所有萜类化合物共同的前体,在异戊二烯焦磷酸异构酶(IPP isomerase)的作用下生成二甲烯丙基焦磷酸(DMAPP);3分子IPP和1分子DMAPP在牻牛儿基牻牛儿基焦磷酸合成酶(GGPP synthase)的催化下生成GGPP;GGPP在八氢番茄红素合成酶(phytoene synthase)和八氢番茄红素脱氢酶(phytoene desaturase)的作用下生成番茄红素(lycopene);然后,番茄红素在番茄红素环化酶(lycopene cyclase)的作用下生成β-胡萝卜素;最后,在虾青素合成酶作用下生成目标产物虾青素[11]。
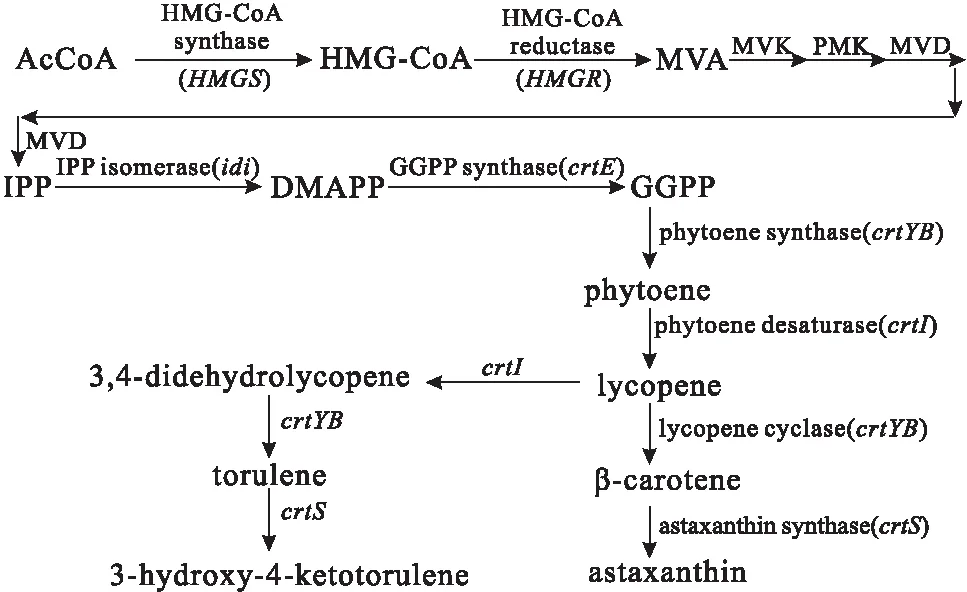
图2 红法夫酵母中虾青素的代谢途径Fig.2 Metabolic pathway of astaxanthin in Xanthophyllomyces dendrorhous
3 红法夫酵母中虾青素的合成限速酶
过去几十年,科研工作者在菌种选育方面的手段比较单一,主要是随机诱变、优化发酵工艺等。随着分子生物学手段的不断进步,研究人员更多地通过基因工程手段构建基因工程菌株,通过改变基因的表达来控制相关代谢流的限速酶,从而提高目标产物的产量。表1为红法夫酵母中虾青素的合成限速酶。

表1 红法夫酵母中虾青素的合成限速酶
3.1 HMG-CoA还原酶
HMG-CoA还原酶,由HMGR基因编码。HMG-CoA还原酶是MVA途径的一个限速酶。由于红法夫酵母中虾青素的合成主要来自于MVA途径,因而HMG-CoA还原酶是虾青素上游基因调控的第一个重要限速酶。研究人员通过表达HMGR基因,可以促进MVA的合成,从而可以使碳流更多地流向虾青素[12]。
3.2 IPP异构酶
IPP异构酶是MVA途径中最后一个重要的限速酶,由idi基因编码。IPP异构酶的主要功能是催化IPP生成DMAPP,而DMAPP是GGPP的前体物质。因而,通过控制IPP异构酶的活性可以控制整个虾青素的代谢。Wang等[13]将海洋细菌中的crt基因簇导入到大肠杆菌中,从而过表达虾青素代谢途径基因,虾青素产量提高到1.25 mg·g-1,表明控制虾青素代谢途径基因表达的确可以控制虾青素的合成,但是这些基因在原核与真核生物中的具体作用有待进一步探究。
3.3 GGPP合成酶
GGPP合成酶是催化IPP和DMAPP合成GGPP的限速酶。研究显示,大多数类胡萝卜素都是通过异戊二烯化合物途径合成,这个途径的前体物质是IPP。GGPP作为萜类化合物的前体,是很多萜类化合物以及类胡萝卜素的骨架,而且GGPP是绝大多数代谢物的前体,因而GGPP可以在上游调节许多产物的碳流量。GGPP合成酶是原核与真核生物体内最重要的限速酶之一[14]。
3.4 八氢番茄红素合成酶和番茄红素环化酶
八氢番茄红素合成酶和番茄红素环化酶均由crtYB基因编码,其中,八氢番茄红素合成酶可以催化GGPP合成八氢番茄红素,番茄红素环化酶可以催化番茄红素环化合成β-胡萝卜素。红法夫酵母中的crtYB基因目前已经得到分离。八氢番茄红素合成酶被ATP(作为辅底物)和二价阳离子(Mn2+或Mg2+)激活,却受无机磷酸的抑制。在类胡萝卜素的代谢途径中,八氢番茄红素合成酶是最关键的限速酶,控制着整个类胡萝卜素的代谢途径[15]。研究显示,仅仅提高番茄红素环化酶的表达量,无法显著提高虾青素产量。因而可以推测,仅仅单一地过表达某一个相关的基因,虽然可以调节相关类胡萝卜素产量,但对虾青素产量的影响不大[16]。
3.5 八氢番茄红素脱氢酶
在虾青素代谢途径中,八氢番茄红素脱氢酶是由crtI基因编码的一种重要的脱氢酶,也是催化八氢番茄红素发生多步连续脱氢反应依次生成不同碳碳双键饱和度的脱氢产物的关键限速酶。有研究人员对八氢番茄红素脱氢酶催化的多步连续脱氢反应的脱氢步数进行了探究。Arnold团队[17]采用序列比对的理性设计方法对发生四步脱氢反应的欧文氏菌来源的crtI基因进行单点突变改造,分别获得了合成链孢红素以及六步脱氢产物3,4-3′,4′-脱氢番茄红素的突变体。
3.6 虾青素合成酶
虾青素合成酶是虾青素代谢途径中的最后一个重要的限速酶。在光合细菌中,β-胡萝卜素到虾青素的合成过程由β-胡萝卜素羟化酶和β-胡萝卜素酮化酶催化,但是在红法夫酵母中没有分离到相关的酶。研究表明,在红法夫酵母中,催化合成虾青素的酶是一种细胞色素P450单加氧酶,由crtS基因编码。通过过表达crtS基因,可以提高β-胡萝卜素向虾青素的转化率[16]。
4 红法夫酵母代谢工程育种方法
4.1 过表达虾青素内源性基因
内源性基因主要指虾青素代谢途径中表达相关限速酶的基因,通过增加这些基因的拷贝量来提高相关限速酶的表达,进而提高转化率。Gassel等[18]通过游离表达红法夫酵母中虾青素代谢途径相关基因,包括crtE、crtYB、crtS,使得虾青素产量提高了20多倍。宋熙[19]向红法夫酵母中导入质粒,过表达crtE基因,使得自带启动子和带有gpd强启动子的菌株的虾青素产量显著提高。Ledetzky等[20]向红法夫酵母中转化了最多3个拷贝的crtYB基因,总类胡萝卜含量测定结果表明,重组子中八氢番茄红素合成酶已接近饱和;crtYB基因拷贝数的增加也影响了类胡萝卜素的组成,细胞中积累了大量合成虾青素的底物和中间体,通过与虾青素合成酶基因的额外转化,它们可以进一步转化为虾青素。Chi等[21]通过过表达虾青素代谢途径中的虾青素合成酶,使得虾青素产量提高了33.5%,与虾青素合成相关的其它限速酶的表达量也得到了相应提高。
4.2 异源表达外源性基因
研究人员以往大多是通过调控内源性基因来控制代谢流,提高虾青素产量,但由于红法夫酵母中内源性基因种类的局限性,导致能够改变的代谢流有限。因此,研究人员转为调控外源性基因,比如向红法夫酵母中导入一些光合细菌或者藻类的虾青素代谢途径基因等。金超[22]将来源于雨生红球藻的β-胡萝卜素酮化酶编码基因(bkt)和来源于欧文氏细菌的β-胡萝卜素羟化酶编码基因(crtZ)导入到产β-胡萝卜素红法夫酵母突变株内,首次实现了在红法夫酵母中合成3S,3′S左旋构型的虾青素。Breitenbach等[23]以经过基因工程改造的仅积累β-胡萝卜素的红法夫酵母为底盘细胞,导入异源的crtZ基因,通过同源重组,将crtZ基因整合到核糖体DNA上去,最终生成5.2 mg·g-1的玉米黄素。
4.3 敲除旁支基因
除了过表达虾青素代谢途径中的限速酶外,还可以通过敲除虾青素代谢途径外的非致死基因使碳流更多地流向目标产物。通常使用的基因敲除方法主要有同源重组敲除法、Cre/loxp系统以及近年比较热门的CRISPR/Cas9系统介导的基因敲除。虽然CRISPR/Cas9系统已经非常成熟,但是将其应用到红法夫酵母鲜有报道。Yamamoto等[24]通过敲除cyp61基因消除HmgS和HmgR的反馈抑制,虾青素产量提高了数倍。张宁[25]成功建立了红法夫酵母CRISPR/Cas9基因编辑平台,利用同源重组敲除法对类胡萝卜素合成的竞争途径甾醇代谢途径的erg27和cyp61基因进行双敲除,虾青素产量明显提高,为高产虾青素红法夫酵母的选育奠定了基础。
5 展望
近几十年来,科研工作者对红法夫酵母发酵产虾青素的研究取得了许多重要的成果,但仍有很多问题需要解决:产量较低、生产成本较高、无法工业化生产等。为提高虾青素产量,科研人员采取多种方法改造菌株,基因编辑是目前研究的热点,CRISPR/Cas9系统作为基因编辑中比较热门的手段被应用到红法夫酵母中以提高虾青素产量,如何有效地应用CRISPR/Cas9系统提高虾青素产量是天然虾青素工业化生产的一个重要突破口。相信,随着发酵工艺的不断优化、优势菌株的不断选育,天然虾青素的高效工业化生产必将实现。
