四分子交联蛋白-5在母-胎界面表达与不明原因妊娠丢失相关性
2022-10-19梁营秋陶鑫丽刘敏茵汤海瑜权莉钟碧玲高天旸
梁营秋 陶鑫丽 刘敏茵 汤海瑜 权莉 钟碧玲 高天旸
1石家庄市第四医院(河北医科大学附属妇产医院)(石家庄050000);广东省第二人民医院2生殖医学中心,3病理科(广州 510317)
胚胎着床的过程是非常复杂的,需要母-胎界面多种细胞分泌的多种激素、生长因子及细胞因子等协同作用,共同形成母-胎界面特殊的免疫微环境,允许作为半同种移植物的胚胎滋养细胞对子宫内膜恰当的识别、黏附、侵袭、种植。这个过程与肿瘤细胞转移、种植十分相似,但又有不同,正常滋养细胞的侵袭行为受到母-胎界面免疫微环境的精确调控而具有“节制性”[1-2]。胚胎发育异常、母体免疫、感染、解剖、内分泌异常或母胎界面免疫微环境改变、滋养细胞增生、侵袭异常等,都可能导致妊娠丢失,从而导致胚胎种植失败、流产等不良妊娠结局的发生。据估计,全世界每年有2 300 万例流产,相当于每分钟就有44 例流产,自然流产的发生往往给患者及其家庭带来巨大的伤害和压力[3],但目前自然流产的病因和治疗还是医学领域的难题。
四分子交联体(Tetraspanins)是一组低分子质量的糖蛋白,因其有四个跨膜区域,又称四跨膜蛋白超家族(transmembrane 4 superfamily,TM4SF)[4]。这个家族蛋白可以通过蛋白间的级联效应,调节细胞的多种功能,如细胞分化、变形、黏附、迁移和蛋白转运,形成新生血管,降解和重排基质细胞,参与多种肿瘤细胞的侵袭进展[5]。由于胚胎滋养细胞侵袭蜕膜的行为与肿瘤细胞的侵袭行为的类似与不同。因此近年来不少学者研究Tetraspanins在胚胎种植中的作用,发现CD82、CD63、CD9 等在母-胎界面均有不同程度表达,并参与了滋养细胞生物学特性的调节[6-7]。
四分子交联体5(Tspan-5)就是四跨膜蛋白超家族中的一员,因其在细胞外结构域的大细胞外环中有8 个半胱氨酸(而其他四跨膜蛋白具有4 或6 个半胱氨酸),故又称为TspanC8[8]。研究发现Tspan5 激活Notch 信号,增强上皮-间充质转化和肿瘤细胞的肌动蛋白骨架重排,是肝癌细胞生长、迁移和侵袭所必需的[9-10]。前期研究发现Tspan-5 与植入过程中滋养细胞的增生和侵袭特性呈正相关,且发现输卵管妊娠的滋养细胞侵袭活性增强[11-12]。因此本文观察Tspan-5 在母-胎界面的表达情况,并比较不明原因自然流产患者和正常早孕者绒毛、蜕膜中该蛋白的表达水平,以探讨其与不明原因妊娠丢失及胚胎种植失败的相关性。
1 资料与方法
1.1 研究对象及分组
1.1.1 观察组 共37 例,系2018年1月至2020年1月就诊于我院的稽留流产患者的清宫标本。所有入组患者均行胚胎染色体的检查。排除:胚胎染色体异常者,母体患有多囊卵巢综合征、甲状腺功能异常、宫腔粘连、生殖道畸形及感染等相关疾病者。
1.1.2 对照组 同期就诊于我院,因计划外妊娠要求人工流产的正常早孕患者,要求年龄孕周孕次等与观察组相匹配,共41 例。排除:(1)既往有异常孕产史者(如自然流产、死产、死胎等);(2)本次妊娠期间有先兆流产症状和体征者;(3)患有多囊卵巢综合征、甲状腺功能异常等内分泌疾病者;(4)有自身免疫性疾病或感染者;(5)有泌尿生殖系统解剖结构异常的患者。
所有标本均经过我院病理科医师诊断验证,且患者手术前3 个月内未应用激素类药物治疗。
1.1.3 未妊娠组 标本为我院病理科同期存档的育龄期女性刮宫的子宫内膜蜡块,共43 例。分为:(1)月经期:10 例,因“子宫内膜增厚”在我院刮宫,术后病理提示“月经期子宫内膜”。(2)增殖期:21 例,因“子宫内膜增厚”在我院刮宫,术后病理提示“增殖期子宫内膜”。(3)分泌期:12 例,因“男方因素”拟在我院行体外受精胚胎移植的患者,胚胎移植前行探宫和宫腔搔刮时所取子宫内膜。排除标准:(1)泌尿生殖系统解剖结构异常者;(2)既往有异常孕育史者;(3)有自身免疫性疾病或感染者;(4)有多囊卵巢综合征、甲状腺功能异常等内分泌疾病者。
本研究已获得广东省第二人民医院伦理委员会的批准(批准文号:2018-SZYX-032),且所有患者知情同意。
1.2 主要试剂 一抗:由美国Santa Cruz 公司提供的兔抗人Tspan-5 蛋白多克隆抗体,稀释浓度为1∶100;山羊血清封闭液由BOSTE 公司提供;二抗:由GT 公司提供的HRP 标记聚合物(抗兔、鼠)。
1.3 方法 (1)采用免疫组化法检测标本中Tspan-5 蛋白表达,实验方法按S-P 法操作。操作步骤严格按照试剂盒要求进行:石蜡切片脱蜡至水,抗原修复,滴加一抗4 ℃过夜,二抗在室温下孵育,DAB 显色,用苏木素复染,脱水后透明封片,在光镜下观察。以葡萄胎绒毛标本作为阳性对照组,空白对照组以PBS 代替一抗。(2)检测结果的判定:标本染色为黄色或棕黄色处判定为阳性信号,每张照片均采用Image-Pro Plus 软件测定平均积分光密度值(IOD 值),每张玻片选5 个视野,取平均值。
1.4 统计学方法 统计分析用SPSS 13.0统计软件进行,计量资料用()表示。符合正态分布且方差齐的数据,采用完全随机设计的方差分析(One-Way ANOVA)行多组均数的比较,用Dunnett 法行组间多重比较;若方差不齐,用Welch 法校正,用Dunnett′s T3 法进行组间多重比较。独立样本t检验(independent-sample T test)的方法进行两组均数的比较;若方差不齐时用Satterthwaitet′检验。对于不符合正态分布的数据,采用两独立样本的非参数检验(Kruskal WallisHtest)。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
2.1.1 观察组 稽留流产患者(共37 例),孕周为6 ~12周,孕次为1 ~10次,平均孕次(2.92±1.93)次,平均自然流产次数1.41 次;平均停经时间(63.11±11.86)d;患者平均年龄为(27.84±4.94)岁。见表1。
2.1.2 对照组 正常早孕患者(共41 例),孕周为6 ~12周,孕次为1 ~7次,平均孕次(2.56±1.45)次;平均停经时间(58.17 ± 11.69)d;患者平均年龄为(27.60±4.42)岁。见表1。
表1 各组患者基本临床情况比较Tab.1 Comparison of clinical data between the two groups ±s
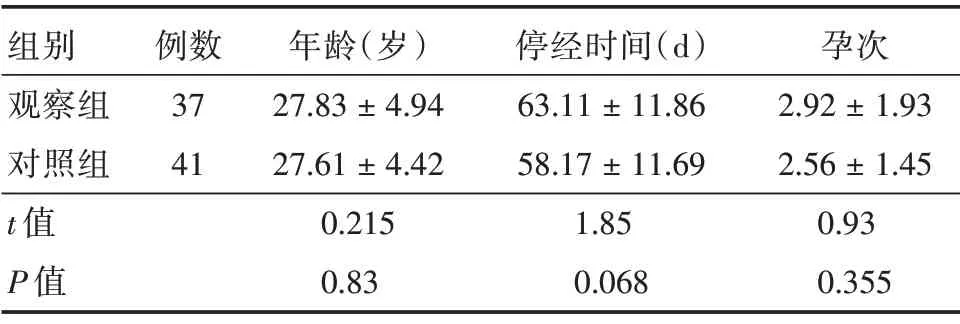
表1 各组患者基本临床情况比较Tab.1 Comparison of clinical data between the two groups ±s
组别观察组对照组t 值P 值例数37 41年龄(岁)27.83±4.94 27.61±4.42 0.215 0.83停经时间(d)63.11±11.86 58.17±11.69 1.85 0.068孕次2.92±1.93 2.56±1.45 0.93 0.355
2.2 人绒毛组织中Tspan-5 的表达
2.2.1 妊娠绒毛组织中Tspan-5 的表达部位 无论是在正常早孕患者绒毛中,还是在自然流产患者绒毛组织中,Tspan-5 均主要定位于具有侵袭作用的绒毛外细胞滋养细胞(EVCT)和具有增殖活性的细胞滋养细胞的胞浆和胞膜上,主要起分泌作用的合体滋养细胞中则是没有表达的(图1)。
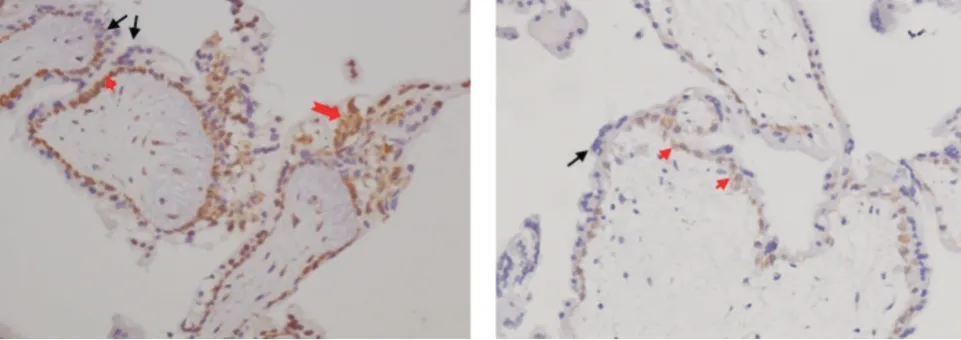
图1 在正常早孕和自然流产患者绒毛中Tspan-5 蛋白的表达(SP 法,×200)Fig.1 Expression of Tspan-5 protein in placental villi of patients with normal early pregnancy and those with spontaneous abortion(SP,×200)
2.2.2 人绒毛中Tspan-5 的表达水平 Tspan-5 蛋白在自然流产绒毛中表达水平显著低于对照组[IOD 均值:(53.22±35.47)vs.(89.04±36.44)],差异有统计学意义(P<0.001),见表2。
表2 Tspan-5 蛋白在观察组和对照组绒毛中表达水平的比较Tab.2 Comparison of the expression levels of Tspan-5 in placental villi between the observation group and the control group ±s

表2 Tspan-5 蛋白在观察组和对照组绒毛中表达水平的比较Tab.2 Comparison of the expression levels of Tspan-5 in placental villi between the observation group and the control group ±s
?
2.3 妊娠蜕膜组织中Tspan-5 的表达
2.3.1 妊娠蜕膜组织中Tspan-5的表达部位 Tspan-5在自然流产和正常早孕患者蜕膜组织中均有表达,表达部位主要是腺上皮细胞(glandular epithelial cells)和蜕膜基质细胞(decidual stromal cells,DSCs)的胞质和胞膜(图2)。
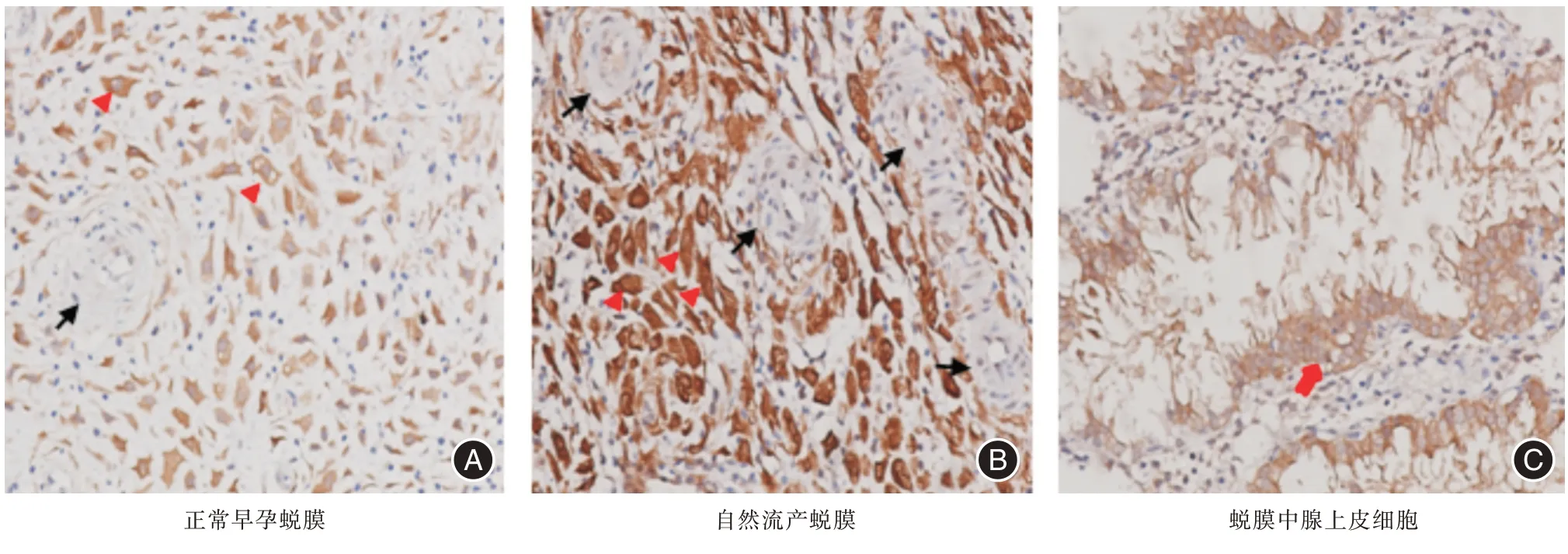
图2 Tspan-5 的表达Fig.2 Expression of Tspan-5
2.3.2 蜕膜/子宫内膜中Tspan-5 的表达水平的比较 Tspan-5 在观察组蜕膜组织中表达水平显著高于对照组[IOD均值:(184.49±119.69)vs.(93.43±67.10),P<0.001],差异有统计学意义(表3)。
表3 Tspan-5 在观察组和对照组蜕膜中表达水平的比较Tab.3 Comparison of the expression levels of Tspan-5 in the decidua between the the observation group and the control group ±s

表3 Tspan-5 在观察组和对照组蜕膜中表达水平的比较Tab.3 Comparison of the expression levels of Tspan-5 in the decidua between the the observation group and the control group ±s
组别观察组(自然流产)对照组(正常早孕)例数37 41 IOD 均值184.49±119.69 93.43±67.10 t 值4.084#P 值<0.001
2.4 Tspan-5 在未妊娠子宫内膜中的表达
2.4.1 Tspan-5 蛋白在未妊娠子宫内膜中的表达部位 Tspan-5 主要表达于未妊娠患者的增生期和分泌期的子宫内膜腺上皮细胞和子宫内膜基质细胞(endometrial stromal cells,ESC)的胞浆和胞膜,月经期子宫内膜则未见表达(图3)。
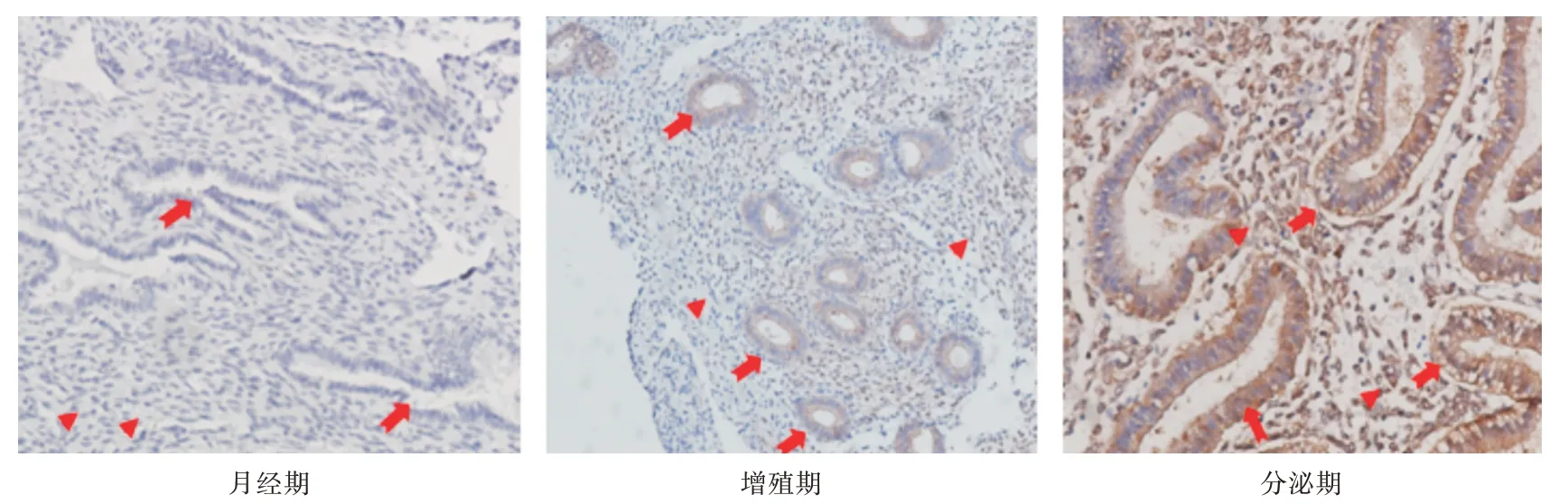
图3 未妊娠患者子宫内膜中Tspan-5 中的表达(月经期、增殖期、分泌期)(SP 法,×200)Fig.3 Expression of Tspan-5 in menstrual,proliferative and secretory phase endometrium(SP×200)
2.4.2 未妊娠子宫内膜中Tspan-5 的表达水平Tspan-5 在正常早孕蜕膜中表达水平[IOD 均值:(93.43 ± 67.10)]略高于增殖期[IOD 均值:(75.71±29.87)]和分泌期子宫内膜[IOD 均值:(88.56 ±33.24)],但3 组总体均数比较,差异无统计学意义(F=1.26,P=0.296,表4)。
表4 Tspan-5 在正常早孕蜕膜和未妊娠女性子宫内膜中表达水平的比较Tab.4 Comparison of the expression levels of Tspan-5 in the decidua of women with normal early pregnancy and in the endometrium of non-pregnant women ±s
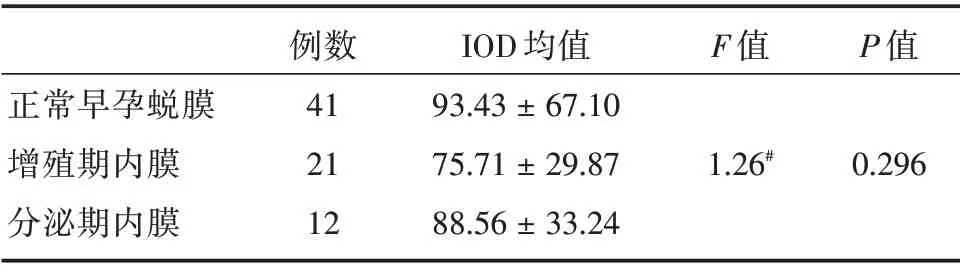
表4 Tspan-5 在正常早孕蜕膜和未妊娠女性子宫内膜中表达水平的比较Tab.4 Comparison of the expression levels of Tspan-5 in the decidua of women with normal early pregnancy and in the endometrium of non-pregnant women ±s
正常早孕蜕膜增殖期内膜分泌期内膜例数41 21 12 IOD 均值93.43±67.10 75.71±29.87 88.56±33.24 F 值1.26#P 值0.296
3 讨论
正常情况下,滋养细胞对子宫内膜的侵袭具有“节制性”,胚胎着床过程中滋养细胞的侵袭受滋养细胞本身因素和母体蜕膜微环境的精确的调控,仅发生于妊娠早期,且仅浸润深度一般不超过母体子宫肌层的内1/3,胎盘形成后其侵袭行为便自行终止。显然,滋养细胞具有类似肿瘤细胞的增殖、侵袭、迁移特性,但滋养细胞侵袭性的“节制性”又与肿瘤细胞显著不同。目前大量的研究认为滋养细胞分泌的激素、蛋白酶,蜕膜组织中的蜕膜间质细胞(DSC)和uNK 细胞等分泌的白介素、促血管生长因子及胎盘局部氧含量变化等,具有抑制或促进滋养细胞的侵袭迁移的作用,从而参与胚胎种植过程[13]。但是,滋养细胞从侵袭到停止侵袭的转化调控机制尚不清楚。研究认为自然流产、先兆子痫、胎儿宫内发育迟缓(FGR)等疾病均与滋养细胞的浸润异常有关[14-15]。
目前,用于评估胚胎活性及滋养细胞生长状态的主要指标是母体外周血中β-HCG 的水平,但由于HCG 主要是由不具有增殖能力和侵袭活性的合体滋养细胞分泌的,并不能很好的反映滋养细胞的侵袭性和增殖能力。本课题组前期研究已经证明Tspan-5 由执行侵袭功能的绒毛外滋养层细胞(EVCT)和增生活跃的细胞滋养细胞(CT)表达,与滋养细胞的增生和侵袭特性呈正相关[9],认为Tspan-5 能够反映滋养细胞的增殖状态和侵袭特性。本研究发现自然流产患者绒毛组织中Tspan-5表达水平明显低于正常早孕者。这提示母-胎界面某些因素可能通过调节滋养细胞中Tspan-5 的表达水平,影响滋养细胞侵袭特性,滋养细胞侵袭不足可能与自然流产的发生有关。
蜕膜基质细胞(decidual stromal cell,DSC)是母体蜕膜中的重要细胞,参与蜕膜营养供应,具有很强的内分泌功能,能够分泌多种激素、各种细胞因子、白细胞抗原及特定的黏附分子,调节蜕膜局部微环境,在胚胎种植过程中起重要作用。本研究发现Tspan-5 在蜕膜基质细胞的胞浆、胞膜有特异性表达,与自然流产患者滋养细胞中Tspan-5表达明显下降不同,该蛋白在自然流产蜕膜中表达水平反而显著升高,推测蜕膜基质细胞在胚胎种植过程中可能不仅是“被侵袭”,还具有主动粘附和迁移特性。CRISTINA 和JUBIN 等[16-17]研究发现Tspan-5 表达于高迁移活性的神经嵴细胞、迁徙的外颗粒细胞和浦肯野细胞,认为该蛋白在细胞迁移过程中具有调控作用,这与本研究结果不谋而合。
多项研究也从不同途径证明了蜕膜基质细胞具有收缩和迁移活性,且对胚胎和滋养细胞具有识别和应答。OLIVER 等[18]发现蜕膜基质细胞表达运动相关的波形蛋白(vimentin)和微丝α-平滑肌肌动蛋白(α-smooth muscle actin),而这是成纤维细胞和平滑肌细胞特有的超微结构,认为蜕膜基质细胞可能具有收缩功能。CHARLOTTE 等[19]则用免疫荧光的方法观察到蜕膜基质细胞向滋养细胞团所在位置定向移动的现象,提示蜕膜基质细胞对滋养细胞可能有特定的识别反应。GREWAL等[20-21]将人类蜕膜基质细胞分别与鼠囊胚和人类胚胎共培养,发现人蜕膜基质细胞能够抑制鼠胚胎滋养细胞的侵入;而人蜕膜基质细胞有向远离人胚胎着床位点的方向迁移的能力,认为蜕膜基质细胞的这种反向活动有利于人类胚胎向子宫内膜的侵入,说明人类蜕膜基质细胞对不同胚胎具有不同的“识别和应答”。这些研究结果支持本研究的推论:胚胎滋养细胞的侵袭能力可能需要子宫内膜的识别和迁移反应,且子宫内膜基质细胞的迁移特性的变化可能影响滋养细胞的侵袭活性和侵袭程度。
一项在破骨细胞的研究中发现,Tspan-5 基因敲除可抑制子宫内膜中Notch 信号活性,表明Tspan-5 是Notch 信号激活的促进因子[22]。研究认为Notch 信号增强可促进蜕膜间质细胞增殖及蜕膜化,有利于胚胎着床[23]。本研究中,分泌期子宫内膜中Tspan-5 的表达高于增殖期,而子宫内膜的蜕膜化始于分泌期,提示Tspan-5 可能与子宫内膜的蜕膜化相关。
本研究通过检测Tspan-5 在母-胎界面中的表达情况,探索该蛋白在胚胎种植中的作用及其与妊娠丢失的相关性,属于原创性研究,对Tspan-5在胚胎种植中的作用进行了深入的思考和探索,对自然流产的诊治提供了新的思路和方向。不足之处在于本研究主要基于组织学研究结果,还需要进一步深入的细胞实验和动物实验来探索Tspan-5 在母-胎界面的具体作用及调控通路。
