过表达TLR4基因对胃癌细胞自噬的抑制作用及其机制
2022-10-18张蒨,李静
张 蒨,李 静
(锦州医科大学附属第一医院消化内科,辽宁 锦州 121001)
胃癌是全球范围内常见的癌症之一,也是癌症死亡的主要原因之一,尽管近年来胃癌发病率呈缓慢下降趋势,但其并发症多,确切病因尚未完全阐明,严重威胁人类的健康,因此寻求分子靶点对胃癌诊断和治疗具有重要意义[1-2]。Toll样受体4(Toll like receptor 4,TLR4)是跨膜Toll样受体(Toll-like receptors,TLRs)家 族 成 员,TLRs作为信号转导蛋白,能识别通路相关的分子模式和内源性配体,TLR4激活可通过促进细胞凋亡抵抗、侵袭、转移和免疫监视逃避来促进肿瘤进展[3-5]。先天免疫是抵抗细菌入侵的第一道屏障,TLR4在先天性免疫和炎症中起着重要作用[6]。有研究[7-8]表明:TLRs基因与结肠癌和直肠癌的发展和预后相关。研究[9]显示:敲减Toll样受体2(Toll-like receptor 2,TLR2)基因可以抑制结直肠癌细胞增殖。研究[10-11]显示:TLR4参与胃癌细胞增殖和迁移。过表达TLR4基因对胃癌细胞自噬作用的相关研究报道较少,其机制尚未完全阐明。本研究采用慢病毒过表达RNA技术,在胃癌BGC-823细胞和SGC-7901细胞中过表达TLR4基因,探讨其对胃癌细胞自噬能力的影响并阐明其可能的分子机制,为胃癌的诊断和治疗提供新靶点。
1 材料与方法
1.1 细胞、主要试剂和仪器人胃癌HGC-27细胞(武汉普诺赛生命科技有限公司),正常胃黏膜上皮GES-1细 胞 及 胃 癌MGC-803、BGC-823和SGC-7901细胞(美国模式培养物集存库)。RPMI 1640培养基(北京HyClone科技有限公司),DMEM高糖培养基和胰酶(美国Gibco公司),胎牛血清(浙江天杭生物科技有限公司),1%青-链霉素(武汉普诺赛生命科技有限公司),慢病毒及感染试剂(上海吉凯基因化学技术公司),CCK-8试剂盒(美国APExBIO公司),PCR试剂盒(日本TaKaRa公司),TLR4和GAPDH抗体(美国Bioworld Technology公司),磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K)、磷 酸 化PI3K(phosphorylated PI3K,p-PI3K)、蛋 白 激酶B(protein kinase B,Akt)和 磷 酸 化Akt(phosphorylated Akt,p-Akt)(沈阳万类生物科技有限公司),哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)(美国Abcam公司),Beclin1和磷酸化mTOR(phosphory lated mTOR,p-mTOR)(美 国ABclonal公司),p62(美国Proteintech公司),微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)A/B(美 国Cell Signaling Technology公司),电化学发光剂(北京Biosharp公司)。倒置光学显微镜(日本Olympus公司),紫外可见光分光光度计(美国Thermo公司),基因扩增仪(德国费森尤斯公司),实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)仪(美国Bio-Rad公司)。
1.2 细胞培养和感染正常胃黏膜上皮GES-1细胞培养于含10%胎牛血清及1%青-链霉素的DMEM高糖培养基中,人胃癌HGC-27细胞培养于含20%胎牛血清及1%青-链霉素的RPMI 1640培养基中,人胃癌MGC-803、BGC-823和SGC-7901细胞培养于含10%胎牛血清及1%青-链霉素的RPMI 1640培养基中,置于37℃、5%CO2培养箱中孵育。将处于对数生长期的细胞计数铺板后37℃培养16~24 h,至细胞汇合度为20%~30%,更换培养基。SGC-7901细胞的最适感染复数(multiplicity of infection,MOI)为30时加入慢病毒和HitransG A感染增强液(吉凯基因自主研发的病毒感染增强液,其主要成分是一种新型的高分子非离子表面活性剂,同时也是一种细胞保护剂和促进吸收剂,可以通过提高细胞表面活性,增加病毒与细胞的接触面积,促进病毒高效感染细胞,且对细胞毒性极低,适合敏感细胞使用),BGC-823细胞MOI为30时加入慢病毒和HitransG P感染增强液(吉凯基因自主研发的病毒感染增强液,其主要成分是一种阳离子聚合物,通过抑制细胞膜与病毒之间的电荷排斥,增加慢病毒对细胞的感染效率),分为未感染组(普通培养基,无血清,无双抗)、阴性对照病毒组和过表达TLR4组。感染72 h,荧光表达丰度较高时,显微镜观察感染效率。感染效率达80%时,加入2 mg·L-1嘌呤霉素进一步筛选感染慢病毒的细胞,继续传代培养3~4代后进行后续实验。感染效率=感染细胞数/细胞总数×100%。
1.3 Western blotting法检测正常胃黏膜细胞和胃癌细胞及感染各组细胞中TLR4蛋白表达水平正常胃黏膜上皮GES-1细胞及胃癌SGC-7901、BGC-823、MGC-803和HGC-27细胞采用PBS缓冲液洗涤;慢病毒感染BGC-823和SGC-7901细胞后,将细胞由100 mm培养皿转移至1.5 mL离心管中,4℃、5 500 r·min-1离 心5 min,按 照RIPA∶PMSF(100∶1)配制裂解液,加入1%磷酸酶抑制剂,吹打混匀,超声碎细胞3次,每次10 s,每次有时间间隔,碎细胞前三蒸水擦洗,静置10 min,4℃、12 000 r·min-1离心25 min,弃上清。采用BCA蛋白定量法检测各组细胞蛋白浓度,制备浓度相同的蛋白样品。电泳后转膜1.5 h,将蛋白转移至PVDF膜上,室温下TBST配制1%BSA封闭液封闭2 h,一抗TLR4和GAPDH稀释比例为1∶10 000,4℃摇床孵育14~16 h;TBST洗膜3次,每次10 min;二抗稀释比例为1∶10 000,室温下摇床孵育2 h;TBST洗膜3次,每次10 min。ECL化学发光液按照A液∶B液=1∶1配制,均匀滴于膜上,使条带显影,采用Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。独立实验重复3次。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH蛋白条带灰度值。
1.4 CCK-8法检测各组细胞增殖活性各组SGC-7901细胞按每孔5 000个、BGC-823细 胞 按每孔2 000个接种于96孔细胞培养板,每组设5个复孔,置于37℃、5%CO2培养箱中培养;分别于细胞贴壁24、48、72、96和120 h后每孔加入10 μ L CCK-8溶液,孵育1 h,采用酶标仪于450 nm波长处检测吸光度(A)值,独立实验重复3次,绘制生长曲线,细胞增殖活性以A值表示。
1.5 RT-qPCR法检测各组细胞中TLR4、Beclin1和LC3 mRNA表达水平采用TRIzol法提取总RNA,去旧培养基,100 mm培养皿中加入1 mol·L-1TRIzol溶液吹打混匀,转移至1.5 mL离心管中,室温下静置5 min;每个EP管加入200 μL氯仿,漩涡震荡混匀15 s,室温静置2~3 min;12 000 g、4℃离心15 min,吸上层无色水相400 μL至新的1.5 mL离心管;加入与上清液等体积的异丙醇400 μL,数次颠倒混匀,室温下沉淀10 min;12 000 g、4 °C离心10 min,可见白色羽毛状沉淀,去上清液,留沉淀;加1 mL无酶75%乙醇,漩涡或颠倒混匀,7 500 g、4℃离心5 min,去上清;室温下静置,至RNA略干后,加入20~100 μL DEPC水,-80 °C保 存。Nanodrop分 光 光 度 计 检测RNA浓度及纯度,1 μL无酶水校正,取A260/A280比值为1.8~2.0范围内样本。PCR引物序列:TLR4,F 5′-GCCGCTGGTGTATCTTTG-3′,R 5′-CATCCTGTACCCACTGTTCC-3′;GAPDH,F 5′-GTGAAGCAGGCGTCGGA-3′,R 5′-CAAAGGTGGAGGAGTGGGT-3′;LC3,F 5′-GACTTATTCGAGAGCAGCATCC-3′,R 5′-ACATGGTCAGGTACAAGGAACT-3′;Beclin 1,F 5′-CGTCCAACAACAGCACCAT-3′,R 5′-ACACGGTCCAGGATCTTGAA-3′。冰上配制各反应液,去除基因组DNA后,逆转录为cDNA,采用RTqPCR仪 扩 增。采 用2-ΔΔCt法 计 算 目 的 基 因mRNA表达水平,实验重复3次。
1.6 Western blotting法检测各组细胞中自噬相关蛋白和PI3K/Akt/mTOR信号通路相关蛋白表达水平各组细胞蛋白质样品电泳后转移至PVDF膜上,LC3 0.22 μm膜、其余蛋白0.45 μm膜进行转膜1.5 h,LC3转膜30 min,室温下TBST配制1% BSA封闭液封闭2 h,根据maker对应的蛋白相对 分 子 质 量 裁 膜,LC3、Beclin1、p62、PI3K、p-PI3K、Akt、p-Akt(一抗稀释比例1∶1 000)、mTOR(一 抗 稀 释 比 例1∶5 000)、p-mTOR(一抗稀释比例1∶2 000)和GAPDH(一抗稀释比 例1∶10 000)所 在 条 带4℃孵 育14~16 h;TBST洗膜3次,每次10 min,二抗稀释比例为1∶10 000,室温下摇床孵育2 h;TBST洗膜3次,每次10 min。ECL化学发光液按照A液∶B液=1∶1配制,均匀滴于膜上,使条带显影,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH蛋白条带灰度值。
1.7 统计学分析采用GraphPad Prism 8.3.0统计软件进行统计学分析。各组细胞增殖活性,TLR4、Beclin1和LC3 mRNA表达水平,细胞中TLR4、p62、Beclin1、LC3、PI3K、p-PI3K、Akt、p-Akt、mTOR和p-mTOR蛋 白 表 达 水 平 均符合正态分布,以xˉ±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组细胞中慢病毒感染效率构建过表达TLR4慢病毒细胞株,荧光显微镜下观察结果显示:阴性对照病毒组和过表达TLR4组BGC-823细胞和SGC-7901细胞慢病毒感染效率均大于80%,能够验证TLR4表达。见图1和2。

图1 倒置显微镜(A-C)和荧光显微镜(D-F)下观察慢病毒感染5 d后BGC-823细胞感染情况(Bar=200 μm)Fig.1 Infection of BGC-823 cells at 5 d after infection of lentivirus under inverted microscope(A-C)and fluorescence microscope(D-F)(Bar=200 μm)
2.2 各组细胞中TLR4蛋白表达水平Western blotting法检测结果显示:胃黏膜上皮GES-1细胞和 胃 癌SGC-7901、BGC-823、MGC-803及HGC-27细胞中TLR4蛋白表达水平分别为1.00±0.00、0.63±0.08、3.01±0.61、2.02±0.62和1.84±0.29;与胃黏膜上皮GES-1细胞比较,胃癌BGC-823、MGC-803和HGC-27细胞中TLR4蛋白表达水平明显升高(P<0.05),胃癌SGC-7901细胞中TLR4蛋白表达水平明显降低(P<0.01)。未感染组、阴性对照病毒组和过表达TLR4组BGC-823细胞中TLR4蛋白表达水平分别为1.00±0.00、1.37±0.51和40.81±19.06;SGC-7901细胞中TLR4蛋白表达水平分别为1.00±0.00、1.49±0.61和6.98±3.04;与未感染组和阴性对照病毒组比较,过表达TLR4组BGC-823细胞和SGC-7901细胞中TLR4蛋白表达水平明显升高(P<0.05)。见图3和4。
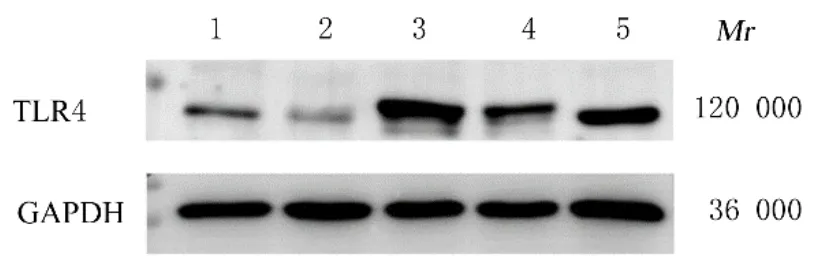
图3 Western blotting法检测GES-1细胞和胃癌细胞中TLR4蛋白表达电泳图Fig.3 Electrophoregram of expressions of TLR4 protein in GES-1 cells and gastric cancer cells detected by Western blotting method
2.3 各组细胞增殖活性CCK-8法检测结果显示:在感染96和120 h时,与未感染组和阴性对照病毒组比 较,过 表 达TLR4组BGC-823细 胞 和SGC-7901细胞增殖活性明显升高(P<0.05或P<0.01)。见表1和2。
表1 CCK-8法检测各组BGC-823细胞增殖活性Tab.1 Proliferation activities of BGC-823 cells in various groups detected by CCK-8 assay (n=3,±s)
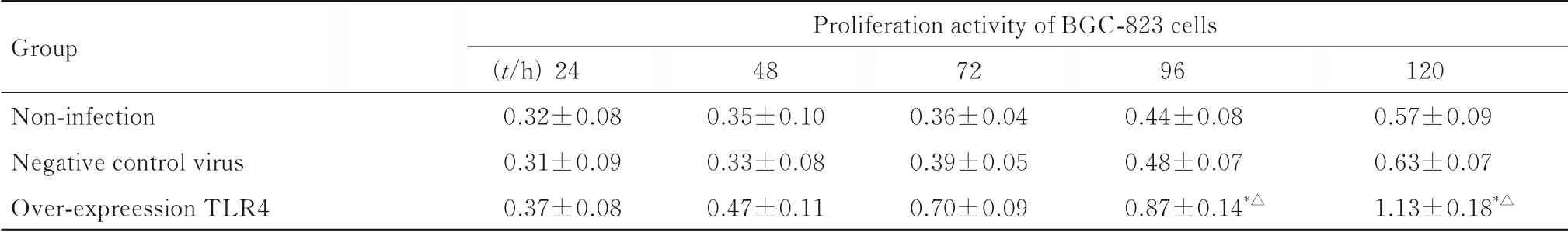
表1 CCK-8法检测各组BGC-823细胞增殖活性Tab.1 Proliferation activities of BGC-823 cells in various groups detected by CCK-8 assay (n=3,±s)
*P<0.05 compared with non-infection group;△P<0.05 compared with negative control virus group.
Group Non-infection Negative control virus Over-expreession TLR4 Proliferation activity of BGC-823 cells(t/h)24 0.32±0.08 0.31±0.09 0.37±0.08 48 0.35±0.10 0.33±0.08 0.47±0.11 72 0.36±0.04 0.39±0.05 0.70±0.09 96 0.44±0.08 0.48±0.07 0.87±0.14*△120 0.57±0.09 0.63±0.07 1.13±0.18*△
2.4 各组细胞中TLR4、LC3和Beclin1 mRNA表达水平与阴性对照病毒组比较,过表达TLR4组BGC-823细胞和SGC-7901细 胞中TLR4 mRNA表达水平明显升高(P<0.01),Beclin1 mRNA表达水平明显降低(P<0.05),SGC-7901细胞中LC3 mRNA表达水平明显降低(P<0.05)。见图5。
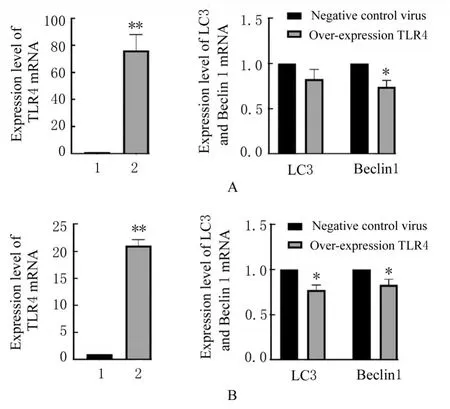
图5 RT-qPCR法检测各组BGC-823细胞和SGC-7901细胞中TLR4、LC3和Beclin1 mRNA表达水平Fig.5 Expression levels of TLR4,LC3 and Beclin1 in BGC-823 and SGC-7901 cells in various groups detected by RT-qPCR method
2.5 各组细胞中自噬相关蛋白和PI3K/Akt/mTOR信号通路相关蛋白表达水平与未感染组和阴性对照病毒组比较,过表达TLR4组BGC-823细胞和SGC-7901细胞中LC3和Beclin1蛋白表达水平明显降低(P<0.05),p62、p-PI3K、p-Akt和p-mTOR蛋白表达水平明显升高(P<0.05)。见图6和7。
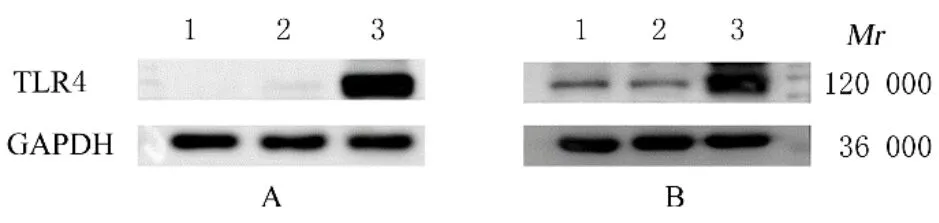
图4 Western blotting法检测各组BGC-823细胞(A)和SGC-7901细 胞(B)中TLR4蛋 白 表 达 电 泳 图Fig.4 Electrophoregram of expressions of TLR4 protein in BGC-823 cells(A)and SGC-7901 cells(B)in various groups detected by Western blotting method
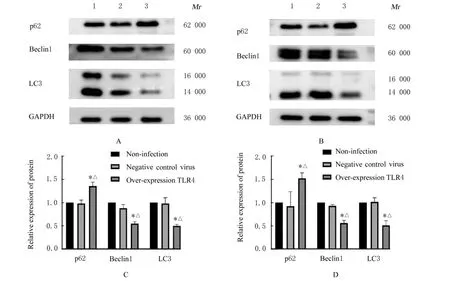
图6 各组BGC-823细胞和SGC-7901细胞中自噬相关蛋白表达电泳图(A,B)和直条图(C,D)Fig.6 Electrophoregram(A,B)and histogram(C,D)of autophagy-related proteins in BGC-823 cells and SGC-7901 cells in various groups
表2 CCK-8法检测各组SGC-7901细胞增殖活性Tab.2 Proliferation activities of SGC-7901 cells in various groups detected by CCK-8 assay (n=3,±s)

表2 CCK-8法检测各组SGC-7901细胞增殖活性Tab.2 Proliferation activities of SGC-7901 cells in various groups detected by CCK-8 assay (n=3,±s)
*P<0.05,**P<0.01 compared with non-infection group;△P<0.05,△△P<0.01 compared with negative control virus group.
Group Non-infection Negative control virus Over-expreession TLR4 Proliferation activity of SGC-7901 cells(t/h)24 0.38±0.08 0.37±0.07 0.45±0.10 48 0.50±0.07 0.49±0.08 0.67±0.17 72 0.61±0.09 0.60±0.09 0.86±0.30 96 0.71±0.10 0.73±0.09 1.17±0.21*△120 0.80±0.04 0.79±0.04 1.33±0.15**△△
3 讨 论
研究[12-13]显示:TLR4在胃癌组织和细胞中表达上调,在正常胃黏膜中低表达。本研究选择正常胃黏膜上皮GES-1细胞及胃癌SGC-7901、BGC-823、MGC-803和HGC-27细胞作为研究对象,证实TLR4基因在胃癌细胞中高表达。采用慢病毒过表达TLR4基因的BGC-823细胞和SGC-7901细胞,感染96和120 h时与未感染组比较,阴性对照病毒组BGC-823细胞和SGC-7901细胞增殖活性差异无统计学意义,而过表达TLR4组细胞增殖活性明显升高,证实过表达TLR4基因能增强胃癌细胞的增殖能力。
细胞凋亡也被称为Ⅰ型程序性细胞死亡,自噬则被称为Ⅱ型程序性细胞死亡。细胞自噬是指细胞在外界环境因素的影响下,细胞利用溶酶体降解自身受损、变性或衰老的大分子物质和细胞器的自我消化过程[14]。生存信号刺激包括PI3K、Akt和mTOR信号途径,能够抑制自噬;当生存信号不足时,PI3K信号途径减弱,同时还伴随自噬或凋亡减少[15]。微管相关蛋白1轻链3-Ⅱ(microtubuleassociated protein 1 light chain 3-Ⅱ,LC3-Ⅱ)是自噬体的标准标记物,通过细胞溶质微管相关蛋白1轻 链3-Ⅰ(microtubule-associated protein 1 light chain 3-Ⅰ,LC3-Ⅰ)与新生自噬体表面的磷脂酰乙 醇 胺(phosphatidylethanolamine,PE)结 合 产生;p62是一种泛素结合蛋白和多功能衔接蛋白,具有调节细胞事件的多种功能;Beclin1是酵母Atg6的哺乳动物直系同源体,也是自噬机制的核心成分,通过激活Vps34在自噬调节中起着核心作用[16-18]。研究[19-20]显示:TLR4基因能抑制细胞自噬,并损害小胶质细胞的吞噬能力。TLR4能激活细胞自噬,从而促进肺癌细胞的迁移和侵袭,也能参与激活自噬途径并改变结直肠癌的化疗反应[21-22]。本研究结果显示:与未感染组和阴性对照病毒组比较,过表达TLR4组BGC-823细胞和SGC-790细胞中p62蛋白表达水平明显升高,LC3和Beclin1蛋白表达水平明显降低,p-PI3K、p-Akt和p-mTOR蛋白表达水平明显升高,提示过表达TLR4基因可能通过调控PI3K/Akt/mTOR细胞信号通路及自噬相关蛋白LC3、Beclin1和p62的表达明显抑制胃癌细胞的自噬。
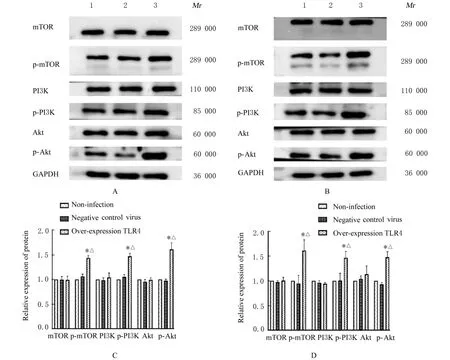
图7 各组BGC-823细胞和SGC-7901细胞中PI3K/Akt/mTOR信号通路相关蛋白表达电泳图(A,B)和直条图(C,D)Fig.7 Electrophoregram(A,B)and histogram(C,D)of PI3K/Akt/mTOR signaling pathway-related proteins in BGC-823 cells and SGC-7901 cells in various groups
综上所述,TLR4基因在胃癌细胞上高表达,过表达TLR4基因可以促进胃癌细胞增殖,通过调控PI3K/Akt/mTOR信号通路及自噬相关蛋白Beclin1、LC3和p62的表达,明显抑制胃癌细胞自噬。本研究证实TLR4基因在胃癌中起着关键作用,提示其可能为胃癌治疗提供新的治疗靶点。
