北五味子多糖对人膀胱癌T24细胞增殖和凋亡的影响及其机制
2022-10-18孙红霞刘春旭安学俊崔光华王靖宇佟双喜杨晓秋
孙红霞,刘春旭,安学俊,崔光华,王靖宇,佟双喜,杨晓秋
(1.北华大学药学院药理教研室 吉林 吉林 132013;2.北华大学附属医院泌尿外科,吉林 吉林 132011)
五味子为木兰科多年生落叶木质藤本植物,是我国常用的一种传统中药。北五味子多糖(Schisandra chinensispolysaccharide,SCP)提取自五味子,具有多种生物学活性,其主要成分为鼠李糖、阿拉伯糖、木糖和甘露糖等。SCP具有保肝、增强免疫、抗氧化、抗衰老和抗肿瘤等作用[1-3],特别是其抗肿瘤作用近年来受到广泛关注。有关SCP对膀胱癌细胞生长抑制的作用目前国内外尚未见报道,因此本研究探讨SCP对体外生长膀胱癌T24细胞增殖和凋亡的作用及其对磷酸酶和张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)、磷脂酰肌 醇-3激酶(phosphatidylinositol-3 kinase,PI3K)和蛋白激酶B(protein kinase B,PKB,即Akt)信号通路相关蛋白表达的影响,阐明其作用的初步分子机制,为揭示SCP抗膀胱癌作用提供药理学理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人膀胱癌T24细胞株购自上海慧颖生物科技公司。SCP由吉林省五味子开发及产业化科学研究中心制备,通过超临界CO2流体萃取,将北五味子中水溶性成分和脂溶性成分分离,利用超声波产生的强烈振动、高加速度、强烈空化效应及搅拌作用,经超声波预处理40 min后进行浸提,采用酶法与三氯乙酸结合脱蛋白得北五味子粗多糖,提取率为77.6%,纯度可达50%以上。细胞培养基DMEM和胰蛋白酶购自美国Gibco公司,胎牛血清购自美国Hyclone公司,β-actin、PTEN、磷 酸 化PI3K(phosphorylated PI3K,p-PI3K)、Akt、磷酸化Akt(phosphorylated Akt,p-Akt)、鼠抗人一抗和兔抗鼠二抗均购自美国Santa Cruz公司,MTT购自美国Sigma公司,AnnexinⅤ-FITC流式细胞凋亡检测试剂盒购自武汉伊莱瑞特生物科技公司,其余试剂均为国产分析纯。CO2培养箱购自上海赛默飞世尔公司,酶标仪购自深圳迈瑞生物公司,高速冷冻离心机购自上海土森视觉科技有限公司,凝胶成像系统购自美国美谷生物科技公司,倒置显微镜购自日本Olympus公司。
1.2 细胞培养和分组人膀胱癌T24细胞株置于含10%胎牛血清和1%青-链霉素DMEM培养液中,37℃、5% CO2培养箱中培养。实验使用细胞均为接种后24 h处于对数生长期的细胞。实验分为对 照 组(0 mg·L-1SCP)及50、100和200 mg·L-1SCP组。取对数生长期的T24细胞以3×104mL-1的密度接种于培养瓶中培养,24 h后分别加入0、50、100和200 mg·L-1SCP,作用48 h后,胰酶消化离心,细胞悬浮于磷酸盐缓冲液(phosphate buffered saline,PBS)中备用。
1.3 MTT法检测各组细胞增殖抑制率取对数生长期膀胱癌T24细胞,以4×103/孔接种于96孔细胞培养板,培养24 h后,分别加入0、50、100和200 mg·L-1SCP,培养48 h后,每孔加入5 mg·L-1MTT 20 μL,孵育4 h,弃上清液,每孔加二甲基亚枫(dimethyl sulfoxide,DMSO)150 μ L,避光振荡10 min。采用酶联免疫检测仪于490 nm波长处检测各组细胞的吸光度(A)值,计算各组细胞增殖抑制率。细胞增殖抑制率=[1-(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)]×100%。
1.4 Hoechst 33258荧光染色法检测各组细胞凋亡情况将对数生长期T24细胞按3×105/孔接种于6孔细胞培养板,细胞贴壁融合至60%~70%,分别加入0、50、100和200 mg·L-1SCP继续培养48 h,吸尽孔内培养基,加入0.5 mL固定液,10 min后去固定液,PBS缓冲液洗涤2次,0.5 mL Hoechst 33258染色液避光染色5 min。于倒置荧光显微镜下观察细胞核形态表现(激发波长350 nm,发射波长460 nm)和各组细胞凋亡情况。实验重复3次。
1.5 AnnexinⅤ-FITC/碘化丙啶(propidium iodide,PI)双染法检测各组细胞凋亡率各组T24细胞经SCP处理48 h后,0.25%胰酶消化,收集细胞。PBS缓冲液洗涤3次,加入100 μL结合缓冲液悬液制备单细胞混悬液。加入5 μL AnnexinⅤ-FITC和5 μL PI染液混匀。室温下避光反应10 min。采用流式细胞仪检测各组细胞凋亡率。实验重复3次。
1.6 流式细胞术检测各组不同细胞周期T24细胞百分率和凋亡率SCP作用24 h后,收集各组T24细 胞 悬 液,1 000 r·min-1离 心5 min,弃 上 清 液。PBS洗涤,细胞沉淀采用预冷70 %乙醇-20℃固定过夜。取固定后细胞,PBS缓冲液洗涤2次悬浮,加入50 mg·L-1核糖核酸酶A 36℃水浴30 min,800 μL PI染液至终浓度为50 mg·L-1,摇匀后4℃避光静置30 min,200目尼龙网过滤。采用流式细胞仪检测各组不同细胞周期T24细胞百分率和凋亡率。
1.7 Western bloting法检测各组细胞中PTEN、p-PI3K、Akt和p-Akt蛋白表达水平SCP作用48 h后收集各组T24细胞,提取各组细胞总蛋白,采用BCA法测定总蛋白含量。分别取各组40 μg总蛋白上样,将蛋白转移至PVDF膜上,5 %脱脂奶粉封闭后,加入适量稀释PTEN(l∶1 000)、p-PI3K(l∶1 000)、Akt(l∶1 000)、p-Akt(1∶1 000)和β-actin(l∶1 000)一抗,4℃孵育过夜,加入二抗(1∶500),室温下摇荡孵育2 h,采用ECL发光液发光,充分反应后,采用Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin蛋白条带灰度值。实验重复3次。
1.8 统计学分析采用SPSS 23.0统计软件进行统计学分析。各组T24细胞增殖抑制率,细胞凋亡率,不同细胞周期细胞百分率,各组细胞中PTEN、p-PI3K、p-Akt和Akt蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较若方差齐采用LSD-t法,若方差不齐则采用Dunnett’s T3单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组T24细胞增殖抑制率与对照组比较,50、100和200 mg·L-1SCP组细胞增殖抑制率明显升高(P<0.05或P<0.01)。见表1。
表1 各组T24细胞增殖抑制率Tab.1 Inhibitory rates of proliferation of T24 cells in various groups (n=7,±s,η/%)

表1 各组T24细胞增殖抑制率Tab.1 Inhibitory rates of proliferation of T24 cells in various groups (n=7,±s,η/%)
*P<0.05,**P<0.01 compared with control group.
Group Control SCP(mg·L-1)50 100 200 Inhibitory rate of proliferation 0 18.69±4.32*39.13±5.36**64.76±8.45**
2.2 各组T24细胞凋亡情况荧光显微镜下观察结果显示:不同剂量SCP组出现细胞核内染色质的固缩和断裂,呈现出典型的细胞凋亡表现形态。与对照组比较,随SCP浓度升高,50、100和200 mg·L-1SCP组凋亡细胞数明显增多。见图1。

图1 各组T24细胞凋亡情况(Hoechst 33258荧光,×400)Fig.1 Apoptosis of T24 cells in various groups(Hoechst 33258 fluorescence,×400)
2.3 各组T24细胞凋亡率AnnexinⅤ-FITC/PI双染法检测结果显示:与对照组比较,不同剂量SCP组T24细胞凋亡率明显升高(P<0.05或P<0.01)。见图2和表2。
表2 各组T24细胞凋亡率Tab.2 Apoptotic rates of T24 cells in various groups(n=7,±s,η/%)
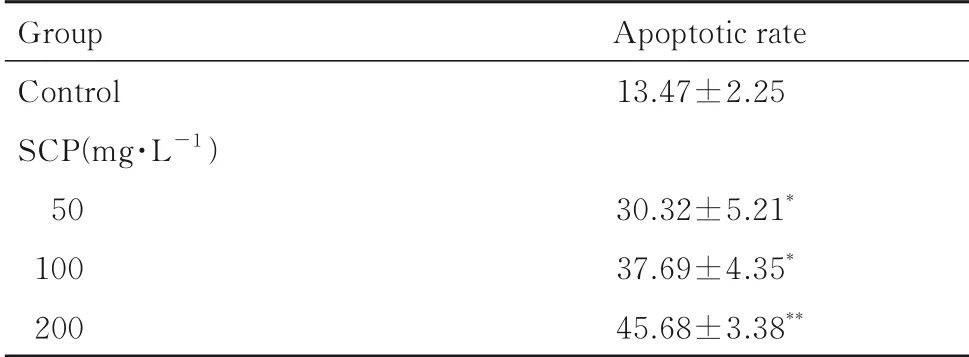
表2 各组T24细胞凋亡率Tab.2 Apoptotic rates of T24 cells in various groups(n=7,±s,η/%)
*P<0.05,**P<0.01 compared with control group.
Group Control SCP(mg·L-1)50 100 200 Apoptotic rate 13.47±2.25 30.32±5.21*37.69±4.35*45.68±3.38**

图2 AnnexinⅤ-FITC/PI双染法检测各组T24细胞凋亡率Fig.2 Apoptotic rates of T24 cells in various groups detected by AnnexinⅤ-FITC/PI double staining method
2.4 各组不同细胞周期T24细胞百分率和凋亡率与对照组比较,50、100和200 mg·L-1SCP组G0/Gl期T24细胞百分率明显升高(P<0.05或P<0.01),100和200 mg·L-1SCP组S期 和G2/M期T24细胞百分率明显降低(P<0.01)。与对照组比较,50、100和200 mg·L-1SCP组T24细胞凋亡率明显升高(P<0.01)。见图3和表3。
表3 各组不同细胞周期T24细胞百分率和凋亡率Tab.3 Percentages of T24 cells at different cell cycles and apoptotic rates in various groups (n=7,±s,η/%)

表3 各组不同细胞周期T24细胞百分率和凋亡率Tab.3 Percentages of T24 cells at different cell cycles and apoptotic rates in various groups (n=7,±s,η/%)
*P<0.05,**P<0.01 compared with control group.
Group Control SCP(mg·L-1)50 100 200 Percentage of T24 cells G0/G1 27.43±2.56 38.62±4.75*65.39±4.21**80.71±6.57**S 48.54±3.82 40.21±4.75 30.77±2.85**16.91±2.96**G2/M 24.03±1.98 21.17±2.59 3.84±0.45**2.38±0.81**Apoptotic rate 5.87±0.97 28.73±4.56**38.35±5.73**60.52±7.48**

图3 流式细胞术检测各组不同细胞周期T24细胞百分率Fig.3 Percentages of T24 cells at different cell cycles in various groups detected by flow cytometry
2.5 各组T24细胞中PTEN和p-PI3K蛋白表达水平及p-Akt/Akt比值与对照组比较,50、100和200 mg·L-1SCP组T24细胞中PTEN蛋白表达水平明显升高(P<0.05或P<0.01),p-PI3K蛋白表达水平和p-Akt/Akt比值明显降低(P<0.05或P<0.01)。见图4。

图4 各组T24细胞中PTEN、p-PI3K、p-Akt和Akt和蛋白表达电泳图(A)和直条图(B-D)Fig.4 Electrophoregram(A)and histogram(B-D)of expressions of PTEN,p-PI3K,p-Akt,and Akt proteins in T24 cells in various groups
3 讨 论
膀胱癌是泌尿系统肿瘤中位列第一的恶性肿瘤,临床上主要治疗方法为经尿道膀胱肿瘤电切术(transurethral resection of bladder tumour,TUR-BT),但术后5年复发率高达60%~70%,且约25%的患者复发后会进展为浸润性膀胱癌[4-6]。为防止患者术后复发辅以膀胱灌注的免疫抑制剂或化疗药物均存在不同程度的全身或局部不良反应,且仍有约20%的患者经膀胱灌注治疗后肿瘤仍复发[7-9]。而根治性膀胱切除术联合尿流改道术后仍有约50%的患者可能出现转移,且对转移性膀胱癌患者采用的化疗方案疗效无法持久,患者5年生存率仅为20%~40%。针对目前膀胱癌灌注药物及化疗药物疗效的不稳定性及其不良反应,寻找安全有效、来源于天然产物的抗肿瘤药物是近年来肿瘤药物研发中的热点。
SCP是北五味子的活性成分之一,随着对SCP功能的不断研究,其抗肿瘤的作用成为研究热点,但有关SCP对膀胱癌作用的研究较少。本研究检测不同剂量SCP对人膀胱癌T24细胞增殖和凋亡的作用,结果显示:SCP能提高T24细胞增殖抑制率,抑制人膀胱癌T24细胞增殖,同时促进其凋亡,使S期细胞百分率降低,G0/G1期细胞百分率升高,G2/M期细胞百分率降低,表明SCP具有阻止T24细胞增殖的作用,使T24细胞阻滞于G0/G1期,从而诱导细胞凋亡。本研究中AnnexinⅤ-FITC/PI双染法和Hoechst 33248荧光染色法检测结果显示:SCP能够诱导T24细胞凋亡,与流式细胞术检测结果一致。
Akt活化能阻止人膀胱癌T24细胞凋亡,而使用PI3K抑制剂LY 294002使Akt活性丧失,从而导致膀胱癌细胞凋亡[10-12]。PI3K抑制剂LY 294002可明显抑制肿瘤细胞的生长[13-15]。研究[16]显示:PI3K/Akt通路在膀胱癌细胞的增殖和凋亡过程中起到重要的调节作用。本研究结果显示:SCP能抑制PI3K/Akt通路相关蛋白的表达,且随着SCP剂量升高,该抑制作用明显增强,提示SCP抑制膀胱癌细胞增殖和促进其凋亡的作用可能是通过对PI3K/Akt通路的负反馈调节实现的[17]。
PTEN是一种新发现具有双特异磷酸酶活性的抑癌基因,也是继p53之后另一种较为广泛地与肿瘤发生关系密切的基因,PTEN蛋白在细胞生长、细胞凋亡、细胞黏附、细胞迁移和浸润等方面具有重要作用[18-20]。PTEN参与化学通路传导,将信号传导给细胞,使细胞停止分裂并进入程序性死亡(即细胞凋亡),上述功能可以阻止非控制性细胞生长进而抑制肿瘤形成。PTEN表达下调间接刺激PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)活性从而促进肿瘤形成[18,21-22]。研究[23]显示:男 性膀胱癌的发展与抑癌基因PTEN缺失引起细胞内PI3K/Akt/mTOR信号通路的异常激活有关。研究[24-27]显示:PI3K/Akt信号通路与膀胱癌的发生有密切关联,该信号通路的激活是发生癌症的主要原因,抑癌基因PTEN是负性调控基因,其表达下调引起PI3K和Akt激活,当PTEN基因缺失或突变时,PTEN无法有效拮抗PI3K/Akt/mTOR信号通路作用,致使该通路功能异常,从而诱发癌症。
本研究探讨SCP对人膀胱癌T24细胞中PTEN及p-PI3K和Akt蛋 白表达的影 响,SCP能明显上调人膀胱癌T24细胞中PTEN蛋白表达,下调p-PI3K和p-Akt蛋白表达,且具有剂量依赖性,SCP对PI3K/Akt信号通路的抑制作用可能与其对PTEN的诱导效应有关,但其是否通过调控PTEN/PI3K/Akt信号通路发挥作用有待进一步验证。
综上所述,SCP可能通过调控PTEN和PI3K/Akt信号通路相关蛋白表达,即上调PTEN蛋白表达,抑制PI3K/Akt蛋白激活,进而调控细胞周期,抑制细胞增殖,促进细胞凋亡,抑制癌症发生。
