沉默信息调节因子1对慢性牙周炎模型大鼠肾损伤的影响
2022-10-18刘笑梦刘歆婵于维先
李 鑫,丁 旭,刘笑梦,刘歆婵,武 洲,于维先,4
(1.吉林大学口腔医院牙周科,吉林 长春 130021;2.吉林大学口腔医院种植科,吉林 长春 130021;3.日本九州大学齿学研究院,日本 福冈 812-8582;4.吉林省牙发育及颌骨重塑与再生重点实验室,吉林 长春 130021)
牙周炎是发生于牙周组织的慢性炎症性疾病,主要表现为牙周结缔组织破坏和牙槽骨吸收,是成人牙齿缺失的主要原因。研究[1]显示:牙周炎不仅损害局部牙周组织,也会严重威胁人类健康,导致非酒精性脂肪肝和阿尔兹海默症等疾病发生。近年来,牙周炎与肾脏疾病之间的关系引起了学术界的广泛关注[2-6]。研究[7]显示:牙周炎患者慢性肾病(chronic kidney disease,CKD)的患病率是牙周健康者的1.73倍,而局部牙周治疗可有效减缓CKD进程[3]。因此,探讨慢性牙周炎诱发肾脏损伤的相关机制,寻找防治靶点是目前研究的关键问题。沉默信息调节因子1(silencing information regulator 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖性蛋白质去乙酰基酶,在能量稳态和细胞应激中起关键作用,其失调与癌症、糖尿病和心脏疾病等全身 疾 病 有 关[8]。周 丰 等[9]研 究 发 现:SIRT1可 调节牙周炎中氧化应激和炎症通路,从而调控牙周炎的发生发展。采用SIRT1激活剂白藜芦醇可有效降低牙周炎大鼠牙周组织中氧化应激水平,上调SIRT1表达,从而延缓牙周炎进展[10]。此外,SIRT1的抗氧化功能有利于减轻糖尿病肾病小鼠肾脏纤维化,改善肾组织形态[11]。然而,有关SIRT1对慢性牙周炎模型大鼠肾损伤作用的研究目前国内外尚未见报道。本研究旨在探讨SIRT1在慢性牙周炎大鼠肾损伤中的作用,为牙周炎大鼠肾损伤的防治提供实验依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF级Wistar雄性大鼠20只,8周龄,体质量200~220 g,饲养于吉林大学动物实验中心,动物生产许可证号:SCXK(辽)2015-0001,购自辽宁长生生物技术股份有限公司。大鼠在温度22℃~25℃、相对湿度55%~70%和12 h昼夜循环环境 中 适 应 性 喂 养1周,自由饮水及进食。动物实验经吉林大学口腔医院医学伦理委员会批准(2019/64)。过碘酸雪夫(periodic acid-schiff stain,PAS)染 色 液 试 剂 盒(北京酷莱博科技有限公司),SYBR Prime-ScriptTMRT-PCR Kit试剂盒(日本TaKaRa公司),SIRT1抗体(美国Proteintech公司),过氧化物酶体增殖物激活受体γ辅助因子1α(peroxisome-proliferatoractivated receptor γ coactivator-1α,PGC-1α)抗体、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抗体和核因子κB(nuclear factor-kappa B,NF-κB)p65抗体(英国Abcam公司),总抗氧化状态(total antioxidative status,TAS)试剂盒(武汉伊莱瑞特生物科技有限公司),锰-超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒和丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程研究所)。酶标检测仪(美国Bio-TEK公司),实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)扩 增 仪MX3005P(美国AgILent公司)。
1.2 实验动物分组和造模20只大鼠随机分为对照组和牙周炎组,每组10只。按照参考文献[12]和本课题组前期研究[13]中的方法造模。牙周炎组:直径0.2 mm正畸丝结扎大鼠双侧上颌第一磨牙颈部,持续8周;对照组大鼠不作处理。采用牙周临床指标检查及牙槽骨吸收水平评价牙周炎模型是否成功建立[13]。造模8周后对大鼠进行安乐死,取上颌骨、血清和肾组织行后续实验。
1.3 2组大鼠牙周组织临床指标检查2 mL·kg-12%戊巴比妥钠麻醉后,肉眼观察2组大鼠牙龈颜色、形状和质地,采用相机拍摄各组大鼠上颌第一磨牙及其牙周组织。记录牙龈出血指数(bleeding index,BI)、牙周探诊深度(probing depth,PD)和牙齿松动度(tooth mobility,TM)。采用Mazza法记录BI:0=牙龈健康,无炎症及出血;1=牙龈颜色有炎症性改变,探诊不出血;2=探诊后有点状出血;3=探诊出血沿牙龈缘扩散;4=出血流满并溢出龈沟;5=自动出血。采用牙周探针于大鼠上颌第一磨牙颊腭侧近中、中央和远中6个点测量牙周袋深度,取平均值记录PD。用镊子检查2组大鼠上颌第一磨牙是否松动,记录TM:<Ⅰ度:生理活动度;Ⅰ度松动:颊腭向松动;Ⅱ度松动:颊腭向及近远中向松动;Ⅲ度松动:颊腭向、近远中向和垂直向均松动。以上结果均由同一人检查并记录。
1.4 苏木素-伊红(hematoxylin-eosin,HE)染色观察2组大鼠牙周组织病理形态表现处死大鼠后,取上颌骨置于10%中性甲醛固定液中固定24~48 h,经10%乙二胺四乙酸脱钙3个月后,乙醇梯度脱水,二甲苯溶液透明,浸蜡,包埋,组织切片(5 μm);二甲苯脱蜡后,梯度乙醇水化,苏木素10 min;冲洗,1%盐酸酒精分化,氨水返蓝,1%伊红5 min;染色后,梯度乙醇脱水,二甲苯透明,最后中性树胶封片。封片后显微镜下观察2组大鼠牙周组织结合上皮完整性、附着丧失水平和牙槽骨吸收情况。
1.5 微型计算机断层成像(micro computed tomography,Micro-CT)评价2组大鼠牙槽骨吸收情况Micro-CT扫描大鼠上颌骨,扫描参数设置为70 kV,200 mA,300 ms。采用IPL图像处理软件重建上颌骨三维图像,Image J软件分别测量近远中釉牙骨质界(cement-enamel junction,CEJ)到牙槽嵴顶(alveolar bone crest,BC)的距离,单位为mm,并取平均值,判断2组大鼠牙槽骨吸收情况。
1.6 HE染色观察2组大鼠肾组织病理形态表现处死大鼠后,取部分肾组织按“1.4”中步骤进行包埋、切片和染色。显微镜下观察2组大鼠肾组织中肾小球和肾小管结构变化。
1.7 PAS染色观察2组大鼠肾组织病理形态表现5 μm肾组织切片脱蜡至水,氧化剂室温孵育8 min,水洗后,室温阴暗处Schiff试剂浸染15 min,偏重亚硫酸钠分化,自来水冲洗10 min,苏木素复染,盐酸分化,返蓝,常规脱水,透明,封片。观察2组大鼠肾组织中肾小球和肾小管结构完整性。
1.8 生化试剂盒检测2组大鼠24 h尿蛋白、尿肌酐(creatinine,Cr)及 血清 中Cr、尿 素氮(blood urea nitrogen,BUN)和白蛋白(albumin,Alb)水平建模8周后,处死前将大鼠置于代谢笼中收集24 h尿液,生化试剂盒检测2组大鼠尿液中总蛋白和Cr水平;麻醉后腹主动脉取血,4℃、3 000 g离心15 min,取上清,生化试剂盒检测2组大鼠血清中Cr、BUN和Alb水平。
1.9 生化试剂盒检测2组大鼠肾组织中TAS、Mn-SOD、GSH和MDA水平取1 g大鼠肾组织,加入9 mL生理盐水,置于冰上匀浆,离心后取上清,采用生化试剂盒检测2组大鼠肾组织中TAS、Mn-SOD、GSH和MDA水平。
1.10 Western blotting法检测2组大鼠肾组织中TNF-α和NF-κB p65蛋白表达水平取大鼠新鲜肾组织,与RIPA裂解液混合后匀浆,4℃离心后取上清。BCA试剂盒测定蛋白浓度,100℃煮沸5 min使蛋白变性。每孔20 μg蛋白等量上样,聚丙烯酰胺凝胶电泳后湿转法将蛋白转至聚偏二氟乙烯膜上,5%脱脂牛奶封闭1 h,TNF-α抗体(1∶1 000)、NF-κ B p65抗 体(1∶1 000)和β-actin抗 体(1∶10 000)4℃孵育过夜,二抗室温1 h,电化学发 光法(electrochemiluminescence,ECL)显色。Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin蛋白条带灰度值。
1.11 免疫组织化学法检测2组大鼠肾组织中SIRT1和PGC-1α蛋白表达水平肾组织切片二甲苯脱蜡后,置于梯度乙醇中水化,柠檬酸钠抗原修复,山羊血清封闭后,SIRT1(1∶250)、PGC-1α(1∶25)抗体4℃孵育过夜,按照兔超敏二步法免疫组织化学试剂盒说明书操作,DAB显色,流水终止反应,苏木素复染,盐酸分化,返蓝,常规脱水透明,最后中性树胶封片,显微镜下观察。免疫组织化学结果半定量方法,采用Image J软件分析肾组织棕色部分累计光密度(integrated optical density,IOD)值和面积,计算平均光密度值(averaged optical density,AOD)。AOD=IOD/面积,以AOD值代表目的蛋白表达水平。
1.12 RT-qPCR法检测2组大鼠肾组织中SIRT1和PGC-1α mRNA表达水平取新鲜肾组织,液氮研磨,TRIzol试剂提取组织中总RNA,按照逆转录试剂盒说明书操作将提取的RNA逆转录为cDNA,采用SYBR Prime-ScriptTMRT-PCR Kit试剂盒进行RT-qPCR反应,以β-actin为内参。引物序列见表1。反应条件:95℃预变性30 s;95℃变性5 s;60℃退火30 s,共40个循环。每个样本设置3个复孔,取平均值,采用2-ΔΔCt法计算目的mRNA表达水平。
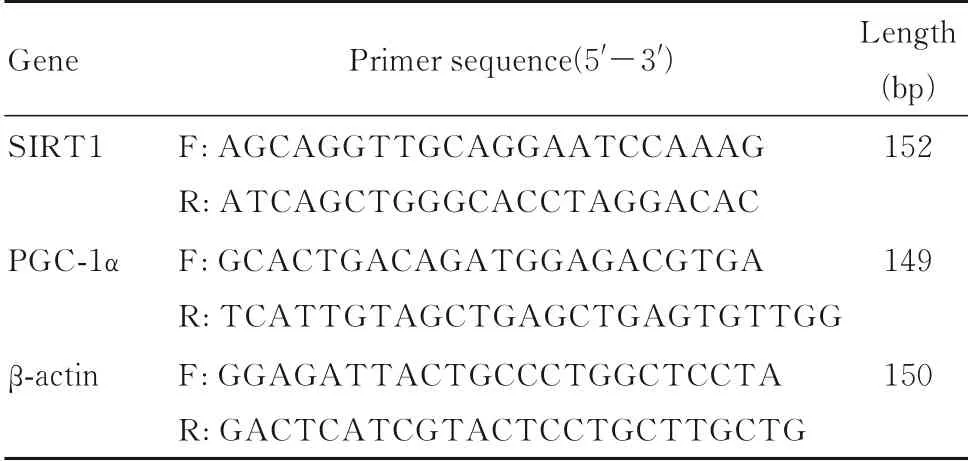
表1 PCR引物序列Tab.1 Primer sequences of PCR
1.13 统计学分析采用SPSS 25.0统计软件进行统计学分析。各组大鼠PD,尿和血清中生化指标水平,肾组织中氧化应激指标水平,肾组织中TNF-α和NF-κB p65蛋 白 表 达 水 平,肾 组 织 中SIRT1和PGC-1α mRNA和蛋白表达水平均符合正态分布,以±s表示,2组间样本均数比较采用t检验;大鼠牙周BI和TM组间比较采用曼-惠特尼U检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 2组大鼠牙周组织临床指标对照组大鼠未探及深牙周袋,探诊无出血,牙齿无松动;牙周炎组大鼠可探及深牙周袋,探诊易出血,牙齿不同程度松动。见表2。

表2 2组大鼠牙周组织临床指标Tab.2 Clinical indexes of peridontium of rats in two groups(n=10)
2.2 2组大鼠牙周组织病理形态表现和牙槽骨吸收情况肉眼观察:对照组大鼠牙龈呈粉红色,龈缘紧贴牙面,质地韧;牙周炎组大鼠牙龈肿胀,质地松软。HE染色结果显示:对照组大鼠牙周组织结构完整、清晰,无附着丧失;牙周炎组大鼠可见深牙周袋及附着丧失,牙槽骨高度明显降低。Micro-CT结果显示:与对照组比较,牙周炎组大鼠牙槽骨吸收明显。对照组和牙周炎组大鼠CEJBC距离分别为(0.835 7±0.057 9)和(1.513 0±0.044 6)mm。见图1。

图1 2组大鼠牙周组织病理形态表现和牙槽骨吸收情况Fig.1 Pathomorphology of peridontium tissue and alvelar bone resorption of rats in two groups
2.3 2组大鼠肾组织病理形态表现HE染色结果显示:对照组大鼠肾组织结构完整清晰,未见病理损伤;牙周炎组大鼠肾组织形态紊乱,肾小囊腔扩张,少数近曲肾小管上皮细胞脱落。PAS染色结果显示:对照组大鼠肾小球基底膜薄而清晰,肾小管刷状缘完整;牙周炎组大鼠肾小球基底膜轻度增厚,肾小管刷缘被破坏。见图2和3。
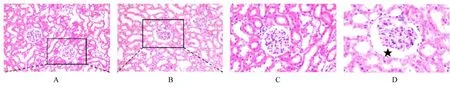
图2 HE染色观察2组大鼠肾组织病理形态表现Fig.2 Pathomorphology of kidney tissue of rats in two groups observed by HE staining
2.4 2组大鼠肾脏功能指标与对照组比较,牙周炎组大鼠24 h尿蛋白和Cr及血清中BUN、Alb和Cr水平升高,但差异无统计学意义(P>0.05)。见表3。
表3 2组大鼠肾脏功能指标Tab.3 Renal function indexes of rats in two groups (n=3,±s)

表3 2组大鼠肾脏功能指标Tab.3 Renal function indexes of rats in two groups (n=3,±s)
Group Control Periodontitis Alb in serum[ρB/(g·L-1)]20.31±0.41 21.35±0.11 Cr in serum[mB/(μmol·L-1)]28.68±0.98 30.54±1.22 BUN in serum[mB/(mmol·L-1)]5.29±0.09 5.65±0.14 Urine protein[ρB/(mg·L-1)]1 034.00±36.83 1 087.00±18.86 Cr in urine[mB/(μmol·L-1)]910.80±87.33 1 140.00±76.76
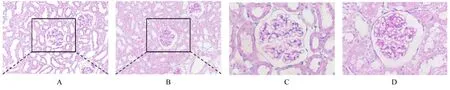
图3 PAS染色观察2组大鼠肾组织病理形态表现Fig 3 Pathomorphology of kidney tissue of rats in two groups observed by PAS staining
2.5 2组大鼠肾组织中氧化应激水平与对照组比较,牙周炎组大鼠肾组织中TAS、Mn-SOD和GSH水平降低(P<0.01),MDA水平升高(P<0.01)。见表4。
表4 2组大鼠肾组织中氧化应激水平Tab.4 Levels of oxidative stress in kidney tissue of rats in two groups (n=3,±s)
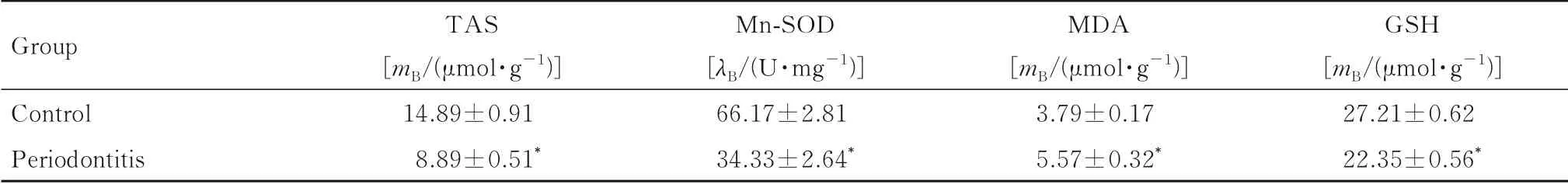
表4 2组大鼠肾组织中氧化应激水平Tab.4 Levels of oxidative stress in kidney tissue of rats in two groups (n=3,±s)
*P<0.01 vs control group.
Group Control Periodontitis TAS[mB/(μmol·g-1)]14.89±0.91 8.89±0.51*Mn-SOD[λB/(U·mg-1)]66.17±2.81 34.33±2.64*MDA[mB/(μmol·g-1)]3.79±0.17 5.57±0.32*GSH[mB/(μmol·g-1)]27.21±0.62 22.35±0.56*
2.6 2组大鼠肾组织中TNF-α和NF-κB p65蛋白表达水平Western blotting检测结果显示:与对照组比较,牙周炎组大鼠肾组织中TNF-α和NF-κB p65蛋白表 达水平升高(P<0.05或P<0.01)。见图4。

图4 2组大鼠肾组织中TNF-α和NF-κB p65蛋白表达电泳图(A)和直条图(B,C)Fig.4 Electrophoregram(A)and histogram(B,C)of expressions of TNF-α and NF-κB p65 proteins in kidney tissue of rats in two groups
2.7 2组大鼠肾组织中SIRT1和PGC-1α蛋白表达水平SIRT1和PGC-1α蛋白主要表达于肾小管上皮细胞中,免疫组织化学染色阳性信号表现为棕黄色。与对照组比较,牙周炎组大鼠肾组织中SIRT1和PGC-1α蛋 白 表 达 水 平 降 低(P<0.05)。见图5和6。
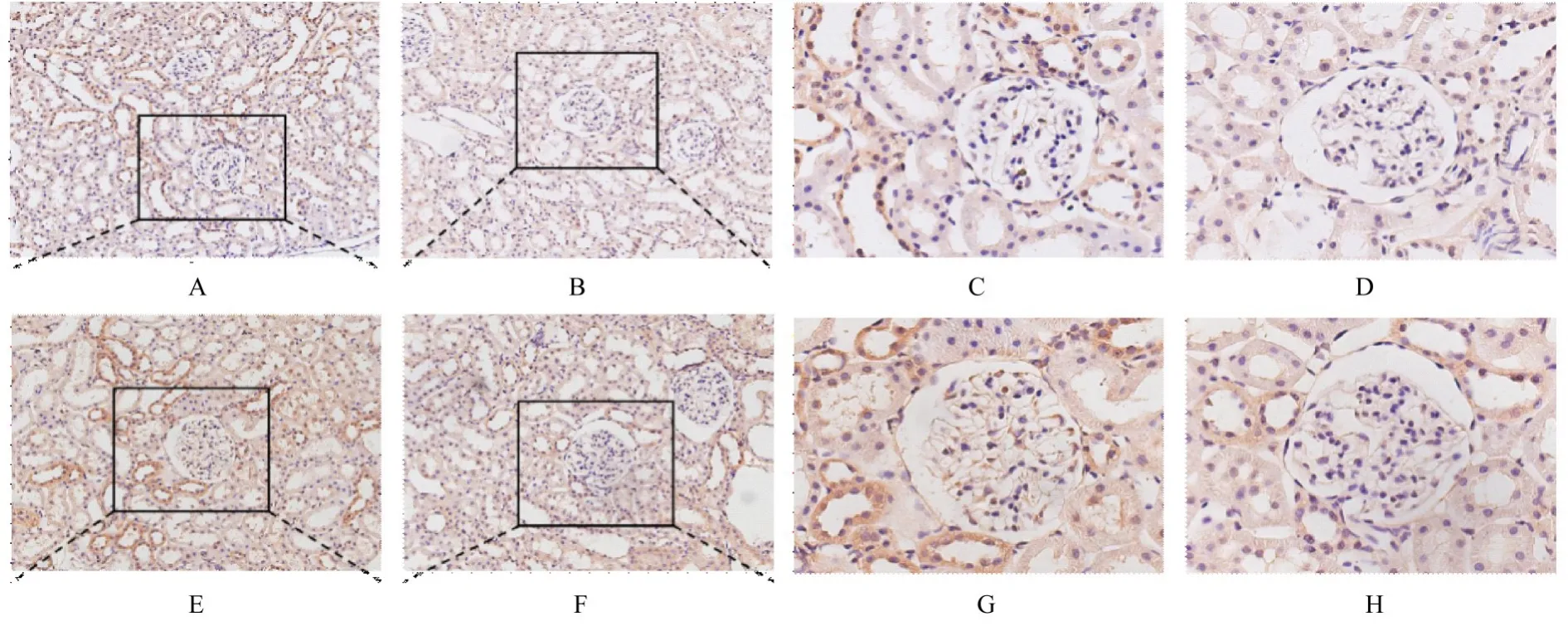
图5 免疫组织化学法检测2组大鼠肾组织SIRT1和PGC-1α蛋白表达情况Fig.5 Expressions of SIRT1 and PGC-1α proteins in kidney tissue of rats in two groups detected by immunohistochemistry
2.8 2组大鼠肾组织中SIRT1和PGC-1α mRNA表达水平RT-qPCR检测结果显示:与对照组比较,牙周炎组大鼠肾组织中SIRT1和PGC-1α mRNA表 达 水 平 降 低(P<0.05或P<0.01)。见表5。
表5 2组大鼠肾组织中SIRT1和PGC-1α mRNA表达水平Tab.5 Expression levels of SIRT1 and PGC-1α mRNA in kidney tissue of rats in two groups (n=3,±s)

表5 2组大鼠肾组织中SIRT1和PGC-1α mRNA表达水平Tab.5 Expression levels of SIRT1 and PGC-1α mRNA in kidney tissue of rats in two groups (n=3,±s)
*P<0.05,**P<0.01 vs control group.
Group Control Periodontitis SIRT1 1.01±0.09 0.50±0.02**PGC-1α 1.00±0.06 0.76±0.03*
3 讨 论
牙周炎是人类第六大常见的疾病,被认为是CKD的潜在危险因素[14-16]。KOSE等[17]发现:结扎诱导的慢性牙周炎大鼠肾组织出现肾小囊腔扩张、肾小管坏死和周围毛细血管充血等病理表现,GALENO等[18]进一步研究发现:去除结扎丝后牙周炎大鼠的肾损伤未见好转。本研究采用正畸丝结扎大鼠双侧上颌第一磨牙构建牙周炎模型,8周后大鼠牙周组织出现明显附着丧失和牙槽骨吸收等症状,表明成功建立大鼠牙周炎模型。本研究结果显示:慢性牙周炎大鼠肾组织结构改变,出现肾小囊腔扩张,肾小管上皮细胞脱落等形态表现。此外,与先前研究[17-19]结果相似,本研究中牙周炎大鼠肾脏功能指标变化差异无统计学意义,提示牙周炎可诱发大鼠肾组织损伤。
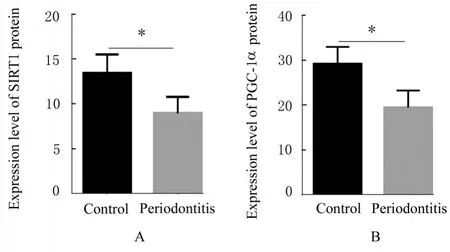
图6 2组大鼠肾组织中SIRT1和PGC-1α蛋白表达水平Fig.6 Expression levels of SIRT1 and PGC-1α proteins in kidney tissue of rats in two groups
研究[4]表明:牙周炎与CKD之间的关系可能是通过氧化应激介导的。牙周炎发生时,牙周组织中淋巴细胞、巨噬细胞和自然杀伤细胞等防御细胞释放活性氧(reactive oxygen species,ROS)以抵御牙周致病菌的入侵。而过量的ROS可通过血液循环到达肾脏,从而导致肾脏组织中氧化/抗氧化系统失衡,造成肾脏组织氧化损伤[19-20]。研究[10,19]证实:结扎诱导的牙周炎模型大鼠牙周组织中氧化应激水平升高。此外,与健康个体比较,牙周炎患者唾液、龈沟液和血浆中氧化应激标志物水平升高;而牙周治疗可将牙周炎患者氧化应激标志物水平降至与牙周健康个体相当[21-22]。FRANÇA等[19]证实:结扎诱导的慢性牙周炎可通过氧化应激引起大鼠肾组织损伤。本研究结果显示:与对照组比较,牙周炎组大鼠肾组织中氧化应激标志物水平升高。牙周炎是一种炎症性疾病,可导致全身炎症负荷增加,KOSE等[17]发现:牙周炎组大鼠肾组织中炎症因子TNF-α和白细胞介素1β(interleukin-1β,IL-1β)水平明显高于对照组。ERDEMLI等[23]发现:与对照组比较,牙周炎组大鼠血清中TNF-α、IL-1β及白细胞介素6(interleukin-6,IL-6)水 平 升高。本研究结果显示:与对照组比较,牙周炎组大鼠 肾 组 织 中TNF-α和NF-κB p65蛋 白 表 达 水 平 升高,提示牙周炎可引起大鼠肾组织中氧化应激和炎症水平升高。研究[24-26]报道:炎症反应过程中,TNF-α/NF-κB通路可促进线粒体产生过量ROS,引起氧化应激水平升高;另一方面,过量的ROS可激活NF-κB信号通路,增强炎症反应。因此氧化应激和炎症可形成恶性循环促进牙周炎大鼠肾损伤。
SIRT1是一种去乙酰基酶,可调控多种细胞生物活性,已被证实具有肾脏保护功能[8]。生理条件下,SIRT1能促进PGC-1α去乙酰化使其转录功能上调,维持线粒体稳态,降低细胞内氧化应激水平[27]。此 外,SIRT1还 可 通 过NF-κB去 乙 酰 化 降低炎症介质TNF-α水平,从而抑制炎症过程[8]。因此,SIRT1可能是打破氧化应激和炎症恶性循环,减轻牙周炎大鼠肾损伤的关键靶点。然而,氧化应激可以下调SIRT1表达,抑制SIRT1活性,使其无法发挥肾脏保护功能[27]。本研究结果显示:与对照组比较,牙周炎组大鼠肾组织中SIRT1及其下游因子PGC-1α mRNA和蛋白表达水平降低,提示在慢性牙周炎模型大鼠中,SIRT1表达下调,加重牙周炎大鼠肾组织损伤。
综上所述,本研究通过分析结扎诱导的慢性牙周炎大鼠肾组织形态表现、肾组织中氧化应激和SIRT1蛋白表达水平,证实SIRT1下调可加重慢性牙周炎大鼠肾损伤,提示SIRT1可作为牙周炎诱发肾损伤的防治靶点。但在大鼠慢性牙周炎模型中,牙周炎是否直接通过抑制SIRT1/PGC-1α信号通路诱导大鼠肾损伤尚需进一步研究。
