Toll样受体4接头分子对乳酸诱导巨噬细胞M2极化的促进作用及其机制
2022-10-18韩宛娜郗艳丽金连海
陈 为,沈 楠,韩宛娜,郗艳丽,任 旷,金连海,许 娜
(1.吉林医药学院生物医药双创转化实训平台,吉林 吉林 132013;2.吉林医药学院低压低氧环境与健康干预创新中心,吉林 吉林 132013;3.吉林医药学院毒理学教研室,吉林 吉林 132013)
在哺乳动物体内,乳酸是无氧氧化的代谢产物。作为糖类分解的主要代谢途径之一,无氧氧化的生理功能在于迅速提供能量,对许多生理和病理过程具有重要意义,如剧烈运动的肌纤维供能、伤口修复、炎症活跃期免疫细胞供能和癌细胞的快速增殖供能等[1]。此外,长期慢性炎性疾病也可引起体内氧利用不足而最终导致乳酸水平升高,包括慢性呼吸功能障碍、代谢性疾病和尿毒症等[2]。近年来,研究者以乳酸为核心,在化学、生物化学、分子生物学、临床医学和运动医学等领域开展了多项研究,形成了无氧阈和Warburg效应等多种学说[3]。随着能量代谢微环境和免疫调控机制研究的不断深入,乳酸在平衡内环境稳态、调节免疫反应、调控肌肉再生、神经发生和蛋白质修饰等方面均有重要的作用[4-8]。乳酸研究由“代谢废物”和“检测指标”进入了“调节因子”的新范式。
Toll样受体(Toll-like receptors,TLRs)是一类位于细胞表面高度保守的模式识别受体超家族,能够识别多种病原体及炎性分子,参与炎症反应。研究[9]表明:巨噬细胞表面及内部分布有多种TLRs(TLR1、TLR2、TLR4、TLR5、TLR6和TLR10),且TLR4相关的信号传导对巨噬细胞极化有关键的影响。接头分子在TLRs信号传导过程中发挥重要的作用,目前发现TLRs的接头分子有5种,包括髓样分化因子88(myeloid differentiation factor 88,MyD88)、诱导β干扰素的Toll/白细胞介素1(interleukin-1,IL-1)受体结构域 衔 接 蛋 白[Toll/IL-1 receptor(TIR)domain containing adaptor protein inducing interferon-β,TRIF]、类MyD88接头分子(MyD88-adaptor like protein,MAL)、TRIF相 关 接 头 分 子(TRIFrelated adaptor molecule,TRAM)和包含TIR结构域的分子等,不同TLRs家族成员可依赖一个或多个接头分子传导信号[10]。巨噬细胞广泛存在于人体组织中,在免疫反应中具有明显的可塑性,即在不同的微环境或细胞外刺激物作用下巨噬细胞可发生M1极化或M2极化[11]。作为TLR4发挥生理功能的2个重要接头分子,MyD88和TRIF介导的信号传导途径分别为MyD88依赖途径和TRIF依赖途径,均参与了巨噬细胞极化的调控[12]。研究[13-15]显示:乳酸可诱导巨噬细胞产生M2极化,然而对于细胞内部具体何种接头分子参与乳酸引起M2极化的研究尚未见报道。
CRISPR/Cas9基因编辑技术是近年来快速发展的一项新技术,目前已广泛应用于生命领域的研究[16]。本研究借助CRISPR/Cas9基因编辑技术定向敲除接头分子MyD88和TRIF,探讨二者在促进乳酸诱导巨噬细胞M2极化中的作用,以期进一步阐明相关机制,为乳酸的生物调控作用研究提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器小鼠单核巨噬细胞白血病Raw264.7细胞、人胚肾293T细胞和大肠杆菌DH5-α(吉林医药学院生物医药双创转化实训平台实验室保存)。pSPAX2、pMD2G、穿梭质粒、pHBLV-U6-gRNA-EF1-ZsGreen载体和LipofiterTM转染试剂盒(上海汉恒生物科技有限公司),质粒抽提试剂盒(美国Axygen公司),RNA提取试剂盒(上海奕杉生物科技有限公司),实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(大连宝生物工程有限公司),胎牛血清、1640培养液、0.25%胰酶和Puromycin(美国Gibco公司),乳酸(美国Sigma公司),MyD88蛋白抗体、TRIF蛋白抗体、核因子κB抑制蛋白α(nuclear factor κB inhibitor protein-α,IκB-α)抗体和NF-κB p65蛋白(NF-κB p65 protein,p65)抗体(美国Cell Signaling Technology公司),羊抗兔和羊抗鼠IgG抗体(美国Proteintech公司),小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素10(interleukin-10,IL-10)、γ干扰素(interferon-γ,INF-γ) 酶 联 免 疫 吸 附 测 定(enzyme linked immunosorbent assay,ELISA)试剂盒(深圳达科为生物技术有限公司),ECL增强型化学发光试剂盒(美国GE公司)。CO2细胞培养箱和低温高速离心机(美国Thermo公司),荧光显微镜(日本Olympus公司),荧光定量PCR仪(美国Applied Biosystems公司),Infinite F500多功能高端酶标仪(奥地利TECAN公司),电泳仪和转膜仪(美国Bio-Rad公司),高端凝胶成像系统(美国Alpha Innotech公司)。
1.2 引物序列设计本研究所采用的引物由吉林省库美生物科技有限公司设计合成。见表1。

表1 PCR引物序列Tab.1 Primer sequences of PCR
1.3 慢病毒法制备Raw264.7-Cas9细胞将pSPAX2、pMD2G和携带Cas9穿梭质粒扩增,抽提后共转染293T细胞,培养72 h后,收集上清,去除细胞碎片后,10 000 g离心2 h,上清中获取高滴度HBLV-Cas9-PURO慢病毒,稀释计数法测定病毒滴度。Raw264.7细胞铺板,细胞密度生长至约50%时,以病毒感染复数(multiplicity of infection,MOI)为20感 染HBLV-Cas9-PURO。24 h后更换含10 g·L-1Puromycin新鲜完全培养液。收获细胞以进行基因敲除。提取细胞总RNA、逆转录、PCR和琼脂糖电泳观察Cas9基因表达情况,采用荧光显微镜观察慢病毒转染情况。
1.4 MyD88和TRIF基因敲除细胞制备根据小鼠MyD88和TRIF在NCBI的基因序列,设计向导RNA(guide RNA,gRNA)序列,引物序列由吉林省库美生物科技有限公司设计合成(表2)。序列合成后,退火为双链Oligo序列,T4连接酶接入含ZsGreen荧光标记的pHBLV-U6-gRNA-EF1-ZsGreen线性化表达载体,连接产物转化至DH5α感受态细胞中,Amp抗性平板37℃培养过夜,挑菌并扩大培养。将测序验证正确的DH5α阳性克隆进行质粒提取、慢病毒包装及滴度测定。

表2 gRNA寡核苷酸序列Tab.2 Sequences of gRNA oligonucleotides
Raw264.7-Cas9细 胞 以5×105mL-1密度接种于6孔细胞培养板,待细胞生长至约50%时,以MOI为30感染包装的各组慢病毒,感染24 h后更换含10 mg·L-1Puromycin新鲜完全培养液继续培养2~3 d,以获得稳定基因敲除细胞株。感染MyD88-gRNA慢病毒细胞为MyD88-KO细胞组,感染TRIF-gRNA慢病毒细胞为TRIF-KO细胞组,未感染Raw264.7细胞为对照组。
1.5 RT-qPCR法检测各组细胞中MyD88和TRIF mRNA表达水平收集对照组、MyD88-KO组和TRIF-KO组细胞,采用RNA快提试剂盒提取总RNA,微量紫外分光光度计测定RNA浓度,以总RNA为模板,逆转录获得cDNA。采用SYBR™Green PCR Master Mix于荧光定量PCR仪上进行RT-qPCR反 应。采 用2-ΔΔCt法 计 算 各 组 细 胞 中MyD88和TRIF mRNA表达水 平。
1.6 Western blotting法检测各组细胞中MyD88和TRIF蛋白表达水平采用RIPA裂解液裂解对照组、MyD88-KO组和TRIF-KO组细胞,并提取总蛋白。采用BCA蛋白定量试剂盒测定蛋白浓度。每样本取等量(50 μg)蛋白10% SDS-PAG凝胶电泳,将电泳分离蛋白转移至PVGF膜上,采用5%脱脂奶粉封闭后,将膜分别与MyD88抗体(1∶2 000)、TRIF抗体(1∶1 000)和β-actin抗体(1∶6 000)4℃条件下孵育过夜,二抗室温孵育1 h,ECL发光后凝胶成像系统成像。采用Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 乳酸诱导Raw264.7细胞极化按照参考文献[14]中的方法,采用15 mmol·L-1乳酸进行极化诱导实验,实验分为未处理Raw264.7细胞组、Raw264.7+乳酸组、MyD88-KO组、MyD88-KO+乳酸组、TRIF-KO组和TRIF-KO+乳酸组,各乳酸组细胞均采用15 mmol·L-1乳酸作用24 h,收集上清和细胞进行后续实验。光学显微镜下观察各组细胞形态表现。采用RNA快提试剂盒提取总RNA,微量紫外分光光度计测定RNA浓度,以总RNA为模板进行逆转录。RT-qPCR法检测各组细胞中巨噬细胞甘露糖受体CD206和精氨酸酶1(arginase1,Arg1)mRNA表达水平。采用ELISA试剂盒检测细胞上清液中TNF-α、INF-γ和IL-10水平。
15 mmol·L-1乳酸作用各组细胞24 h后,提取各组细胞总蛋白,BCA蛋白定量后SDS-PAGE电泳,电转移至PVDF膜上,5%牛血清白蛋白封闭1 h,β-actin、TLR4、IκB-α和p65一抗(1∶6 000、1∶1 000、1∶4 000和1∶2 000)4℃孵育过夜,二抗室温孵育1 h,ECL发光后凝胶成像系统成像,Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。
1.8 分子对接检测乳酸与接头分子结合采用Autodock软件进行分子对接,乳酸分子(ZINC4658560)结构由ZINC数据库下载,TLR4(7mlm)、MyD88(4eo7)和TRIF(3rc4)蛋白结构由PBD数据库下载,导入Autodock对接,选择第一对接结构并采用PyMOL软件分析图像。
1.9 统计学分析采用SPSS 17.0统计软件进行统计学分析。基因敲除各组细胞中MyD88及TRIF mRNA和蛋白表达水平,乳酸诱导后各组细胞中CD206和Arg1 mRNA表达水平,细胞上清中TNF-α、INF-γ和IL-10水平,各组细胞中TLR4、IκB-α和p65蛋白表达水平均符合正态分布,以±s表示,2组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 HBLV-Cas9-PURO慢病毒转染Raw264.7细胞和Cas9表达情况HBLV-Cas9-PURO慢病毒转染后Cas9在Raw264.7细胞中成功表达,细胞呈明显绿色荧光,表明构建的慢病毒将Cas9成功导入并表达。见图1和2。
图1 Cas9 PCR电泳图Fig.1 Electrophoregram of Cas9 PCR
2.2 MyD88和TRIF基因敲除后各组细胞中MyD88及TRIF mRNA和蛋白表达水平与对照组比较,MyD88-KO组细胞中MyD88 mRNA和蛋白表达水平明显降低(P<0.05),TRIF-KO组细胞TRIF mRNA和蛋白表达水平明显降低(P<0.01),表明通过慢病毒方式的CRISPER/Cas9基因编辑方法成功敲除MyD88和TRIF。见图3和4。
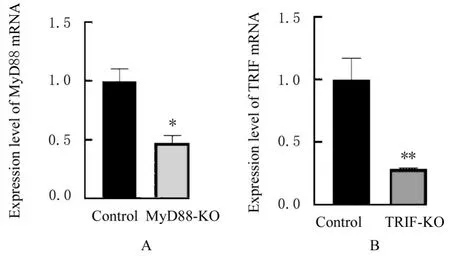
图3 MyD88和TRIF敲除后各组细胞中MyD88和TRIF mRNA表达水平Fig.3 Expression levels of MyD88 and TRIF mRNA in cells in various groups after knockout of MyD88 and TRIF
2.3 乳酸处理后各组细胞中CD206和Arg1mRNA表达水平、细胞形态表现及细胞因子水平RT-qPCR检测结果显示:与未处理Raw264.7细胞组比较,Raw264.7+乳酸组细胞中CD206和Arg1 mRNA表达水平均明显升高(P<0.05)。与MyD88-KO组比较,MyD88-KO+乳酸组细胞中CD206和Arg1 mRNA表达水平均升高(P<0.05)。与TRIF-KO组比较,TRIF-KO+乳酸组细胞中CD206和Arg1 mRNA表达水平降低(P<0.05)。见图5。

图5 RT-qPCR法检测各组细胞中CD206(A)和Arg1(B)mRNA表达水平Fig.5 Expression levels of CD206(A)and Arg1(B)mRNA in various groups detected by RT-qPCR method

图2 荧光显微镜观察慢病毒转染情况(×40)Fig.2 Transfection of lentivirus observed by fluorescence microscope(×40)
细胞形态表现:与未处理Raw264.7细胞组比较,Raw264.7+乳酸组细胞表现出较为典型的M2极化形态,即体积增大、出现明显的突起伪足和偏锥形细胞比例增加;MyD88-KO组和MyD88-KO+乳酸组细胞同样表现出M2极化的形态表现;而TRIF-KO组和TRIF-KO+乳酸组细胞形态变化不明显。见图6。

图6 光学显微镜观察各组细胞形态表现(×20)Fig.6 Morphology of cells in various groups observed by optical microscope(×20)
ELISA法检测结果显示:与未处理Raw264.7细胞组比较,Raw264.7+乳酸组细胞上清液中TNF-α水平明显降低(P<0.05),INF-γ和IL-10水平差异无统计学意义(P>0.05);与MyD88-KO组比较,MyD88-KO+乳酸组细胞上清液中TNF-α水平明显降低(P<0.05),INF-γ水平差异无统计学意义(P>0.05),IL-10水平明显升高(P<0.05);与TRIF-KO组比较,TRIF-KO+乳酸组细胞上清液中TNF-α水平明显升高(P<0.05),INF-γ和IL-10水平差异无统计学意义(P>0.05)。见表3。

表3 各组细胞上清液中TNF-α、INF-γ和IL-10水平Tab.3 Levels of TNF-α,INF-γ and IL-10 in cell supernatant in various groups[n=3,x±s,ρB/(ng·L-1)]

图4 MyD88和TRIF敲除后各组细胞中MyD88和TRIF蛋白表达电泳图(A,B)和直条图(C,D)Fig.4 Electrophoregram(A,B)and histogram(C,D)of expressions of MyD88 and TRIF proteins in cells in various groups after knockout of MyD88 and TRIF
2.4 各组细胞中TLR4和NF-κB信号通路相关蛋白表达水平与未处理Raw264.7细胞组比较,其余各组细胞中TLR4蛋白表达水平差异均无统计学意义(P>0.05),Raw264.7+乳酸组细胞中IκB-α和p65蛋白表达水平降低(P<0.05);与MyD88-KO组 比 较,MyD88-KO+乳 酸 组 细 胞 中IκB-α和p65蛋白表达水平明显降低(P<0.05);与TRIF-KO组比较,TRIF-KO+乳酸组细胞中IκB-α和p65蛋白表达水平差异无统计学意义(P>0.05)。见图7。
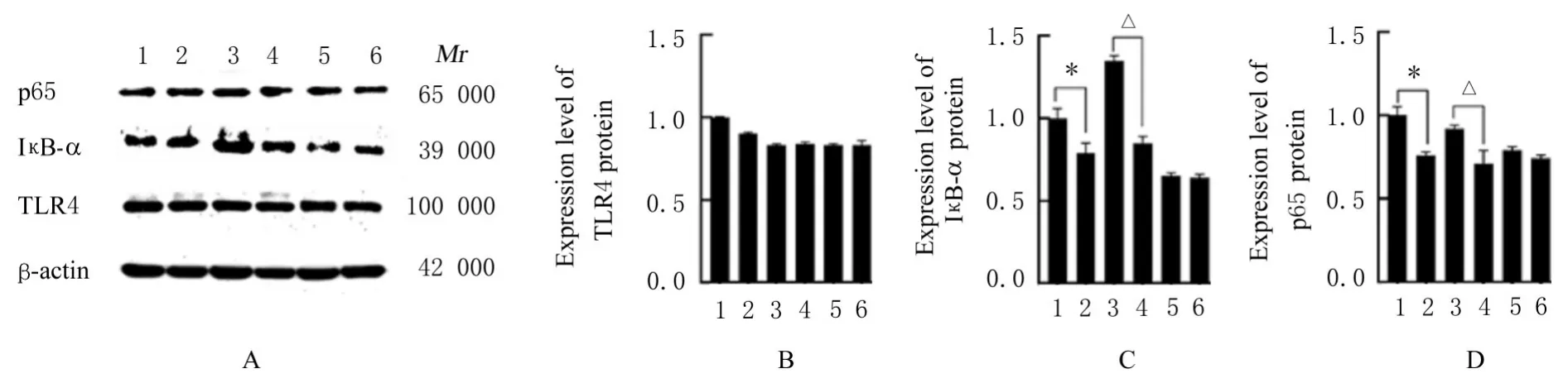
图7 Western blotting法检测各组细胞中TLR4,IκB-α和p65蛋白表达电泳图(A)和直条图(B-D)Fig.7 Electrophoregram(A)and histogram(B-D)of expressions of of TLR4,IκB-α and p65 proteins in cells in various groups detected by Western blotting method
2.5 乳酸与TLR4、MyD88和TRIF结合情况乳酸与TLR4、MyD88和TRIF分子对接模拟结果显示:乳酸与TLR4蛋白形成2个氢键,分别为ARG55:HH12和LYS128:HZ1,结合能为-2.72;乳酸与MyD88蛋白形成4个氢键,分别为GLU159:HN、ARG160:HN、LYS190:HZ3和LYS190:HZ2,结合能为-3.24;乳酸与TRIF蛋白形成4个氢键,分别为ARG1161:HH12、GLY1162:HN、ARG1161:HN和ARG1161:HE,结合能为-3.66。提示乳酸与TRIF蛋白结合优于其与MyD88蛋白结合,与细胞实验结果一致。见图8。

图8 乳酸与TLR4、MyD88和TRIF对接位点图Fig.8 Molecular docking views of lactate with TLR4,MyD88,and TRIF
3 讨 论
近期研究[17-18]表明:乳酸可作为重要的能量代谢底物和信号分子影响诸多生理进程。伤口愈合组织、实质性肿瘤组织和慢性炎性疾病病灶组织中均具有较高浓度乳酸,该现象与细胞快速增殖的供能所需密不可分。而巨噬细胞作为伤口、肿瘤和部分慢性炎性疾病微环境的重要成员,高浓度乳酸对巨噬细胞的影响也被不断报道[19-20]。巨噬细胞具有典型的可塑化特性,根据其功能变化可分为促进炎症的M1极化和抑制炎症的M2极化[21]。研究[9]表明:巨噬细胞极化过程中TLR4接头分子发挥重要作用。然而乳酸作用后巨噬细胞极化的具体机制尚未完全阐明,因此本研究探讨TLR4接头分子是否参与巨噬细胞极化过程。
TLR4作为首个发现的TLRs,广泛分布于巨噬细胞、淋巴细胞和树突状细胞等各类免疫细胞表面,是免疫反应的重要靶点[22]。TLR4被细胞外刺激物激活后,可在细胞内招募接头分子调控下游的信号转导最终引起免疫细胞对外部刺激的反应。巨噬细胞M2极化主要表现为抗炎性细胞因子分泌[IL-10、转 化 生 长 因 子β(transforming growth factor-β,TGF-β)和 趋 化 因 子CC配 体18(C-C motif chemokine ligand 18,CCL18)]、释放活化因子[巨噬细胞集落刺激因子(macrophage colong-stimulating factor,MCSF)、IL-4和IL-13]和标志性膜蛋白(CD206、Arg1、CD163、CD86和Fizz1)表达等[23]。本研究结果显示:在乳酸诱导的M2极化过程中TLR4受体无明显变化,提示乳酸可能并未直接同TLR4结合,而是进入细胞内部后同接头分子相互作用而产生调控效应。本研究进一步的基因敲除实验结果显示:在接头分子TRIF存在情况下,经乳酸诱导后巨噬细胞能够高表达M2极化的标志分子CD206和Arg1,细胞呈锥形并出现明显的伪足,释放抗炎性细胞因子IL-10,抑制炎性因子TNF-α释放;而进一步的分子对接结果显示:与TLR4和MyD88蛋白比较,乳酸可与TRIF蛋白形成较多的氢键且结合能更小,提示乳酸进入细胞内部后更易与TRIF蛋白结合。
NF-κB是巨噬细胞极化调控过程中的关键信号通 路,调 节 大 量 炎 性 因 子 基 因 表 达[24]。NF-κB蛋白是由p65和p50组成的异二聚体,在正常状态下因其与抑制蛋白IκB结合而保持非活性状态。当细胞 受 到 炎 性 刺 激 时,IκB激 酶(inhibitor of κB kinase,IKK)复合物被激活,IκB被磷酸化和泛素化降解,与p65和p50异二聚体复合物分离。p65和p50异二聚体复合物进入到细胞核中激活转录,引起炎症因子的合成增加[25]。巨噬细胞M2极化的基本生理作用是为了平衡过激的炎症可能对细胞的损伤,有研究[26]表明:NF-κB信号通路的负向调控是M2极化过程中的重要机制。本研究结果显示:TRIF蛋白存在的情况下乳酸能够通过下调巨 噬 细 胞 中IκB-α表达,实现对NF-κB信号通路的抑制效应,即p65表达下调。研究[27]显示:细胞中NF-κB信号通路的负性调控蛋白A20参与TRIF介导的NF-κB活化调控。而在线粒体上,TRIF作为TLR3的主要接头分子同样可参与能量代谢相关的信号调控过程[28-29]。最新研究[8]显示:乳酸能够以乳酸化蛋白修饰的方式调控蛋白功能。因此,乳酸在巨噬细胞内是否通过A20或TLR3调控TRIF,或直接修饰TRIF,还需进一步的研究证实。
综上所述,乳酸作用巨噬细胞后,可通过TRIF使 其 下 游IκB-α蛋 白 表 达 下 调,从 而 抑 制NF-κB,促进巨噬细胞M2极化。本研究为初步阐明乳酸的免疫调控作用提供了新的思路和方向。
