人参皂苷Rg1对重症急性胰腺炎大鼠心脏损伤的保护作用及其机制
2022-10-18陈佳祺王首寒杨洪军
杨 杭,陈佳祺,王首寒,杨洪军,王 斌
(吉林省肿瘤医院腹部肿瘤外科,吉林 长春 130012)
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种进展迅速、病死率高的致命性全身性疾病,其最重要的致死原因是心脏损伤[1-4]。研究[5]表明:高血压、心肌缺血再灌注损伤、心肌梗死和心力衰竭等心脏疾病的发生发展都与活性氧含量增加有关。
心血管系统中的活性氧主要由烟酰胺腺嘌呤二核苷酸磷酸氧化酶 (nicotinamide adenine dinucleotide phosphate oxidase,NOX)生 成。在NOX家族中,NOX2和NOX4在心肌中高表达,介导心脏代偿性和失代偿性变化[6-7]。研究[8-13]显示:在脓毒症、缺血性心肌病和心力衰竭等疾病状态下,心功能不全患者的NOX活性均升高,且NOX4升高更明显,促炎细胞因子如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、内 皮 素1(endothelin 1,ET-1)和内毒素等也可激活NOX,促进活性氧的生成,通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路促进氧化应激增加和心肌细胞凋亡,最终导致SAP大鼠心脏损伤。
人参作为一种用于治疗和养生的传统中草药,对人体有保护作用。人参皂苷Rg1,分子式为C42H72O14,是人参属药材的重要药理学活性成分之一,其具有多靶点效应且不良反应少。Rg1可通过增强内源性抗氧化活性物质,如过氧化氢酶、超氧化物歧化酶和谷胱甘肽等活性,明显降低心肌细胞缺氧和复氧过程中活性氧的产生,抵制心肌细胞钙离子(Ca2+)浓度异常性升高,进而抑制左心室肥厚,减少细胞凋亡并保护心脏,避免心肌重塑和慢性血栓栓塞性肺动脉高压大鼠心肌细胞紊乱、右心室肥厚和炎症细胞浸润等现象的发生,并抑制胶原沉积[14-16]。然而,人参皂苷Rg1作为抗氧化剂对SAP相关心脏损伤的作用尚未完全阐明。本研究探讨人参皂苷Rg1对SAP大鼠导致心脏损伤的保护作用,并阐明其可能的分子机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器8周龄健康SD大鼠18只,体质量250~300 g,购自辽宁长生生物技术股份有限公司,动物生产许可证号:SCXK(辽)2020-0001。人 参 皂 苷Rg1(CAS号:22427-39-0)购自上海源叶生物技术有限公司,肌酸激酶MB(creatine kinase-MB,CK-MB)和肌钙蛋白I(cardiac tropnin I,cTnI)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自武汉伊莱瑞特生物科技股份有限公司,白细胞介素1β(interleukin-1β,IL-1β)、TNF-α、内毒素、ET-1和淀粉酶ELISA试剂盒购自杭州联科生物技术股份有限公司,全蛋白提取试剂盒、BCA蛋白定量试剂盒和SDS-PAGE凝胶配制试剂盒购自北京索莱宝生物技术有限公司,NOX4、细胞外调节蛋白激酶1/2(extracellular regulated protein kinase1/2,ERK1/2)、磷 酸 化ERK1/2(phosphorylated ERK1/2,p-ERK1/2)、磷酸化p38(phosphorylated p38,p-p38)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、磷酸化JNK(phosphorylated JNK,p-JNK)、β-actin和羊抗兔IgG(H+L)HRP购自常州市祥泰生物技术有限公司。超声成像系统购自中国迈瑞公司,ULTRA-TURRAX®组织匀浆器购自德国IKA公司,5415R高速离心机购自德国Ependorff公司,Powerpac Basic电 泳系统、Mini Trans-Blot®Cell小型转印槽和680酶标仪购自美国Bio-Rad公司。
1.2 实验分组和造模18只SD大鼠随机分为对照组、模型组和Rg1处理组,每组6只。各组大鼠术前无菌消毒准备后,腹腔注射3%戊巴比妥钠溶液(3 mL·kg-1体质量)麻醉,开腹,充分暴露手术视野。依据参考文献[16-17]方法,对照组大鼠开腹后闭腹;模型组大鼠采用2 mL注射器缓慢逆行向大鼠胆胰管内注射5%牛磺胆酸钠(0.15 μL·kg-1体质量)制备SAP模型,注射后维持5 min,取出微血管钳和穿刺针,关腹;Rg1处理组大鼠于SAP诱导手术前30 min经尾静脉注射Rg1(4 mg·kg-1体质量)。对照组和模型组大鼠术前30 min尾静脉注射等体积生理盐水。术后所有大鼠背部皮下注射无菌生理盐水(4 μL·kg-1体质量)补偿预期失水量,每6 h 1次。
大鼠血清中心肌酶异常超过正常上限值2倍以上,胰腺炎症指标血清中TNF-α、内毒素、ET-1和IL-1β水平升高超正常值2倍以上,可认为造模成功[12]。
1.3 ELISA法检测大鼠血清中炎症因子水平和心肌酶及淀粉酶活性收集不抗凝血液,4℃、3 500 r·min-1离 心15 min,取 上 清 液 备 用。采 用ELISA法检测各组大鼠血清中炎症因子TNF-α、内毒素、ET-1和IL-1β水平及心肌损伤相关指标CK-MB、cTnI和淀粉酶活性,实验重复3次。按照ELISA试剂盒说明书操作,采用酶标仪测定450 nm及405 nm波长处吸光度(A)值,绘制标准曲线。根据标准曲线和A值计算血清中炎症因子水平和心肌酶及淀粉酶活性。
1.4 超声成像系统检测各组大鼠超声心动图各组大鼠术后麻醉苏醒24 h后3%戊巴比妥麻醉,采用超声成像系统以200 mm·s-1的扫描速度观察和记录各组大鼠多普勒信号轨迹,测量心率(heart rate,HR)、左室收缩末期内径(left ventricular end-systolic diameter,LVDs)和左室舒张 末期内径(left ventricular end-diastolic diameter,LVDd),计算左室短轴缩短率(factional shortening,FS)。FS=(LVDd-LVDs/LVDd)×100%。所有数据均由单盲超声诊断仪采集和分析,连续测量5个心动周期,取平均值。
1.5 Western blotting法检测各组大鼠心肌组织中NOX2、NOX4、p-p38、p-ERK1/2和p-JNK蛋白表达水平冰上剪取适量左心室组织样本加入蛋白裂解液,组织匀浆器匀浆,4℃、15 000 r·min-1离心25 min,取上清。采用BCA法测定上清液蛋白浓度,将蛋白浓度用RIPA调整为40 g·L-1,按4∶1比例与5×SDS-PAGE Loading Buffer充分混匀,置于100℃沸水中7 min,使蛋白质变性。10%SDS-PAGE电泳,4℃、100 V转 膜60 min至PVDF膜,5%脱脂奶粉室温封闭2 h。弃封闭液,PBST洗膜后,一抗(1∶1 000)10 h,4℃冰箱孵育,弃一抗,PBST洗膜,二抗(1∶3 000)室温孵育,弃二抗,PBST洗膜。采用化学发光成像系统进行检测,ECL发光剂显影、成像,以β-actin为内参,采用Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin蛋白条带灰度值。
1.6 统计学分析采用GraphPad Prism 9.0统计软件进行统计学分析。各组大鼠血清中TNF-α、内毒素、ET-1和IL-1β水平及CK-MB、cTnI和淀粉酶活性,心肌组织中NOX2、NOX4、p-p38、p-ERK1/2和p-JNK蛋白表达水平均符合正态分布,以±s表示,多组间样本数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血清中炎症因子水平和心肌酶及淀粉酶活性ELISA法检测结果显示:与对照组比较,模型组大鼠血清中TNF-α、内毒素、IL-1β和ET-1水平及CK-MB、cTnI和淀粉酶活性均明显升高(P<0.05);与模型组比较,Rg1处理组大鼠血清中TNF-α、内 毒 素、IL-1 β和ET-1水 平 及CK-MB、cTnI和淀粉酶活性均明显降低(P<0.05)。见表1。
表1 各组大鼠血清中炎症因子水平和心肌酶及淀粉酶活性Tab.1 Levels of inflammatory factors and activities of myocardial enzymes and amylase in serum of rats in various groups(n=6,±s)
*P<0.05 vs control group;△P<0.05 vs model group.
Group Control Model Rg1 treatment TNF-α[ρB/(ng·L-1)]47.08±5.01 150.72±6.72*130.36±2.88*△Endotoxin[ρB/(μg·L-1)]0.54±0.03 1.20±0.02*0.92±0.06*△IL-1β[ρB/(ng·L-1)]55.26±4.25 259.08±5.73*222.53±2.92*△ET-1[ρB/(ng·L-1)]23.15±1.24 52.27±2.02*47.44±1.37*△CK-MB[λB/(U·L-1)]11.33±2.45 32.43±2.74*25.72±3.26△cTnI[ρB/(μg·L-1)]0.68±0.01 1.62±0.09*1.12±0.04△Amylase[λB/(U·L-1)]109.00±45.60 502.33±122.14*385.72±83.26*△
2.2 各组大鼠HR、LVDs、LVDd和FS超声心动图结果显示:与对照组比较,模型组大鼠HR和LVDs明显增加(P<0.05),LVDd差异无统计学意义(P>0.05),FS明显降低(P<0.05);与模型组比较,Rg1处理组大鼠LVDs明显减小(P<0.05),LVDd差异无统计学意义(P>0.05),FS明显升高(P<0.05)。见表2。
表2 各组大鼠HR、FS、LVDd和LVDsTab.2 HR,FS,LVDd and LVDs of rats in various groups (n=6,±s)
*P<0.05 vs control group;△P<0.05 vs model group.
Group Control Model Rg1 treatment HR(beat·min-1)256.25±17.60 301.00±11.14*278.72±10.26 LVDs(d/mm)3.28±0.24 4.00±0.32*3.64±0.17*△LVDd(d/mm)5.62±0.13 5.80±0.33 5.72±0.21 FS(η/%)41.63±1.71 31.03±0.03*36.36±0.14*△
2.3 各组大鼠心肌组织中NOX2、NOX4、p-p38、p-ERK1/2和p-JNK蛋白表达水平Western blotting法检测结果显示:与对照组比较,模型组大鼠心肌组织中NOX2和NOX4蛋白表达水平明 显 升 高(P<0.05或P<0.01);与模型组比较,Rg1处理组大鼠心肌组织中NOX2和NOX4蛋白表达水平明显降低(P<0.05)。与对照组比较,模型组大鼠心肌组织中p-p38、p-ERK1/2和p-JNK蛋白表达水平明显升高(P<0.05);与模型组比较,Rg1处理组大鼠心肌组织中p-p38、p-ERK1/2和p-JNK蛋白表达水平明显降低(P<0.05)。见图1和2。
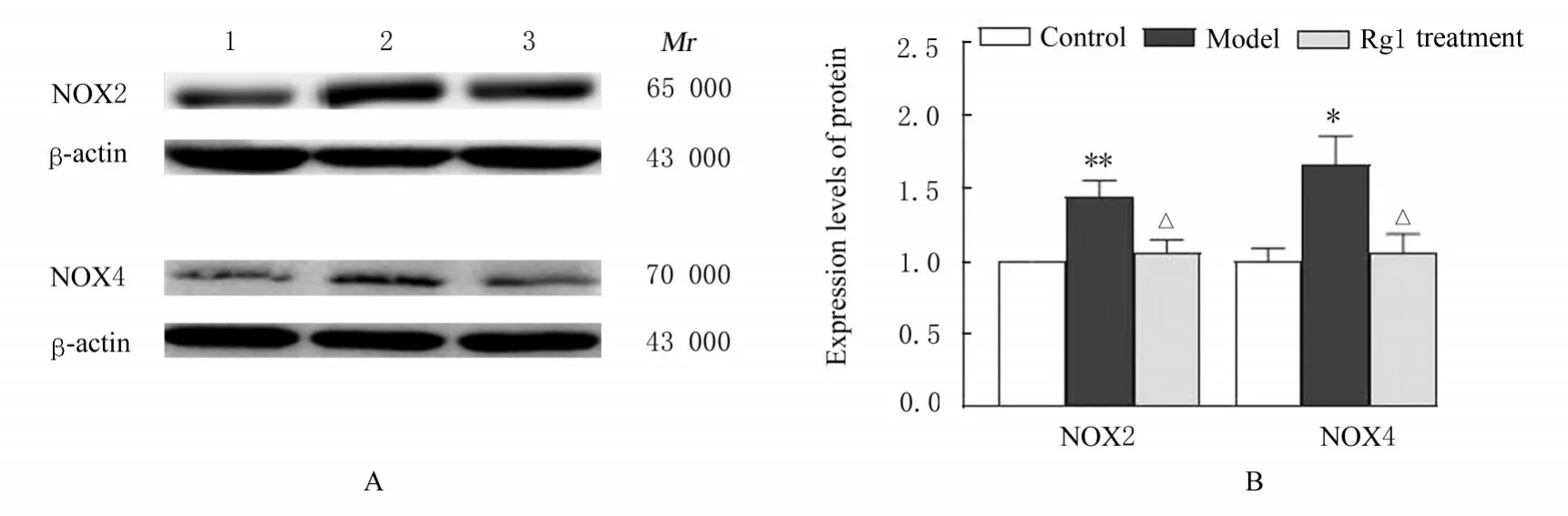
图1 各组大鼠心肌组织中NOX2和NOX4蛋白表达电泳图(A)和直条图(B)Fig.1 Electrophoregram(A)and histogram(B)of expressions of NOX2 and NOX4 proteins in myocardium tissue of rats in various groups
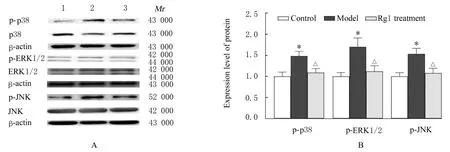
图2 各组大鼠心肌组织中p-p38、p-ERK1/2和p-JNK蛋白表达电泳图(A)和直条图(B)Fig.2 Electrophoregram(A)and histogram(B)of expressions of p-p38,p-ERK1/2 and p-JNK proteins in myocardium tissue of rats in various groups
3 讨 论
SAP患者除胰腺坏死和全身炎症反应外,还会出现肺、肠道、肾和心脏等远隔器官损伤[1-3]。研究[12,18-21]报道:在SAP期间可观察到心功能和心肌损伤的改变。SAP导致的心脏损伤是该病最重要的死亡原因,也是最严重的并发症之一,且SAP大鼠心肌组织中被激活的NOX促进活性氧生成作为损伤心脏的基础,并通过激活MAPK通路,增加氧化应激,同时增加心肌细胞凋亡,最终导致心脏损伤[22-23]。
本研究结果显示:SAP大鼠的心脏损伤模型制备成功;与对照组比较,SAP大鼠血清中心肌损伤相关的CK-MB和cTnI蛋白酶活性明显升高,LVDs和LVDd明显增加,FS明显降低,同时模型组大鼠血清中淀粉酶活性及炎症相关因子TNF-α、内毒素、IL-1β和ET-1水平均明显升高,上述指标不仅是胰腺炎症相关指标,同时也是慢性心力衰竭、心肌缺血再灌注损伤、高血压、脑出血和肺气肿等疾病研究中的重要指标;与模型组比较,Rg1处理组大鼠血清中CK-MB和cTnI活性降低,表明Rg1处理可明显减轻SAP引起的心脏损伤,且LVDs明显减小,FS明显升高,表明Rg1处理明显改善了SAP大鼠的心脏功能,同样证实Rg1处理减轻了SAP大鼠的心脏损伤。
研究[10-12,17]显示:氧化还原敏感的MAPK信号通路通常被认为可调节心肌细胞的炎症和凋亡,NOX可促进活性氧生成,通过激活MAPK通路促进氧化应激增加和心肌细胞凋亡。本文作者推测Rg1可抑制氧化应激并保护SAP大鼠心脏作用,其作用机制可能与干预NOX激活MAPK通路有关。MAPK家族参与多种调控过程,包括对生长信号的反应、细胞凋亡和对压力的敏感性,p38、ERK1/2和JNK是MAPK信号通路的主要亚家族[12,24-26]。结 果 显 示:Rg1处 理 使 由SAP引 发 的NOX2、NOX4、p-ERK1/2、p-p38和p-JNK蛋 白表达明显上调的情况被逆转,表明Rg1对SAP大鼠心脏的保护作用与NOX及其下游信号分子MAPK家族有关。
尽管NOX对左室肥厚本身的发展非必要,但其在压力超负荷时会导致心脏收缩功能障碍的发展。NOX作为活性氧生成的重要来源,使活性氧生成增加,活性氧通过激活MAPK通路促进氧化应激增加和心肌细胞凋亡[10-12]。而人参皂苷Rg1可通过MAPK信号通路降低氧化应激过程[27-30],对SAP大鼠心脏损伤起到保护作用。
综上所述,人参皂苷Rg1对SAP大鼠心脏损伤具有一定保护作用,其机制可能与人参皂苷Rg1抑制NOX介导的由MAPK信号通路增加心肌组织氧化应激有关。
