桑黄酸性多糖对胆管结扎所致小鼠肝纤维化的改善作用及其机制
2022-10-18谷明柳林逢源吴雪峰周嘉宁卢学春杜培革安丽萍
谷明柳,林逢源,吴雪峰,周嘉宁,卢学春,杜培革,安丽萍
(1.北华大学药学院微生物与生化药学教研室,吉林 吉林 132013;2.解放军总医院第二医学中心血液科 国家老年疾病临床研究中心,北京 100853)
肝纤维化是机体各种慢性疾病对肝脏损伤的病理表现,现代药理学研究[1]表明:长期过量饮酒、非酒精性脂肪性肝炎、非酒精性脂肪性肝病、病毒性肝炎、自身免疫性肝炎和胆汁淤积性肝病均有可能发展为肝纤维化。如果持续损伤,肝纤维化可能导致肝硬化,并最终发展为肝癌。淤胆性肝损伤是肝纤维化最重要的刺激因素之一,其特点为肝组织和血清中胆汁酸水平升高,产生肝脏毒性,肝组织出现氧化应激和炎症反应,最终导致肝纤维化和肝硬化[2]。研究[3]显示:肝纤维化是一个动态的过程,可以通过逆转肝纤维化阻止其继续向肝硬化发展而达到治疗效果。
桑黄(Phellinus igniarius)是多孔菌科火木层孔菌的子实体,别名桑寄生、桑臣、桑耳,被现代人称为“森林黄金”。桑黄中含有多糖、黄酮、多酚、三萜和蛋白质等多种成分,其中桑黄多糖是其主要活性成分[4-5]。目前已有研究[6-7]显示:桑黄多糖通过调节氧化应激途径对硫代乙酰胺诱导的肝纤维化具有保护作用。本课题组前期研究[7]表明:桑黄多糖具有体外抗氧化活性,能抑制肝癌细胞增殖,其中桑黄酸性多糖(Phellinus igniariusacidic polysaccharide,PIP)能提高小鼠免疫力,但其对肝纤维化的保护作用目前尚未阐明。本研究通过胆管结扎(bile duct ligation,BDL)建立肝纤维化小鼠模型,探讨PIP对肝纤维化的作用,阐明其可能的作用机制,为肝纤维化的治疗提供新的研究方向。
1材料与方法
1.1 实验动物、药物、主要试剂和仪器SPF级雄性C57/BL6小鼠60只,4周龄,体质量(20.0±2.0)g,动物生产许可证号:SCXK(吉)-2018-0007,购自长春亿斯实验动物技术有限责任公司,分笼饲养,维持12 h∶12 h昼夜循环,自由进食和饮水。桑黄子实体购自延吉百纳和商贸有限公司,经北华大学药学院生药教研室鉴定为长白山野生桑黄子实体,PIP由北华大学药学院微生物与生化药学教研室自制,制备方法为桑黄子实体经水提醇沉,以DEAE纤维素分离纯化制得PIP[8]。秋水仙碱购自美国Sigma公司,超氧化物歧化酶(superoxide dismutase,SOD)、丙 二 醛 (malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒和HE染液购自南京建成生物工程研究所,天狼猩红试剂盒购自北京索莱宝科技有限公司;Ⅲ型前胶原(procollagen typeⅢ,PCⅢ)试剂盒、Ⅳ型胶原(collagen typeⅣ,ColⅣ)试剂盒、兔抗β-actin、核因子E2相关因子(nuclear factor-E2 related factor,Nrf2)、血 红 素 加 氧 酶1(heme oxygenase-1,HO-1)和醌氧化还原酶1(quinone oxidoreductase 1,NQO1)单克隆抗体购自美国Abclonal公司,辣根过氧化物酶标记山羊抗兔IgG购自英国Abcam公司,彩虹Marker购自美国GE Healthcare公司,ECL显色液购于江苏碧云天有限公司。UV-2550型紫外可见分光光度计购自上海岛津国际贸易有限公司,ChampchemiProfessional全自动凝胶成像系统购自北京赛制创业科技有限公司,电泳仪购自美国Bio-Rad公司,Acradia H&C石蜡包埋机、冷台和RM 2245半自动轮转式切片机购自德国Leica公司。
1.2 实验动物分组和造模60只C57/BL6雄性小鼠随机分为对照组(双蒸水灌胃+假手术)、模型组(双蒸水灌胃+BDL)、阳性药组(秋水仙碱0.2 mg·kg-1灌胃+BDL)和PIP组(PIP 70 mg·kg-1灌胃+BDL),每组15只。动物饲养及使用严格按照北华大学动物伦理委员会要求。实验前采用5 %水合氯醛腹腔注射麻醉小鼠,将小鼠固定于操作台上。腹部75 %医用酒精消毒,剪开皮肤及肌肉等组织,暴露肝脏。取棉签蘸生理盐水探入腹腔,将肝叶、胃及部分肠管轻轻向右拨开,眼科镊轻柔游离胆管,埋置2条手术缝线,结扎胆管上、下两段,并于中间处剪断胆管,随即关腹。对照组小鼠仅绕胆总管穿过手术线但不结扎。灌胃给药3周,末次给药12 h后眼球取血,去除内脏,生理盐水洗净吸干,称取小鼠体质量和肝脏质量,计算小鼠肝脏指数。肝脏指数=小鼠肝脏质量(g)/小鼠体质量(g)×100%。每组取肝大叶置于甲醛溶液中固定,常温下保存备用,其余肝组织-80℃保存。
1.3 微板法检测各组小鼠血清中丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平小鼠眼 眶取血,静置1 h后,3 000 r·min-1、4℃离心20 min,采用微板法检测各组小鼠血清中ALT和AST水平,按照试剂盒说明书方法,每孔加入10 μL血清,再加入显色剂,于505 nm波长处测定吸光度(A)值,绘制标准曲线,计算ALT和AST水平。
1.4 双抗体夹心法检测各组小鼠血清中PCⅢ和ColⅣ水平采用双抗体夹心法检测各组小鼠血清中肝纤维化标志物PCⅢ和ColⅣ水平,于板底涂针对抗原的抗体,将血清和检测抗体加入后,反应一段时间后用洗涤液洗涤5次,分别加入2种不同的显色液,以显色反应的结果作为衡量标准。于450 nm波长处检测A值,绘制标准曲线,计算PCⅢ和ColⅣ水平。
1.5 HE染色和天狼猩红染色观察各组小鼠肝组织病理形态表现和肝纤维化程度取固定后的肝大叶石蜡包埋,切片。HE染色后,显微镜下观察各组小鼠肝组织形态表现。天狼猩红染色后,显微镜下观察各组小鼠肝组织纤维化程度。
1.6 检测各组小鼠肝组织中SOD和GSH-Px活性及MDA和GSH水平取冻存的小鼠肝脏,按照肝脏 质 量 和 生 理 盐 水 以1∶9比 例,3 000 r·min-1、4℃离心10 min制成10%组织匀浆,用生理盐水稀释成不同浓度进行最佳取样浓度筛选。按照试剂盒说明书操作,采用水溶性四氮唑(WST-1)法检测SOD活性,硫代巴比妥酸(TBA)法检测MDA水平,微板法检测GSH水平,比色法检测GSH-Px活性。
1.7 Western blotting法检测各组小鼠肝组织中Nrf2/HO-1信号通路相关蛋白表达水平称取50 mg肝组织,加入500 μL RIPA裂解液,冰上匀浆,裂解1 h,4℃、12 000 r·min-1离心20 min,取上清液,BCA试剂盒测定蛋白含量。采用10%SDS-PAGE凝胶电泳分离蛋白,转膜1 h至甲醇处理后的PVDF膜,含5%脱脂奶粉TBS-T封闭液封闭1 h,然后加入一抗β-actin(1∶50 000)、Nrf2(1∶1 000)、HO-1(1∶1 000)和NQO1(1∶1 000)室 温 孵 育1h,TBS-T洗 涤3次,每次15 min,加入二抗(1∶5 000)室温孵育1 h,TBS-T洗涤3次,每次15 min,ECL显色液显色。采用Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin蛋白条带灰度值。
1.8 统计学分析采用SPSS 16.0统计软件进行统计学分析。各组小鼠体质量、肝脏质量、肝脏指数、血清中ALT和AST水平、血清中PCⅢ和ColⅣ水平、肝组织中SOD和GSH-Px活性、肝组织中MDA和GSH水平及肝组织中Nrf2/HO-1信号通路相关蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠体质量、肝脏质量和肝脏指数与对照组比较,模型组、阳性药组和PIP组小鼠体质量差异无统计学意义(P>0.05)。与对照组比较,模型组小鼠肝脏质量和肝脏指数均升高(P<0.05);与模型组比较,阳性药组和PIP组小鼠体质量差异无统计学意义(P>0.05),肝脏质量和肝脏指数均降低(P<0.05)。见表1。
表1 各组小鼠体质量、肝脏质量和肝脏指数Tab.1 Body weights,liver weights,and liver indexes of mice in various groups (n=15,±s)
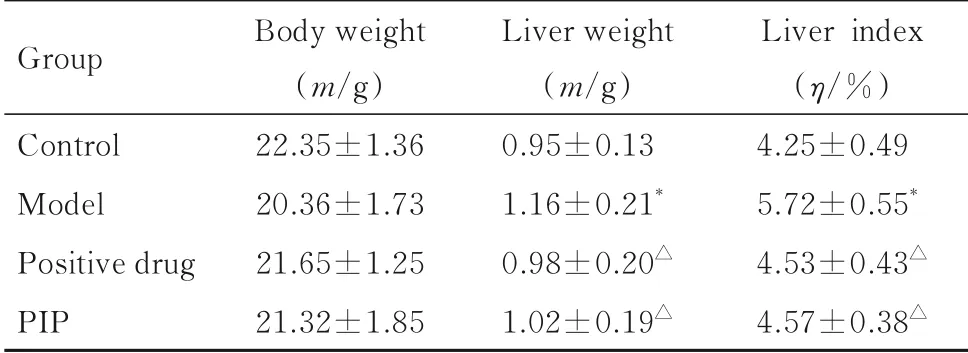
表1 各组小鼠体质量、肝脏质量和肝脏指数Tab.1 Body weights,liver weights,and liver indexes of mice in various groups (n=15,±s)
*P<0.05 vs control group;△P<0.05 vs model group.
Group Control Model Positive drug PIP Body weight(m/g)22.35±1.36 20.36±1.73 21.65±1.25 21.32±1.85 Liver weight(m/g)0.95±0.13 1.16±0.21*0.98±0.20△1.02±0.19△Liver index(η/%)4.25±0.49 5.72±0.55*4.53±0.43△4.57±0.38△
2.2 各组小鼠血清中ALT和AST水平与对照组比较,模型组小鼠血清中ALT和AST水平均明显升高(P<0.01),表明小鼠肝细胞出现损伤,造模成功;与模型组比较,阳性药组和PIP组小鼠血清中ALT和AST水平明显降低(P<0.01)。见表2。
表2 各组小鼠血清中ALT和AST水平Tab.2 Levels of ALT and AST in serum of mice in variousgroups [n=15,±s,λB/(U·L-1]

表2 各组小鼠血清中ALT和AST水平Tab.2 Levels of ALT and AST in serum of mice in variousgroups [n=15,±s,λB/(U·L-1]
*P<0.01 vs control group;△P<0.01 vs model group.
Group Control Model Positive drug PIP ALT 29.84±5.31 210.89±16.85*102.87±18.15△112.61±22.60△AST 16.75±2.94 69.07±5.47*30.32±7.02△44.86±8.75△
2.3 各组小鼠血清中PCⅢ和ColⅣ水平与对照组比较,模型组小鼠血清中PCⅢ和ColⅣ水平均升高(P<0.05),表明肝脏出现纤维化,肝纤维化模型建立成功;与模型组比较,阳性药组和PIP组小鼠血清中PCⅢ和ColⅣ水平均明显降低(P<0.05或P<0.01)。见表3。
表3 各组小鼠血清中PCⅢ和ColⅣ水平Tab.3 Levels of PCⅢand ColⅣin serum of mice in various groups [n=15,±s,ρB/(μg·L-1)]

表3 各组小鼠血清中PCⅢ和ColⅣ水平Tab.3 Levels of PCⅢand ColⅣin serum of mice in various groups [n=15,±s,ρB/(μg·L-1)]
*P<0.05 vs control group;△P<0.05,△△P<0.01 vs model group.
Group Control Model Positive drug PIP PCⅢ51.50±7.99 79.42±4.07*51.97±6.67△52.81±5.15△ColⅣ49.81±2.94 117.11±10.84*56.48±8.01△△47.32±5.81△△
2.4 各组小鼠肝组织病理形态表现HE染色结果显示:对照组小鼠肝组织中肝小叶和肝细胞结构清晰,核居中,门管区未见炎症细胞浸润;模型组小鼠肝小叶结构破坏,排列紊乱,门管区出现纤维组织沉积,可见大灶状液化性肝坏死和较多炎症细胞浸润;阳性药组和PIP组小鼠肝组织坏死程度明显减轻,未见明显纤维组织沉积,但仍可见局灶性炎症细胞浸润。见图1。

图1 各组小鼠肝组织病理形态表现(HE,×200)Fig.1 Pathomorphology of liver tissue of mice in various groups(HE,×200)
2.5 各组小鼠肝组织纤维化程度天狼猩红染色结果显示:与对照组比较,模型组小鼠肝组织门管区胶原纤维含量明显增加,胶原纤维呈亮红色,表明肝组织出现明显纤维化;与模型组比较,阳性药组和PIP组小鼠肝组织门管区胶原纤维含量明显减少,肝纤维化程度改善。见图2。

图2 各组小鼠肝组织纤维化程度(天狼猩红,×200)Fig.2 Fibrosis degrees of liver tissue of mice in various groups(Sirius red,×200)
2.6 各组小鼠肝组织中SOD和GSH-Px活性及MDA和GSH水平与对照组比较,模型组小鼠肝组织中SOD和GSH-Px活性明显降低(P<0.01),MDA和GSH水 平 明 显 升 高(P<0.05或P<0.01);与模型组比较,阳性药组和PIP组小鼠肝组织中SOD和GSH-Px活性均升高(P<0.05),GSH和MDA水平均降低(P<0.05)。见表4。
表4 各组小鼠肝组织中SOD和GSH-Px活性及MDA和GSH水平Tab.4 Activities of SOD and GSH-Px and levels of MDA and GSH in liver tissue of mice in various groups (n=15,±s)
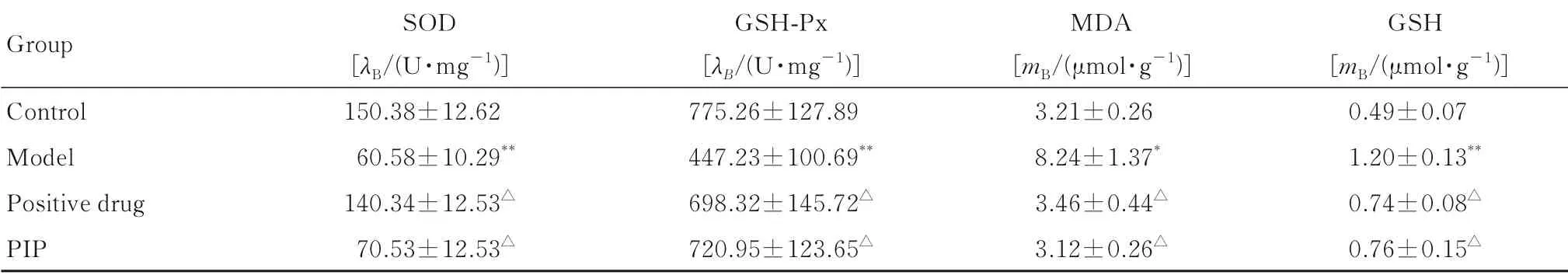
表4 各组小鼠肝组织中SOD和GSH-Px活性及MDA和GSH水平Tab.4 Activities of SOD and GSH-Px and levels of MDA and GSH in liver tissue of mice in various groups (n=15,±s)
*P<0.05,**P<0.01 vs control group;ΔP<0.05 vs model group.
Group Control Model Positive drug PIP SOD[λB/(U·mg-1)]150.38±12.62 60.58±10.29**140.34±12.53△70.53±12.53△GSH-Px[λB/(U·mg-1)]775.26±127.89 447.23±100.69**698.32±145.72△720.95±123.65△MDA[mB/(μmol·g-1)]3.21±0.26 8.24±1.37*3.46±0.44△3.12±0.26△GSH[mB/(μmol·g-1)]0.49±0.07 1.20±0.13**0.74±0.08△0.76±0.15△
2.7 各组小鼠肝组织中Nrf2/HO-1信号通路相关蛋白表达水平与对照组比较,模型组小鼠肝组织中Nrf2、HO-1和NQO1蛋白表达水平均降低(P<0.05);与模型组比较,阳性药组小鼠肝组织中Nrf2和NQO1蛋白表达水平明显升高(P<0.05或P<0.01),HO-1蛋白表达水平明显降低(P<0.01),PIP组小鼠肝组织中Nrf2、HO-1和NQO1蛋 白 表 达 水 平 均 升 高(P<0.05或P<0.01)。见图3。

图3 各组小鼠肝组织中Nrf2/HO-1信号通路相关蛋白表达电泳图(A)和直条图(B-D)Fig.3 Electrophoregron(A)and histogram(B-D)of expressions of Nrf2/HO-1 signaling pathway-related proteins in liver tissue of mice in various groups
3 讨 论
目前常用的肝纤维化造模方法包括BDL法、毒物诱导法、酒精诱导法、刀豆蛋白诱导法和血吸虫诱导法等。其中BDL法是目前最常用的梗阻性胆汁淤积造模方法,具有形成肝纤维化稳定、造模周期短和无毒性物质接触等优势[9]。小鼠BDL后会出现胆汁倒流入血,胆汁酸积聚,小鼠血清中ALT和AST水平升高。ALT和AST是反映肝功能的重要指标,在氨基酸合成和分解代谢过程中起到重要作用,是衡量肝损伤的敏感指标[9]。本研究结果显示:模型组小鼠血清中ALT和AST水平明显升高,肝小叶结构破坏,排列紊乱,门管区出现纤维组织沉积,可见大灶状液化性肝坏死和较多炎症细胞浸润,提示模型组小鼠出现明显的肝损伤;给予PIP后,小鼠血清中ALT和AST水平明显降低,肝脏坏死程度明显减轻,但仍可见局灶性炎症细胞浸润,提示PIP有一定的肝损伤保护作用。PCⅢ可以反映肝纤维化程度,ColⅣ是肝纤维的早期标志物,ColⅣ水平升高可以灵敏反映肝纤维化的发展过程[10]。本研究结果显示:与对照组比较,模型组小鼠肝纤维化标志物PCⅢ和ColⅣ水平升高,门管区胶原纤维含量明显增加,说明小鼠肝纤维化模型建立成功;给予PIP后,PIP组小鼠肝组织中PCⅢ和ColⅣ水平降低,胶原纤维含量减少,提示PIP能减少小鼠肝纤维化进展过程中的胶原堆积,有效缓解肝纤维化,改善肝脏功能,发挥肝损伤保护作用,但其作用机制尚不明确。
在肝纤维化的发生发展过程中,诸多因素可引发机体内氧化应激加剧肝纤维化程度,因此抑制机体内氧化应激程度可以改善肝纤维化[11-12]。SOD能清除肝组织中生成的自由基,作为催化剂发挥抗氧化作用,调节体内氧化应激系统的平衡状态,是天然的抗氧化剂,SOD活性降低会引发脂质过氧化物催化裂解,促进MDA生成,产生细胞毒性[13]。MDA是自由基作用于脂质发生过氧化反应的最终产物,是反映机体潜在抗氧化能力的重要参数[14]。GSH和GSH-Px是 机 体 氧 化 应 激 水 平 的 反应指标,GSH主要在肝组织中生成且具有强大的还原能力,在肝脏保护中发挥积极作用,但当肝细胞遭受严重破坏时可能会出现内源生成减少,消耗增 加,从 而 使GSH水 平 降 低[15]。GSH-Px是 体 内重要的抗氧化酶,能催化GSH和过氧化氢之间的还原反应,维持肝细胞膜结构完整[16]。本研究结果显示:PIP组小鼠肝组织中SOD和GSH-Px活性升高,GSH和MDA水平降低,PIP维持肝内氧化-抗氧化系统的平衡状态,发挥较强的抗氧化活性。由此可知,PIP可以通过调节体内抗氧化酶活性和氧化应激改善肝纤维化,本研究结果为进一步探讨PIP对肝纤维化的保护作用提供了研究方向。
氧化应激损伤在肝纤维化的发生发展过程中起到关键作用,氧化应激系统的过度激活会导致脂质过氧化并产生大量的活性氧,干扰肝脏内细胞的正常功能,因此恢复体内氧化与抗氧化系统的平衡能抑制肝纤维化的进展[17-19]。研究[20]表明:Nrf2是体内重要的抗氧化应激效应因子,也是肝脏抗氧化应激系统的中心环节,Nrf2激活能增强内源性抗氧化系统,抵抗体内氧化应激系统的失衡。在胆汁淤积性肝损伤状态下,Nrf2被持续激活,与Keap1解偶联并与下游抗氧化因子Ⅱ期解毒酶结合,包括HO-1和NQO1,保护机体免受活性氧攻击来降低氧化应激损伤[20-24]。本研究结果显示:PIP处理后,肝纤维化小鼠肝组织中Nrf2、HO-1和NQO1蛋白表达上调,表明Nrf2可能被激活,进而影响肝组织中一系列解毒和抗氧化防御基因的表达,降低氧化应激水平,从而控制肝纤维化的进程。因此,PIP可通过上调Nrf2/HO-1信号通路中3个关键因子Nrf2、HO-1和NQO1蛋白表达水平,增强体内抗氧化酶活性,改善肝纤维化,抑制BDL所致的小鼠肝纤维化的进一步发展。
综上所述,PIP能改善小鼠BDL导致的肝纤维化,其作用可能是通过降低肝组织氧化应激水平,调节Nrf2/HO-1信号通路中关键因子Nrf2、HO-1和NQO1蛋白表达水平实现的。本研究为肝纤维化的治疗提供了新的实验依据。
