褐飞虱对五种杀虫剂抗性的快速检测技术
2022-10-18肖彩云李荣玉
吴 帅, 顾 希, 肖彩云, 李 明, 李荣玉,*, 廖 逊,*
(1. 贵州大学作物保护研究所, 贵阳 550025; 2. 贵州省山地农业病虫害重点实验室, 贵阳 550025;3. 贵州大学农学院, 贵阳 550025)
褐飞虱Nilaparvatalugens属半翅目(Hemiptera)飞虱科(Delphacidae),具有单食性及迁飞性等特点(Dyck and Thoma, 1979; 洪晓月和丁锦华, 2007),是为害亚洲水稻生产的主要害虫之一,每年对我国稻区造成不同程度的经济损失(程家安和祝增荣, 2006)。该害虫通过刺吸式口器刺穿水稻茎秆取食汁液,从而阻断维管束组织,影响营养传输导致水稻大面积倒伏枯死,同时还可作为水稻病毒的传播媒介对水稻造成间接危害。目前褐飞虱的防治措施以化学防治为主,但长期大规模单一使用化学药剂已经导致褐飞虱对许多杀虫剂产生了不同程度的抗性(李荣玉等, 2016; Zhangetal., 2016; Wuetal., 2018; Liaoetal., 2021)。因此,了解褐飞虱的抗性水平,对于田间褐飞虱的合理选药和用药具有重要的参考价值。
目前室内测定褐飞虱对杀虫剂的抗性水平主要采用中华人民共和国农业行业标准《水稻褐飞虱抗药性监测技术规程》(NY/T1708-2009)中的稻茎浸渍法和稻苗浸渍法。该方法所得结果虽然准确性高,但存在试验步骤复杂、费时、费力等问题,故不适用于在田间快速检测褐飞虱的抗性水平。因此,需要开发一种简单、快速的田间褐飞虱抗药性水平检测方法。基于玻璃瓶药膜法获得的杀虫剂诊断剂量,可用于开发快速测定昆虫对杀虫剂抗性水平的选药试剂盒(张宗磊, 2013; 高希武等, 2014; 郭静静等, 2017)。本研究参考玻璃瓶药膜法建立了一种抗药性快速检测方法,该方法操作简单,且适用于稻飞虱这种个体较小昆虫的抗性水平检测。
新烟碱类药剂是作用于昆虫烟碱型乙酰胆碱受体的一类高效杀虫剂,在农业生产中主要用于防治蚜虫(Devineetal., 2016)、烟粉虱Bemisiatabaci(Basitetal., 2011)、稻飞虱(何佳春等, 2019)等刺吸式口器害虫。但是随着新烟碱类药剂的长期使用,我国褐飞虱田间种群对多种新烟碱类药剂产生了抗性,如对第一代新烟碱类药剂吡虫啉已经产生了高水平抗性(刘叙杆等, 2010; 王鹏等, 2013; Garroodetal., 2016),对第二代新烟碱类药剂噻虫嗪和烯啶虫胺等也产生了中等至高水平抗性(Zhangetal., 2014; Shunetal., 2018);此外相关学者也监测到褐飞虱对异丙威及毒死蜱的抗性水平为低水平至中等水平抗性(廖逊, 2019; 张帅, 2019)。随着褐飞虱抗药性水平的不断上升,往往需要施用更高剂量的杀虫剂才能保证有效的防控,但这也会导致褐飞虱抗性个体频率的增加,从而导致杀虫剂面临防治失效的风险。
为实现快速检测田间褐飞虱种群对部分新烟碱类杀虫剂以及毒死蜱、醚菊酯和异丙威的抗性水平,本研究通过玻璃瓶药膜法,建立了褐飞虱对2种新烟碱类杀虫剂以及毒死蜱、醚菊酯和异丙威敏感性的诊断剂量,采用所确定的诊断剂量,测定了5个褐飞虱田间种群对这5种杀虫剂的抗性水平,并与稻苗浸渍法测得的抗性倍数进行相关性分析,对采用诊断剂量所测得的褐飞虱抗性倍数的准确性进行了验证。
1 材料与方法
1.1 供试昆虫
室内褐飞虱敏感种群(SS):于2006年采自湖南省农业科学院试验田,不接触任何药剂室饲养至今(由华中农业大学惠赠)。
贵州省田间褐飞虱种群:花溪种群(HX)、惠水种群(HS)、黄平种群(HP)、安顺种群(AS)、湄潭种群(MT)分别于2020年8-9月采自贵州省花溪、惠水、黄平、安顺和湄潭地区的田间水稻上;安龙种群(AL)于2021年9月采于贵州省安龙地区的水稻上。
所有褐飞虱种群均在不接触任何药剂的新鲜水稻苗上饲养,饲养条件:温度25±1℃,相对湿度70%±5%,光周期16L∶8D。
1.2 供试药剂及仪器
95.8%吡虫啉原药、95%醚菊酯原药、98%毒死蜱原药和97.3%异丙威原药,湖北康宝泰精细化工有限公司;98%啶虫脒原药,山东联合化工有限公司;丙酮,山东化工有限公司;滚轴混匀仪,杭州米欧仪器有限公司。
1.3 杀虫剂对褐飞虱的毒力测定
1.3.1玻璃瓶药膜法:参考郭静静等(2017)的方法稍加修改,用丙酮将5种供试药剂原药配制成母液,试验时根据药剂初筛结果再按等差或等比用丙酮稀释成所需浓度。从稀释好的药液中吸取350 μL滴入内径2.3 cm、高4.3 cm(内表面积为35.20 cm2)的玻璃瓶中,将玻璃瓶放在滚轴混匀仪上滚动30 min,使药液均匀覆盖玻璃瓶内壁,待丙酮挥发干后进行测定。每种药剂设5~6个浓度,每浓度3次重复,仅添加丙酮作为对照。使用吸虫器将15头健康一致褐飞虱3龄若虫放入药瓶中,轻轻盖上瓶盖(确保空气可进入瓶中且试虫无法逃逸),将玻璃瓶放入温度27±1℃、相对湿度70%~80%的人工气候箱中(设置为全光照),1 h后检查死亡率。以对照死亡率小于10%为有效测定,并用对照死亡率进行校正。
1.3.2稻苗浸渍法:采用稻苗浸渍法(Liaoetal., 2017)测定室内褐飞虱敏感种群和贵州省田间种群对吡虫啉、啶虫脒、醚菊酯、毒死蜱和异丙威5种杀虫剂的敏感性。将称取的原药用丙酮溶液稀释得到一定浓度的母液,根据药剂初筛结果用含0.1% Triton-X 100(Sigma-Aldrich)的蒸馏水按等比或等差把母液稀释成5个浓度梯度的药液用于浸苗。取室内培养的长10 cm左右的带根稻苗,冲洗根部直至没有过多杂质,每15根稻苗为1个重复,每个浓度3个重复。洗净后的稻苗放置阴干至表面无水痕后置于药液中浸渍30 s,按药液浓度由低到高的顺序处理,以含0.1% Triton-X 100的蒸馏水为对照,取出后晾干稻苗表面药液,待药液晾干后以浸湿的脱脂棉裹住稻苗茎基部以下使得根部不外露,包好的稻苗放入含有30~35 mL营养液的杯子中,以防止稻苗在试验时间内枯萎从而造成实验误差。吸取褐飞虱3龄若虫,将试虫小心移入有稻苗的杯中,用棉纱布和橡皮筋封住杯口,防止试虫爬出。每杯15头若虫为1个重复,每个浓度3个重复,总虫数45头,将培养杯放入温度27±1℃、相对湿度70%~80%、光周期16L∶8D的恒温培养箱中培养,72 h(异丙威、毒死蜱和醚菊酯)和96 h(啶虫脒和吡虫啉)后记录试虫死亡数。
1.4 诊断剂量的测定
采用玻璃瓶药膜法进行生物活性测定,并利用毒力回归方程分别计算5种杀虫剂对室内褐飞虱敏感种群的LD90值。分别制备5种杀虫剂相应LD90剂量下的载药玻璃瓶(含相应剂量药膜),并测定其对室内褐飞虱敏感种群的实际死亡率,从而验证上述LD90值的准确性。目前已有文献报道采用LD90或LD99剂量作为诊断剂量(张宗磊, 2013; 郭静静等, 2017),本研究对计算获得的LD90进行准确性验证,若LD90剂量下褐飞虱敏感种群实际死亡率在85%~95%之间,则该LD90剂量将作为杀虫剂的诊断剂量用于制备相应的快速检测试剂盒。
1.5 诊断剂量检测方法的准确性验证
采用玻璃瓶药膜法分别测定褐飞虱室内敏感种群以及2020年采自贵州省花溪、惠水、黄平、安顺和湄潭地区的5个田间种群在5种杀虫剂诊断剂量下的校正死亡率,将死亡率与稻苗浸渍法测得的抗性倍数进行相关性分析,评价通过该诊断剂量快速测定褐飞虱抗性水平的可行性。同时,利用玻璃瓶药膜法实测死亡率与稻苗浸渍法实测抗性倍数两组数据构建回归方程模型。
采用玻璃瓶药膜法测定2021年采自贵州省安龙县褐飞虱田间种群在5种杀虫剂诊断剂量下的校正死亡率,将死亡率数据带入构建的回归方程中,分别计算出安龙褐飞虱田间种群对5种杀虫剂的推测抗性倍数。通过比较推测抗性倍数与稻苗浸渍法测得的实测抗性倍数,验证使用诊断剂量评估褐飞虱抗性水平的准确性。
1.6 数据分析
死亡率通过对照死亡率进行校正,LC50和LD90值及95%置信区间、斜率、卡方值和自由度等通过DPS 19.05软件进行计算。采用IBM SPSS 20.0软件分析死亡率与抗性倍数之间的相关性,P<0.05表明两者之间相关性显著。
2 结果
2.1 5种杀虫剂对褐飞虱的诊断剂量
结果表明,吡虫啉、啶虫脒、醚菊酯、毒死蜱和异丙威对褐飞虱室内敏感种群(SS)3龄若虫的LD90分别为30.96, 92.05, 117.24, 514.21和1.24 ng/cm2(表1)。采用上述LD90剂量作为诊断剂量制作快速检测试剂盒并分别处理敏感种群,1 h后试虫校正死亡率介于86.25%~93.75%之间(接近90%)(表2),表明上述诊断剂量准确合理,制作的快速检测试剂盒可用于测定田间褐飞虱种群的抗药性水平。
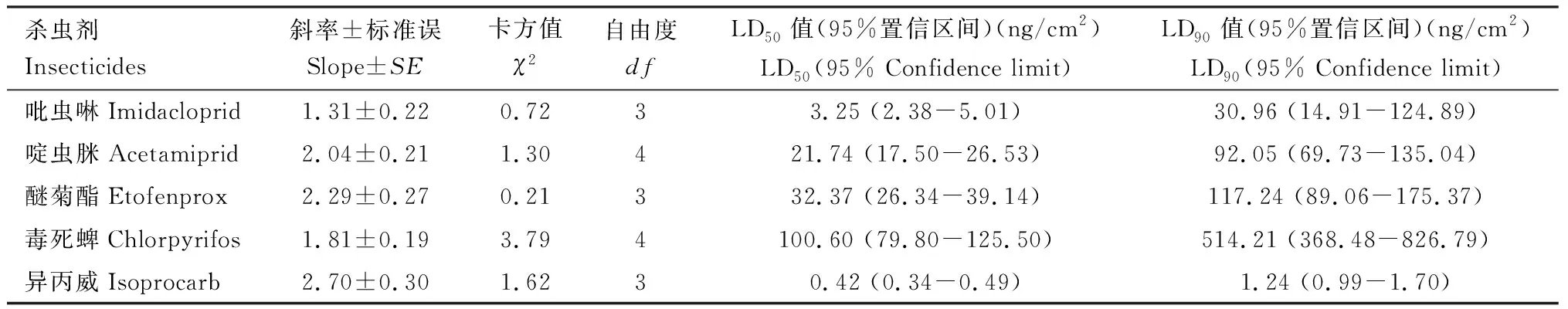
表1 玻璃瓶药膜法测定5种杀虫剂处理1 h时对褐飞虱室内敏感种群(SS) 3龄若虫的毒力Table 1 Toxicity of five insecticides to the 3rd instar nymphs of the laboratory susceptible strain (SS)of Nilaparvata lugens determined by the glass vial method at 1 h after treatment
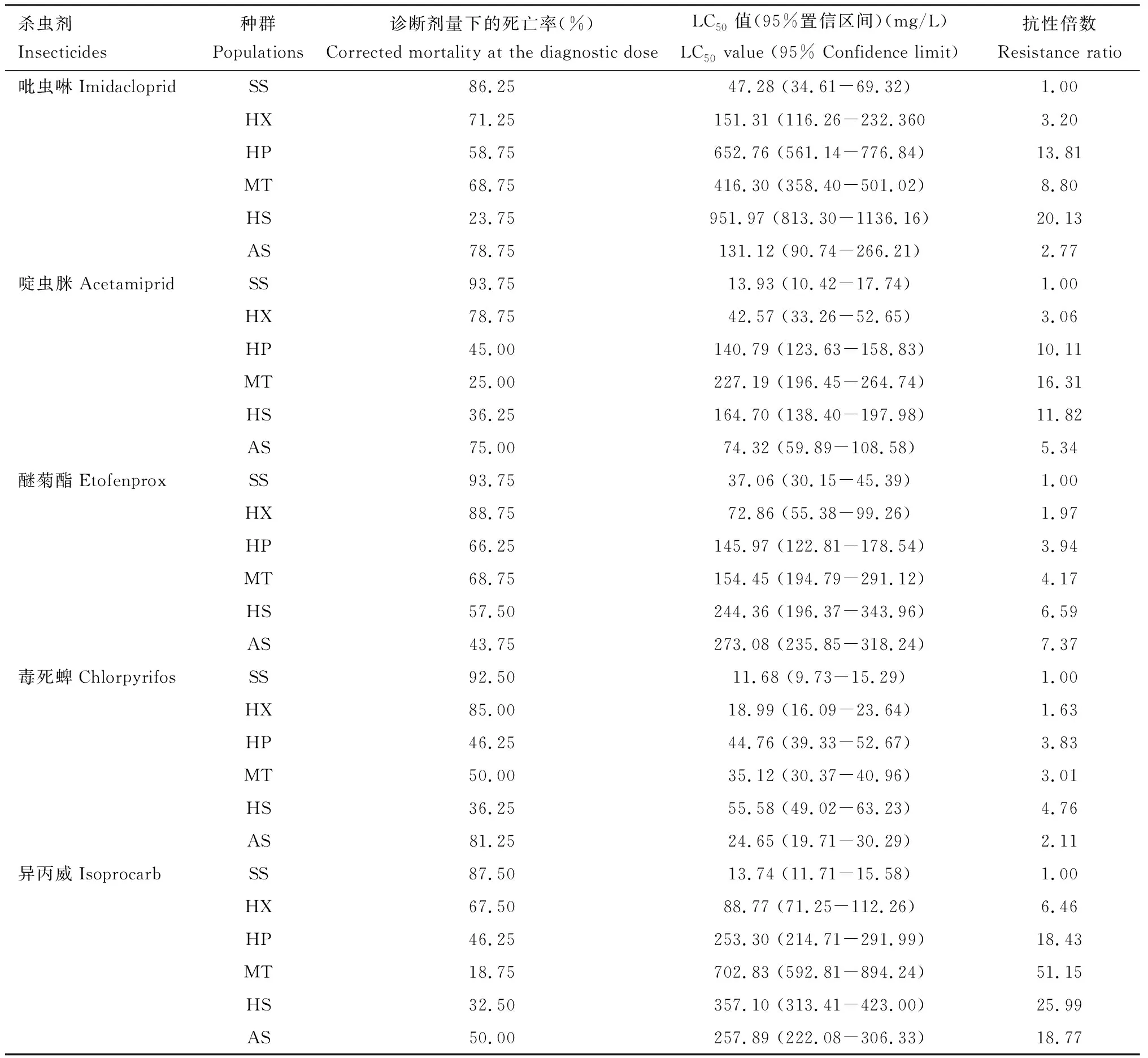
表2 褐飞虱田间种群3龄若虫在5种杀虫剂诊断剂量(LD90)下的校正死亡率及稻苗浸渍法抗性水平测定Table 2 Corrected mortalities of the 3rd instar nymphs of the field populations of Nilaparvata lugens exposed to fiveinsecticides at the diagnostic doses (LD90) and the resistance levels determined by the rice seedling dipping method
2.2 采用诊断剂量快速测定褐飞虱田间种群抗性水平
使用经药膜法测定的5种杀虫剂诊断剂量分别处理不同田间褐飞虱种群,以快速评估褐飞虱的抗性水平。以吡虫啉诊断剂量(30.96 ng/cm2)试剂盒药膜瓶分别处理安顺、花溪、湄潭、黄平、惠水褐飞虱田间种群3龄若虫,1 h后5个种群的校正死亡率分别为78.75%, 71.25%, 68.75%, 58.75%和23.75%,表明不同田间种群褐飞虱对吡虫啉的敏感性不同;通过稻苗浸渍法测得吡虫啉对上述5个田间种群褐飞虱的LC50值分别为131.12, 151.31, 416.30, 652.76和951.97 mg/L,与敏感种群相比,抗性倍数依次是2.77, 3.20, 8.80, 13.81和20.13倍(表2);以上两种方法得到的田间种群对吡虫啉敏感性变化趋势一致。因此,可采用该诊断剂量快速测定褐飞虱田间种群对吡虫啉的敏感性。此外,通过快速检测试剂盒和稻苗浸渍法测定的5个褐飞虱田间种群对其他4种杀虫剂的敏感性变化趋势也表现高度一致(表2)。结果表明,该试剂盒可在1 h快速诊断田间褐飞虱种群对5种杀虫剂的抗性水平。
2.3 快速检测试剂盒准确性的验证
结合田间种群在诊断剂量下的死亡率和实测抗性倍数(稻苗浸渍法测定并计算获得),得到不同杀虫剂的死亡率-抗性倍数线性回归方程(图1),并进行相关性分析。结果表明,褐飞虱田间种群3龄若虫在快速检测试剂盒诊断剂量下的死亡率与吡虫啉(r=-0.949;P=0.004)、啶虫脒(r=-0.988;P=0.000)、醚菊酯(r=-0.979;P=0.001)、毒死蜱(r=-0.969;P=0.001)和异丙威(r=-0.935;P=0.006)的实测抗性倍数之间呈显著负相关(表3)。此外,采用2021年贵州安龙褐飞虱田间种群进一步验证了试剂盒的准确性。在吡虫啉、啶虫脒、醚菊酯、毒死蜱和异丙威的诊断剂量下,安龙田间种群褐飞虱3龄若虫的死亡率分别为67.50%, 78.75%, 70.00%, 42.50%和36.25%(表4)。根据所拟合的褐飞虱田间种群在诊断剂量下的死亡率与实测抗性倍数的相关性方程,计算得到安龙褐飞虱种群对5种杀虫剂的推测抗性倍数介于3.68~31.18倍之间(表4),与采用稻苗浸渍法实测的抗性倍数(介于3.71~26.56倍)变化趋势一致,且两组数据显著相关(r=0.997;P=0.000);另外,从图1中可以看出安龙种群褐飞虱对5种杀虫剂的推测抗性倍数均在各拟合方程的95%置信区间内(图1)。结果表明,采用室内敏感种群死亡率确定的杀虫剂诊断剂量制备的快速检测试剂盒具备较高的检测准确性,结合在杀虫剂诊断剂量下的死亡率和前期建立的死亡率与抗性倍数的相关性方程,可实现褐飞虱田间种群对以上5种杀虫剂抗性倍数的估算及抗性水平的快速评价。
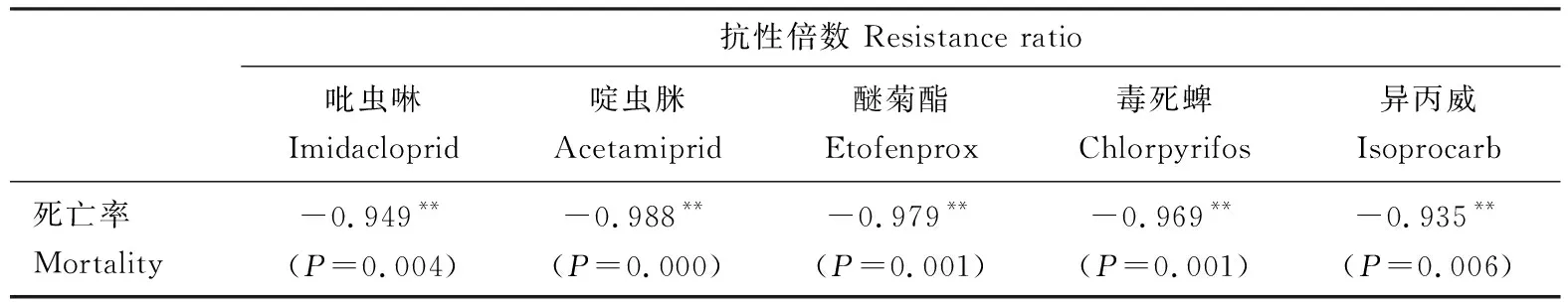
表3 5种杀虫剂诊断剂量下田间褐飞虱种群3龄若虫死亡率和抗性倍数的相关性Table 3 Pairwise correlation coefficient comparison between the mortalities of the 3rd instarnymphs of field populations of Nilaparvata lugens exposed to five insecticidesat the diagnostic doses and the resistance ratio
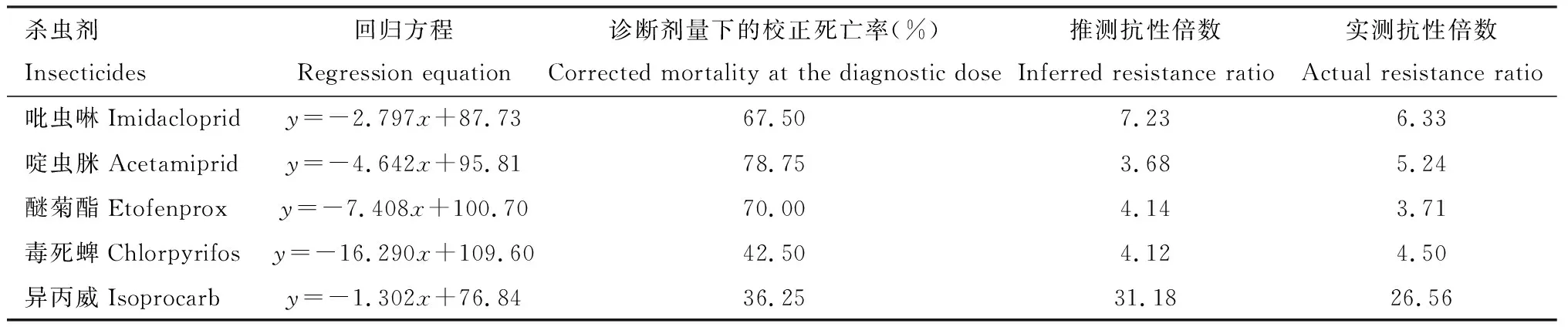
表4 采用快速检测试剂盒测定贵州安龙种群褐飞虱抗性水平的准确性验证Table 4 Verification of the accuracy of the rapid detection kit in determining resistance levelsin Anlong populations of Nilaparvata lugens in Guizhou
3 结论与讨论
本研究建立了一种褐飞虱抗药性水平快速检测方法,并研制出用于检测褐飞虱对5种稻田常用杀虫剂的抗药性快速检测试剂盒。通过与传统生物测定结果的比较,验证了该试剂盒的有效性和准确性。
该检测试剂盒是在玻璃瓶药膜法的基础上开发的,玻璃瓶药膜法是诊断杀虫剂敏感性的有效途径之一,主要针对一些个体相对较小的昆虫,如大豆蚜Aphisglycines(Hansonetal., 2017; Ribeiroetal., 2018)、油菜露尾甲Meligethesaeneus(Slateretal., 2011)、西花蓟马Frankliniellaoccidentalis(Kwonetal., 2015)、 柑橘木虱Diaphorinacitri(Kangaetal., 2016)和斑翅果蝇Drosophilasuzukii(Van Timmerenetal., 2019)等。 玻璃瓶药膜法具有快速诊断的特点,回归方程来自图1。这里x为推测的抗性倍数,y为诊断剂量下的校正死亡率。实际抗性倍数=田间种群LC50值/敏感种群LC50值。Regression equations are from Fig. 1. Here,xis the inferred resistance ratio, andyis the corrected mortality at the diagnostic dose. Actual resistance ratio=LC50value of field population/LC50value of the susceptible strain.
Denlinger等(2016)的研究中巴氏白蛉Phlebotomuspapatasi和长须白蛉Lutzomyialongipalpis对有机磷类和氨基甲酸酯类杀虫剂的最短诊断时间仅为30 min。长期以来,褐飞虱田间种群的抗药性监测主要采用稻苗或稻茎浸渍法等,该类方法是通过杀虫剂的内吸、触杀及胃毒作用来对褐飞虱进行毒力测定,虽然可以模拟田间昆虫对药剂的接触和取食过程,且检测结果准确性高,但需要花费较长时间(包括昆虫饲养时间)。抗性检测的时效性差往往导致有效防治的行动滞后,同时增加了抗性昆虫繁殖、扩散的风险。稻苗浸渍法反映了杀虫剂对褐飞虱的胃毒和触杀毒力,而玻璃瓶药膜法主要评价杀虫剂的触杀毒力。对于致死作用快、触杀毒力强的神经毒剂(如吡虫啉、毒死蜱、醚菊酯等)利于进行快速检测,而对于致死速率较慢的昆虫生长调节剂(噻嗪酮)和口针阻塞剂(吡蚜酮)等则不能使用药膜法进行快速检测。本研究通过测定褐飞虱接触杀虫剂1 h的死亡率(表1),以及构建的死亡率-抗性倍数回归方程(图1),可快速检测出田间褐飞虱的推测抗性倍数,由于拟合回归方程所用数据有限,在本研究所涉抗性倍数范围内的推测抗性水平结果准确性较好,而在此范围外的抗性倍数推测结果的准确性可能稍差。
对于杀虫剂的诊断剂量,不同昆虫种类和不同作用方式的杀虫剂有所差异。殷劭鑫等(2016)在使用诊断剂量处理小菜蛾Plutellaxylostella时,死亡率低于80%是害虫产生抗药性的信号。对于媒介蚊虫,WHO(2013)明确当其对杀虫剂的死亡率低于90%时,则存在抗性;Denlinger等(2016)也指出,由剂量-存活率曲线确定的50%, 90%和95%的致死浓度可以作为诊断剂量的起点;Eiden等(2016)也采用敏感种群LC90, LC99, 2×LC99及4×LC99值作为诊断剂量测定昆虫对杀虫剂敏感性的研究。本研究通过玻璃瓶药膜法,建立吡虫啉、毒死蜱等5种褐飞虱常用杀虫剂对褐飞虱室内敏感种群的LC90值作为诊断剂量(表1),利用5个田间种群建立死亡率-抗性倍数的线性方程(图1);且2021年安龙田间种群验证结果(表4)表明,通过检测试剂盒测定的死亡率及拟合方程计算的推测抗性倍数与稻苗浸渍法测定的抗性倍数之间没有明显差异,验证了这5种抗药性快速检测试剂盒的准确性。
在害虫的抗性治理过程中,通常需要快速、准确的抗药性监测方法来评估害虫对杀虫剂的敏感性水平(Matsumuraetal., 2014; Maoetal., 2019),防治药剂的不合理选用不仅具有直接导致田间害虫防治失败的风险,同时存在害虫抗性发展加快和农药环境污染加剧的风险。本研究中的检测试剂盒可以快速评价褐飞虱田间种群对多种常用药剂的抗性水平,能够科学指导防治药剂的选择,从而提高杀虫剂的使用效率。抗药性快速检测方法的推广应用,能够帮助植保工作人员及时制定科学、高效的害虫防治方案,为农业有害生物科学防控及抗性综合治理提供技术手段。
