药用昆虫喙尾琵琶甲肠道抗菌活性放线菌的筛选及鉴定
2022-10-18王明明殷鹏凯李铭晖杨自忠杨大松杨银河
王明明, 殷鹏凯, 李铭晖, 杨自忠, 杨大松, 杨银河
(大理大学药学院, 云南省昆虫生物医药研发重点实验室, 云南大理 671000)
昆虫是自然界中个体数量最多、种类最丰富的生物。生活习性不同、生存环境多样、肠道环境复杂等因素导致了昆虫的肠道共生菌具有一定特殊性(Liuetal., 2021)。而且,昆虫肠道微生物在抵御外来病原微生物入侵方面发挥十分重要的作用(Zhangetal., 2018; Jang and Kikuchi, 2020)。有研究者已从蜣螂Copristripartitus(Umetal., 2015)、埋葬甲虫(Heiseetal., 2019)、白蚁(未建华等, 2019)、蜻蜓、蟋蟀(徐晓等, 2018)等昆虫肠道微生物中分离得到结构新颖且具有显著抗菌活性的代谢产物。
有文献报道,一些药用植物内生菌能产生与宿主相同或相似药理活性的次生代谢产物(方霞等, 2016)。喙尾琵琶甲Blapsrynchopetera俗名臭壳子,属鞘翅目(Coleoptera)拟步甲科(Tenebrionidae)琵琶甲属Blaps,广泛分布于云南各地,生态幅度较宽,具有较强的适应性,在云南民间长期被作为一种抗菌消炎的药物使用(赵敏等, 2007; Liuetal., 2019)。而且,喙尾琵琶甲作为杂食性昆虫,其肠道微生物种类丰富且存在激烈的生存竞争,可能是获得产生良好抗菌活性物质的微生物新资源。目前,国内外对其的研究主要集中在虫体提取物及防御液的抗菌、抗肿瘤等药理活性方面(施贵荣等, 2012; Xiaoetal., 2018; Xuetal., 2019),缺乏对其肠道微生物的研究。
本研究首次对喙尾琵琶肠道共生放线菌进行探索,分离到176株放线菌。以9株常见致病菌为指示菌株,采用牛津杯琼脂扩散法进行测试,寻找具有抗菌活性的放线菌,结果显示46株放线菌具有抗菌活性;最后通过分子生物学方法鉴定,明确18株具有显著抗菌活性的放线菌均为链霉菌属Streptomyces。本研究有助于药用昆虫喙尾琵琶甲肠道放线菌资源的进一步开发利用,也为后续从喙尾琵琶甲肠道这一特殊生境中获得具有显著抗菌活性且结构新颖的次生代谢产物奠定了理论基础。
1 材料与方法
1.1 供试昆虫与致病菌
2020年8月于云南省大理白族自治州大理市满江区农作物田地内捕捉昆虫成虫。成虫由大理大学昆虫生物医药研发重点实验室杨自忠教授根据形态特征进行鉴定(任国栋等, 2016),鉴定为喙尾琵琶甲Blapsrynchopetera。
5株致病细菌耐甲氧西林金黄色葡萄球菌(methieillin-resistantStaphylococusaureus, MRSA)(ATCC43300)购自广东省科学院微生物研究所,金黄色葡萄球菌(ATCC25923)、大肠杆菌Escherichiacoli(ATCC25922)、粪肠球菌Enterococcusfaecalis(ATCC47077)和铜绿假单胞菌Pseudomonasaeruginosa(ATCC9027)以及3株致病真菌黑曲霉Aspergillusniger(BNCC186380)、青霉菌Penicilliumexpansum(BNCC117714)、白色念珠菌Canidiaalbicans(ATCC10231) 由昆虫生物医药研发重点实验室菌种储藏库提供,致病细菌鼠伤寒沙门氏菌Salmonellatyphimurium(BNCC103281)购自北纳生物科技有限公司。
1.2 试剂与仪器
放线菌分离培养基为高氏一号(GS)培养基(广东环凯微生物科技有限公司),添加35 mg/L的重铬酸钾,抑制真菌和其他细菌的生长;放线菌纯化培养基为不含抑制剂的高氏一号培养基;活化病原菌及抗菌活性筛选培养基为马铃薯葡萄糖(PDB)培养基、胰蛋白胨酵母(LB)培养基(广东环凯微生物科技有限公司)和脑心浸出液(BHI)培养基(北京陆桥技术股份有限公司)。阳性药品试剂包括盐酸万古霉素(vancomycin hydrochloride)、青霉素G钠(penicillin G sodium)和制霉菌素(nystatin)均为上海麦克林生化科技有限公司产品,氯霉素(chloramphenicol)为阿拉丁试剂(上海)有限公司产品。
主要试剂包括琼脂粉(广东环凯微生物科技有限公司),冰醋酸、乙酸乙酯和甲醇(天津市风船化学试剂科技有限公司),重铬酸钾(西陇科学股份有限公司),细菌基因组提取试剂盒及PCR相关试剂(天根生化科技有限公司),通用引物为北京六合华大基因科技有限公司合成。
主要设备包括洁净工作台(苏州安泰空气技术有限公司),振荡培养箱(上海旻泉仪器有限公司),生化培养箱(上海龙跃仪器设备有限公司),立式压力蒸汽灭菌器(上海博讯医疗生物仪器股份有限公司),电子天平(杭州万特衡器有限公司),My Cycler PCR(美国BIO RAD),CYY-7C电泳仪电源(北京市六一仪器厂),水浴锅(上海精宏实验设备有限公司)。
1.3 肠道解剖及肠道共生放线菌的分离与纯化
将20头喙尾琵琶甲成虫装入玻璃瓶置于-20℃冰箱30 min后,向玻璃瓶中加无菌水,摇晃2 min,清洗昆虫表面。将清洗后的试虫放在洁净工作台内。每个样品分别用3.5%次氯酸钠溶液浸泡1 min, 75%乙醇浸泡3 min,消除昆虫体表微生物,然后用无菌水反复冲洗,晾干。用无菌手术剪解剖虫体,再使用无菌手术镊将整个肠道取出置于灭菌的离心管内。为了保证在解剖过程中肠道不受昆虫表面细菌的干扰,将最后一次清洗昆虫的无菌水均匀地涂抹在没有添加K2Cr2O7的高氏一号琼脂培养基上,在28℃的培养箱中培养7 d,培养基上没有任何微生物生长。
将20个肠道混为一个样称重后研磨,并用无菌水依次稀释至10-6g/mL浓度,取10-2~ 10-6g/mL不同浓度的稀释液各100 μL均匀涂布于含有35 mg/L K2Cr2O7的高氏一号培养基 (筛选放线菌)平皿上,每个浓度做3个平行实验,同时设培养基空白对照和无菌水对照。将平皿倒置于生化培养箱中,于28℃培养4 d后,每隔24 h开始观察一次微生物生长情况,选择最合适稀释度的平板,通过菌落形态、大小、颜色、质地、光泽、等特征,挑取不同的单菌落进行分离。在不含抑制剂的高氏一号培养基平皿上进行喙尾琵琶甲肠道共生放线菌的纯化,直至获得单一菌株。最后,将纯化后的菌株接种至高氏一号培养基上再培养,用50%甘油将生长出来的放线菌制成菌液,于-80℃保存备用。
1.4 肠道共生放线菌抗菌活性筛选
每株放线菌采取连续划线法,扩培10个平皿进行小规模发酵,14 d后将长满放线菌的培养基切成1 cm左右大小的方块,使用乙酸乙酯∶甲醇∶冰醋酸=80∶15∶5的配比液重复浸泡提取3次,减压浓缩提取液获得粗提物。采用牛津杯法(佘之蕴等, 2016)检测各菌株次生代谢产物粗提物的抗细菌活性:粗提物和阳性药盐酸万古霉素、氯霉素、青霉素G钠用甲醇依次调整为20 mg/mL, 150 μg/mL, 200 μg/mL和150 μg/mL的浓度。将MRSA、金黄色葡萄球菌、大肠杆菌、鼠伤寒沙门氏菌、铜绿假单胞菌接种在LB液体培养基,粪肠球菌接种在BHI液体培养基,在震荡培养箱中以37℃ 180 r/min的条件培养4 h,调整菌体浓度为(3~5)×106CFU/mL的菌悬液。吸取100 μL菌悬液均匀涂布于对应的LB和BHI琼脂培养基平板上,用无菌镊子将牛津杯(直径8 mm)轻轻放置于平皿上,向其中加入100 μL的各菌株粗提物、对应阳性药及阴性对照甲醇。将平皿轻轻放于4℃冰箱中扩散4 h左右后置于37℃下培养12 h观察抑菌圈,测量并记录抑菌圈直径大小,每组进行3次平行实验。
采用牛津杯法检测各菌株次生代谢产物粗提物的抗真菌活性:粗提物、制霉菌素用甲醇依次调整为20和1 mg/mL的浓度。黑曲霉和青霉菌提前接种在PDA培养基上在28℃的生化培养箱中培养5 d,实验前加入PDB培养基制备菌悬液;将白色念珠菌接种在PDB液体培养基中,在震荡培养箱中以28℃ 200 r/min的条件培养4 h,调整菌体浓度为(3~5)×106CFU/mL的菌悬液。吸取100 μL菌悬液均匀涂布于PDA培养基平皿上,用无菌镊子将牛津杯 (直径8 mm) 轻轻放置于平皿上,向其中加入100 μL的各菌株粗提物、制霉菌素及阴性对照甲醇。将平皿轻轻放于4℃冰箱中扩散4 h左右后置于28℃下培养,24 h后观察接种白色念珠菌的平皿上的抑菌圈,48 h后观察接种青霉菌和黑曲霉平皿的抑菌圈,测量并记录抑菌圈直径大小,每组进行3次平行实验。
1.5 肠道放线菌16S rRNA基因测序
根据抑菌圈大小筛选抗菌活性较强的放线菌。按照细菌基因组提取试剂盒说明书步骤提取这些放线菌的DNA。使用通用引物27F(5′-AGAGTTTGA TCCTGGCTCAG-3′)和 1492R(5′-TACGGCTACCT TGTTACGACTT-3′)(Ballavetal., 2015)扩增16S rRNA基因。PCR反应体系(30 μL): Super Mix 15 μL, 上下游引物(10 pmol/L)各1 μL, 模板DNA 1 μL, ddH2O 12 μL。PCR反应程序: 96℃ 5 min; 96℃ 20 s, 62℃ 20 s, 72℃ 30 s, 共35个循环;72℃ 10 min。3 μL PCR产物进行1.0%的琼脂糖凝胶电泳检测后,委托北京六合华大基因科技有限公司进行基因测序。
1.6 肠道放线菌基于16S rRNA基因序列的分子鉴定和系统发育树分析
测序后,将拼接好的16S rRNA基因序列结果与NCBI数据库中的序列进行Blast比对,下载与菌株同源性高的序列作为参照序列,并运用MEGA 7 (Kumaretal., 2016)软件采用邻接(neighbor-joining)法(Saitou and Nei, 1987)构建系统发育树,根据菌株间的亲缘关系确定各菌株种属分类情况。最后将序列提交至GenBank数据库。
2 结果
2.1 肠道放线菌菌株的分离和纯化
从喙尾琵琶甲肠道中分离到共生放线菌176株,编号为BPA1-BPA175和BPA187,保存于大理大学昆虫生物医药研发重点实验室109室-80℃超低温冰箱内。
2.2 放线菌抗菌活性筛选
为了确保实验数据的有效性,每个平板都根据指示菌株设置了阳性药组,阳性药的抑菌圈直径大小见表1。
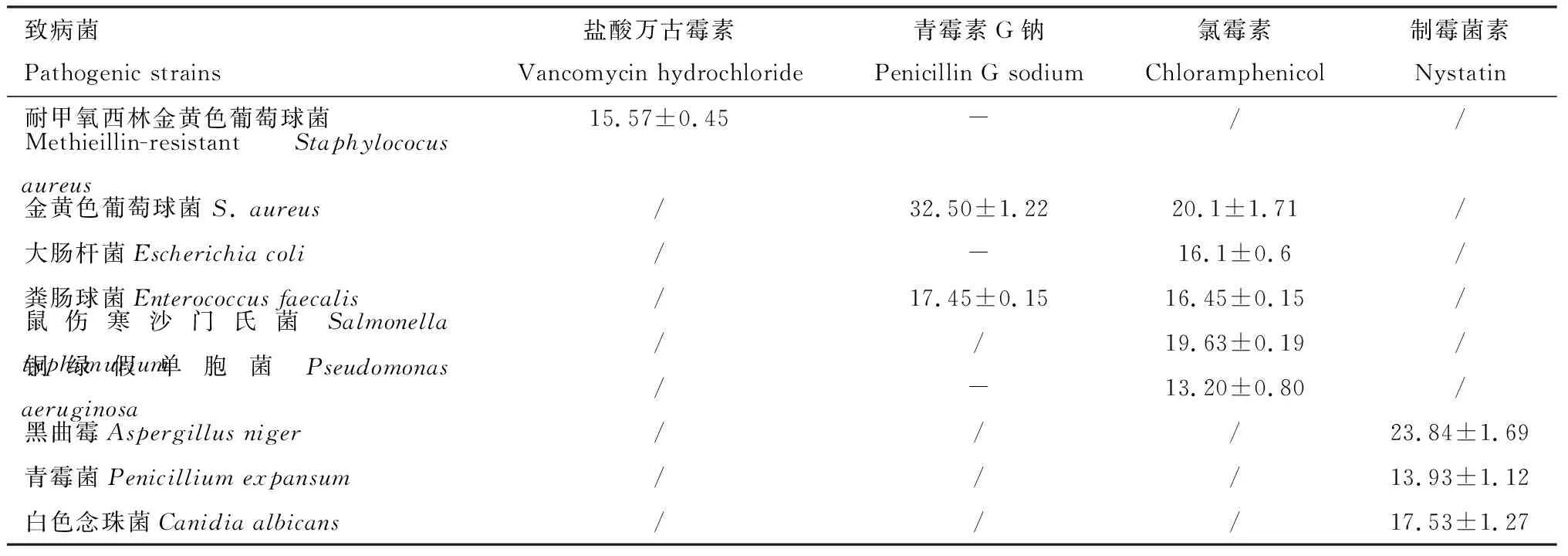
表1 阳性药对致病菌的抑菌圈直径(mm)Table 1 Inhibition zone diameters (mm) of positive drugs against pathogenic bacteria
176株肠道共生放线菌中有25株放线菌对致病细菌表现出不同程度的抑菌作用,其中14株对致病细菌显示出较强的抑菌活性(抑菌圈直径>15 mm),菌株BPA2, BPA8, BPA49和BPA71具有广谱抗细菌活性,对6株致病细菌均有抑制作用,其次为BPA44和BPA62,对铜绿假单胞菌之外的5株致病细菌均有抑制作用,而BPA14, BPA59, BPA134, BPA152, BPA160和BPA187仅对MRSA具有较强的抑菌作用,具体抑菌圈直径如表2所示。 图1(A-F)示使用牛津杯法部分喙尾琵琶甲肠道放线菌(BPA160, BPA71, BPA49和BPA62)粗提物抑制6株致病细菌。
在抗真菌的实验中,总共有37株放线菌表现出抑菌活性,具有显著抗真菌活性(抑菌圈直径>15 mm)的菌株共有11株。其中,BPA8对黑曲霉、青霉菌和白色念珠菌3种真菌均有显著抑菌活性,BPA82对黑曲霉及白色念珠菌具有显著抗菌活性,BPA46, BPA47, BPA59和BPA84 4株放线菌仅对白色念珠菌具有显著抑制作用,而BPA49, BPA62, BPA71, BPA95和BPA100 5株放线菌仅对黑曲霉有较强的抑制作用,具体抑菌圈直径如表3所示。图1(G-I)示使用牛津杯法部分放线菌(BPA59, BPA62和BPA8)粗提物抑制3株致病真菌。
2.3 具有较强抗菌活性菌株的生长形态、分子鉴定及系统发育树
综合表2和表3可知,具有较强抗菌活性(抑菌圈直径≥15 mm)的肠道放线菌共有18株,编号依次为BPA2, BPA8, BPA14, BPA44, BPA46, BPA47,BPA49, BPA59, BPA62, BPA71, BPA82, BPA84, BPA95, BPA100, BPA134, BPA152, BPA160和BPA187,生长形态见图2。系统发育树(图3) 表明, 具有显著抗菌活性的放线菌均属于链霉菌属Streptomyces,其中具有广谱抗菌活性的菌株BPA8与链霉菌(MH817402)及淡紫灰链霉菌S.lavendulae(MN540709)的16S rDNA序列一致性分别达99.73%和99.66%,BPA49与球孢链霉菌S.globisporus(MH384424)的序列一致性达99.72%,BPA71与沙阿霉素链霉菌S.zaomyceticus(EF063456)的序列一致性达99.93%。将18株放线菌序列提交至GenBank数据库,登录号为OL780327-OL780344。
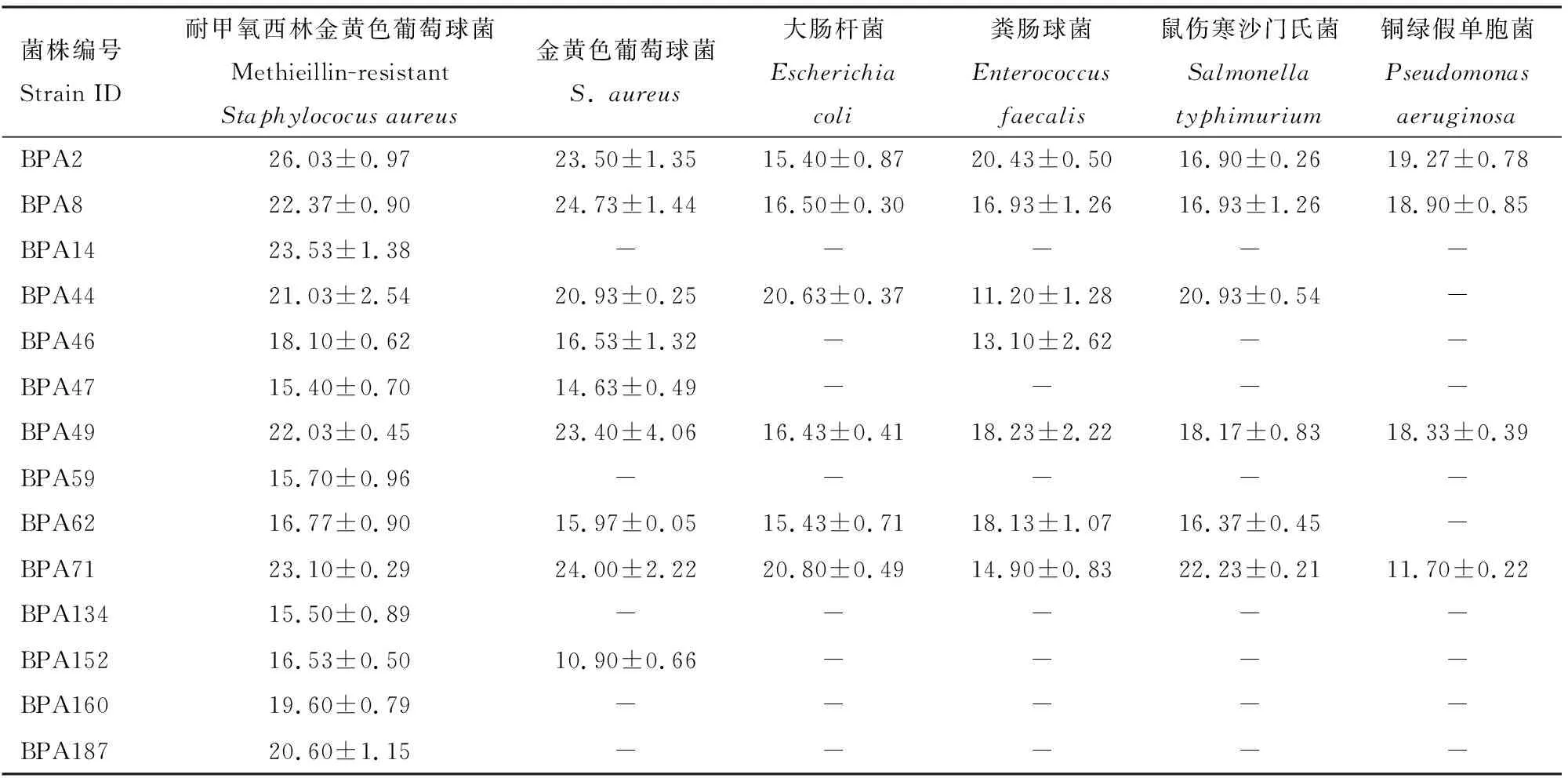
表2 喙尾琵琶甲成虫肠道中具有显著抗菌活性的放线菌对致病细菌的抑菌圈直径(mm)Table 2 Inhibition zone diameters (mm) of actinomycetes with significant antibacterial activitiesin the gut of Blaps rynchopetera adults
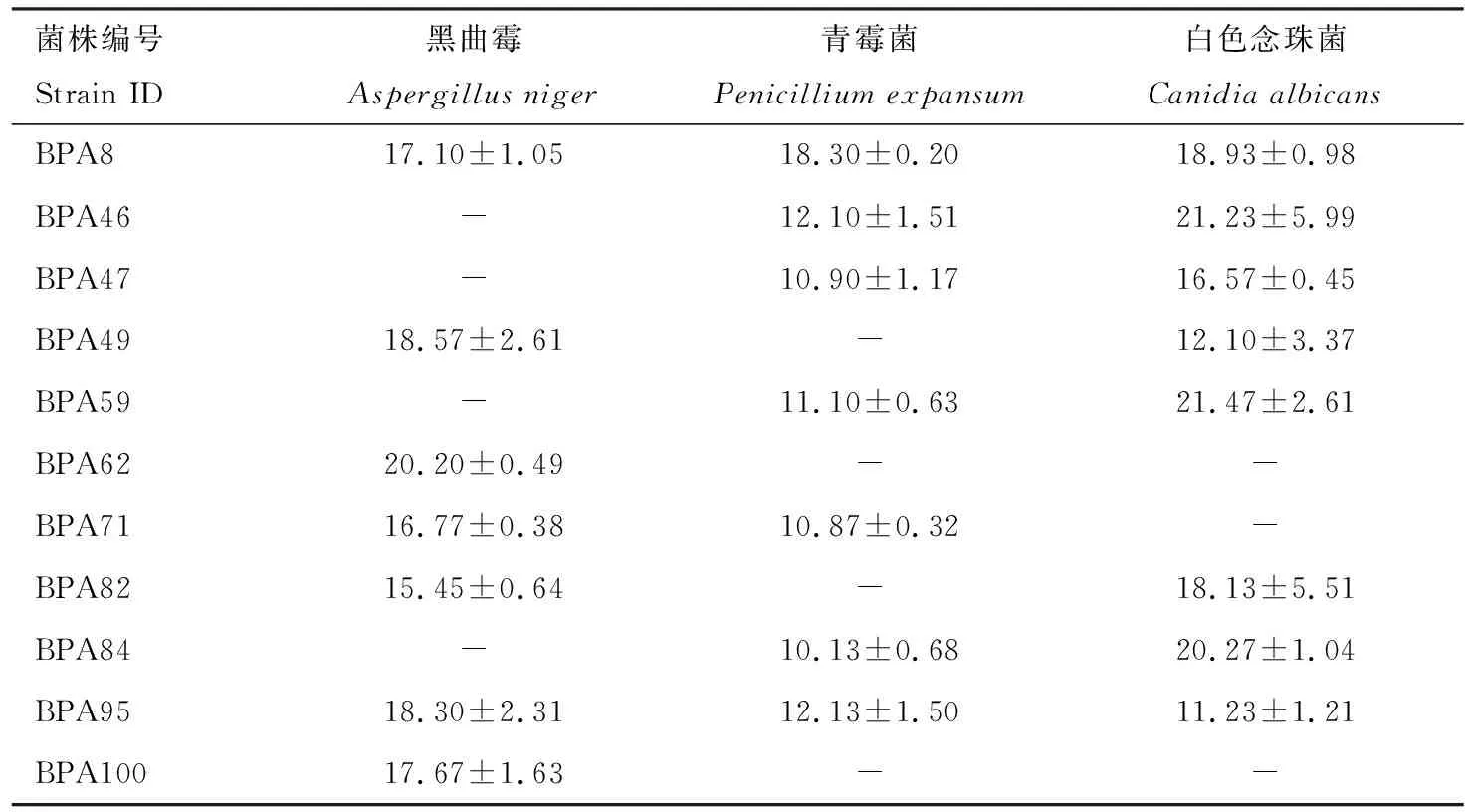
表3 喙尾琵琶甲成虫肠道中具有显著抗菌活性的放线菌对致病真菌的抑菌圈直径(mm)Table 3 Inhibition zone diameters (mm) of actinomycetes with significantantifungal activities in the gut of Blaps rynchopetera adults
3 讨论
和许多昆虫一样,喙尾琵琶甲肠道中存在许多具有抗菌活性的微生物帮助宿主抵御外来病原菌的入侵。在本研究中,其肠道放线菌的抗菌活性筛选对后续寻找明确的抗菌活性物质具有重要的指导意义。许多研究者将不同昆虫肠道微生物作为寻找新型抗菌物质的重要来源之一。方霞等(2016)在药用昆虫美洲大蠊Periplanetaamericana的肠道中分离得到159株放线菌,分属于12个属9个科。随后在美洲大蠊肠道放线菌活性筛选与鉴定的研究中,发现45株放线菌对白色念珠菌、红色毛癣菌、黑曲霉、烟曲霉等人体常见致病真菌具有拮抗作用,其中链霉菌占比71.11%(曾还雄等, 2018)。此外,在甲虫类昆虫共生微生物的化学研究中也发现了一些结构新颖的抗菌化合物,例如,从埋葬甲虫肠道放线菌UTG9中分离到对革兰阳性菌具有抗菌活性的氯代环肽(Shinetal., 2017)。
放线菌是微生物来源的临床药物的主要来源(任建委和杜宝中, 2020)。目前关于喙尾琵琶甲肠道微生物的研究还未见报道,本研究对20头喙尾琵琶甲肠道的混合样品中的放线菌进行分离培养,获得176株形态或代谢物颜色有差异的放线菌,说明该特色生境中可培养的放线菌资源比较丰富。但由于培养条件比较单一,难以模拟昆虫肠道的环境,仍有大量未知放线菌未被分离培养,后续,我们可以采用不同的分离培养基和培养条件,以期获得更多的放线菌资源。
根据全国细菌耐药监测网数据显示,MRSA在临床中仍是检出率最高的耐药致病菌(全国细菌耐药监测网, 2021)。在本研究中,通过牛津杯琼脂扩散法筛选了176株肠道放线菌的代谢产物对9株常见致病菌的抗菌作用。抑菌实验结果显示(表2和3),有23株放线菌显示对MRSA致病菌有抑菌作用,26.1%的放线菌对致病菌具有不同程度的抑菌作用,18株放线菌的抑菌活性较为显著(图2)。通过16S rRNA测序和BLAST比对发现18株抗菌活性较强的菌株均隶属于链霉菌属(图3)。链霉菌属是最高等的放线菌,我们推测这些活性链霉菌可能会产生具有抗菌活性的天然物质,从而有助于喙尾琵琶甲预防外来病原菌的定殖。本研究以9株常见致病菌为指示菌株,筛选到具有较强抗菌活性的链霉菌,为进一步分离药用昆虫喙尾琵琶甲肠道放线菌的生物活性物质打下基础,也为抗菌药物研发提供了新的放线菌资源。
