ITGA2表达增加与胰腺癌的进展和预后不良相关研究
2022-10-17吕朝旭
吕朝旭,史 恺
(攀枝花学院 基础医学院,四川 攀枝花 617000)
胰腺癌是最常见的致死性癌症之一,其恶性程度高、治疗效果差,对全世界居民健康及生活质量都造成了严重危害。在全球,因癌症导致的死亡率中,胰腺癌排名第四位。据统计,2019年有56 770例胰腺癌患者被确诊,其中约 45750 名患者死于胰腺癌[1]。2013年签署的顽固性癌症研究法案预估到2030年,胰腺癌将成为仅次于肺癌的第二大致死性癌症[2]。对于胰腺癌患者来说,及时的手术治疗及相应的辅助化疗对于患者预后的恢复至关重要,而超过80%的胰腺癌患者由于确诊时间晚,肿瘤细胞已发生晚期转移而不适合手术治疗[3]。晚期诊断、早期转移和不同程度的药物抵抗是胰腺癌死亡的三个主要原因[4]。
由于早期胰腺癌没有特异性症状及敏感和特异性的肿瘤标志物,因此超过一半以上的胰腺癌患者被诊断时已经处于晚期转移阶段[5]。从整体上来说胰腺癌患者的五年生存率低于9%,而晚期患者的五年生存率降至3%[4,6]。胰腺导管上皮内瘤变是胰腺癌最常见的前驱病变。虽然及时发现胰腺癌的前驱病变可能对患者的诊断及治疗有很大帮助,但如何尽早发现胰腺癌的前驱病变对于目前的技术来说仍然是一个很大的挑战。手术切除是目前已知的胰腺癌唯一的根治性治疗方案,但未根治性切除的患者总体5年生存率仍低于5%。统计结果表明,80%~90%的胰腺癌患者在诊断时患有无法切除的肿瘤[7]。此外,胰腺癌对许多传统的化疗药物具有抗药性,这些因素使胰腺癌成为严重危害人类健康的疾病之一。因此,早期诊断和检测胰腺癌的前驱病变或寻找新的特异性肿瘤生物标志物并找到及时干预是降低胰腺癌发病率和死亡率的有效的方法[8]。胰腺癌被认为是一种具有高度遗传变异性的疾病,其中包含一些核心基因表达改变[9]。生物信息学分析是目前找出癌症发生发展过程中关键基因的有效方法。
整联蛋白是由α和β亚基组成的异二聚体跨膜受体。据报道,整合素通过将信号分子和衔接蛋白募集到β亚基,有助于调节细胞存活、运动、增殖、粘附、迁移和癌症治疗抗性[10-11]。整合素α2是整联蛋白的α亚单位之一,广泛表达于成纤维细胞、内皮细胞及上皮细胞当中。编码整合素α2蛋白的基因位于5号染色体上,该蛋白由1181个氨基酸组成,作为细胞粘附分子,ITGA2通过与β1亚基非共价结合形成整联蛋白异二聚体,是层粘连蛋白、胶原蛋白、纤连蛋白和E-钙粘蛋白的受体,负责血小板和其他细胞与胶原蛋白的粘附。ITGA2的异常表达与癌症的发生和转移具有显着相关性,包括乳腺癌[12-14]、肠道肿瘤[15]、结直肠癌[16-17]、胃癌[18]、前列腺癌[19]等。但ITGA2的功能存在争议,在不同癌症中充当抑癌基因或癌基因。Anuratha 和 Oliver M.Sieber 揭示 PHLDA1 在肠道肿瘤中作为癌基因发挥作用,部分是通过调节 ITGA2 表达水平介导的,然后促进结肠癌细胞的迁移和增殖[15]。Xu T研究结果表明ITGA2 促进肢端黑色素瘤进展并与肢端黑色素瘤患者的临床预后结果相关20。作为 HMGA2-FOXL2 通路的下游效应分子,ITGA2 在转移性淋巴结和远处转移中增加,这与胃癌患者的总体生存时间缩短有关[18]。以上的研究结果都表明ITGA2在癌症中充当癌基因的角色。而 Ramirez 表明整合素 α2β1 可抑制人类乳腺癌中的乳腺肿瘤[21]。到目前为止,ITGA2 在胰腺癌中的作用及预后尚不清楚。因此,本研究的目的是根据从 TCGA 和 ICGC 数据库获得的胰腺癌表达数据及相应的临床数据来评估 IFGA2 表达在胰腺癌中的角色以及其对胰腺癌预后的关系。
1 材料与方法
1.1 数据下载与统计分析
分别从TCGA数据库、GTEx和ICGC数据库中获得了胰腺组织的mRNA基因表达数据,其中TCGA数据库中包含178个肿瘤组织表达数据和4个正常样本的表达数据,GTEx中包含167个正常的胰腺组织表达数据,ICGC数据库中包含84个肿瘤组织表达数据。同时下载了TCGA和ICGC中胰腺癌患者的相应临床信息,包括性别、年龄、分级、分期等信息以便进一步的数据分析。在分析过程中,一些临床信息不完整的样本被删除。由于 TCGA 中没有足够的正常胰腺组织测序数据,因此我们首先使用相同的归一化方法将 TCGA 和 GTEx 中胰腺组织的测序数据组合在一起,最终获得171个正常胰腺样本和178个癌症样本,然后使用Wilcoxon秩和检验鉴定胰腺癌和正常胰腺组织之间ITGA2表达量的差异。对于临床病理参数与ITGA2表达值之间的关系,则采用 Kruskal-Wallis 检验和逻辑回归进行评估,包括TCGA和ICGC 数据中的分级、分期、T 分期、N 分期和病人的癌症状态。基于Kaplan-Meier曲线分析,我们在R语言中,使用“survival”包研究了 ITGA2 的总体存活率。然后根据ITGA2的中位表达值将TCGA和ICGC患者分为高表达组和低表达组。最后,利用Cox 回归评估了临床病理学特征与 TCGA中胰腺癌患者总生存期之间的关系。根据ITGA2基因的中位表达值,进行多变量Cox分析,比较ITGA2表达对生存的影响以及其他临床特征,如分期、分级、淋巴结转移状态及远处转移状态等。所有统计分析均使用 R(v.3.5.3)进行。
1.2 单基因富集分析
首先根据ITGA2的表达值分别将TCGA队列和ICGC队列中的样本分为高表达组和低表达组。然后使用GSEA软件3.0进行单基因富集分析s-GSEA以识别统计富集的途径。每次分析对预选的基因组进行1000次测序,错误发现率(FDR)值<25%的基因组被认为具有统计学意义。
2 结果
2.1 ITGA2在胰腺癌患者中的过表达
本研究所使用的数据包含来自 TCGA 和 GTEx 的 171 个正常胰腺组织和 178 个胰腺癌组织,以及来自 ICGC 的 84 个胰腺癌组织。TCGA和ICGC患者对应的临床资料见表1。结果显示ITGA2在胰腺癌组织中的表达显著高于正常组织,如图1A所示(p=3.247e-56)。此外,我们通过Oncomine数据库证实了ITGA2在胰腺癌中的表达上调,如图1B所示,倍数变化为8.163,p值=3.41E-8。

表1 TCGA和ICGC数据库中患者的相应临床信息
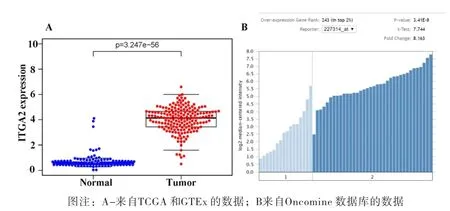
图1 ITGA2在胰腺癌和正常胰腺组织中的表达
2.2 ITGA2表达与临床病理学变量之间的相关性分析
分别采用两种分析方法,Kruskal检验和Logistic回归,对TCGA队列获得的182个胰腺癌样本和从ICGC队列获得的83个胰腺癌样本及其相应的临床病理学变量进行分析,评估ITGA2表达与临床病理变量之间的相关性。结果如图2(A-H)所示。Kruskal检验的结果表明,ITGA2表达增加与某些临床病理变量之间存在明显的关系,例如分级(图2A,p=8.334e-04,TCGA队列;图2F,p=0.027,ICGC队列),TNM分期(图2B,p=0.03,TCGA队列),T分期(图2C,p=0.009,TCGA队列;图2G,p=0.018,ICGC队列),N期(图图2D,p=0.618,TCGA队列;图2H,p=0.559,ICGC队列)和癌症状态(图2E,p=2.758e-06,TCGA队列)。但本次分析的结果显示ITGA2的表达量与N期无相关性。如表2所示,Logistic分析结果回归显示ITGA2表达是一个影响胰腺癌患者预后不良的独立因素。由表2可知,ITGA2高表达与高分期(OR=2.790,Ⅰ期vs.Ⅱ期)、分级(OR=3.000,G1vs.G2;OR=4.79,G1vs.G3)显着相关,癌症状态(OR=3.596,无肿瘤与有肿瘤),这表明具有高ITGA2表达的胰腺癌患者比具有低ITGA2表达的胰腺癌患者更容易进展到更晚期和更高级别。

表2 与临床病理特征相关的TGA2表达(逻辑回归)
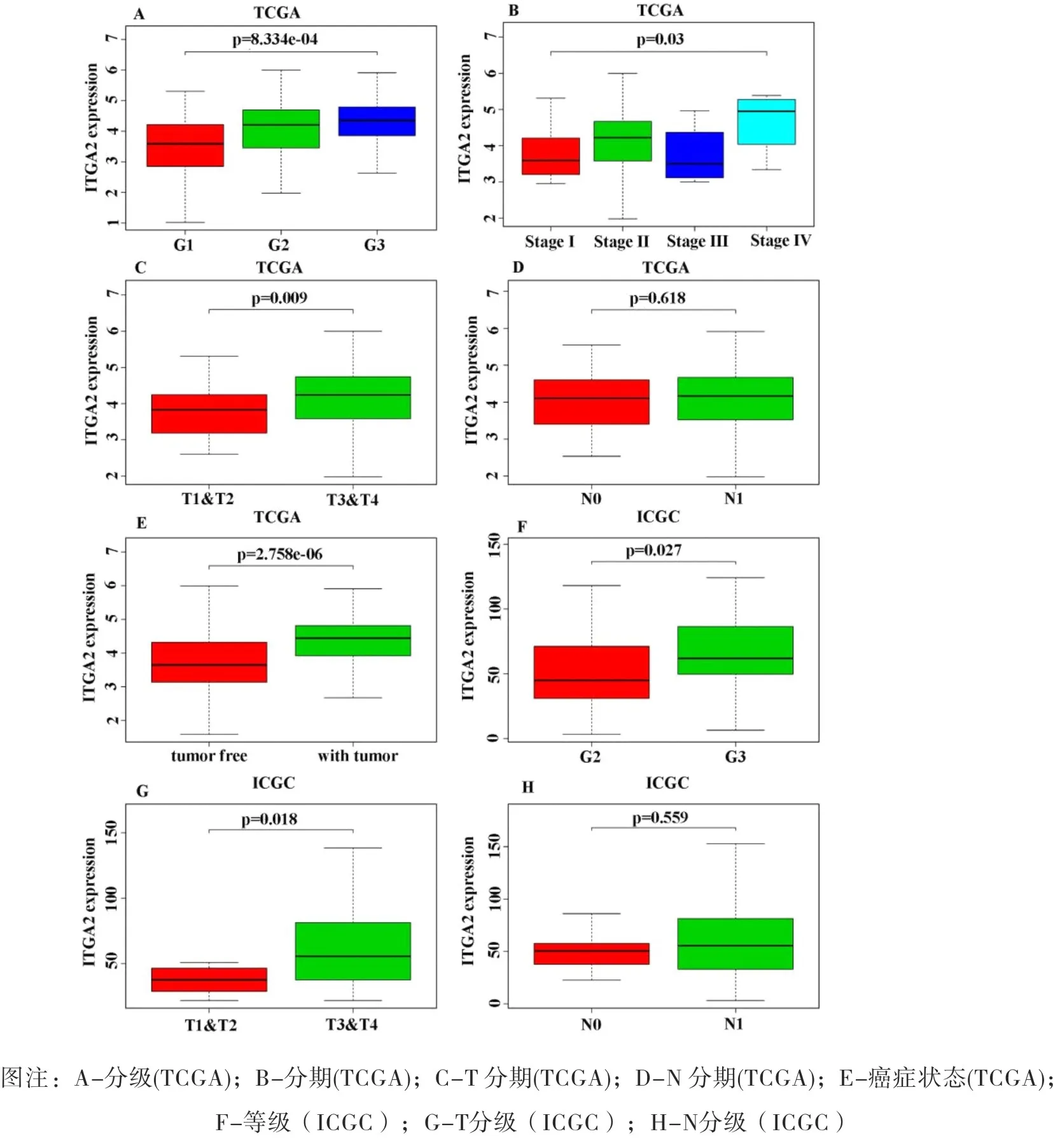
图2 ITGA2表达和临床病理特征的关系
2.3 ITGA2在胰腺癌中表达的预后价值
为了评价ITGA2在胰腺癌中的预后价值,采用Kaplan-Meier生存曲线比较了ITGA2表达对胰腺癌患者生存期的影响。结果表明,ITGA2高表达组的存活时间明显短于低表达组。如图 3A 所示,低表达组患者的总时间明显长于高表达组患者(p=0.002)。为了进一步评估 ITGA2 表达作为胰腺癌生物标志物的预后价值,还对 ICGC 数据库中的 ITGA2 进行了生存分析(p=0.009,图 3B),得到了相同的结果。如表3 所示,单变量 cox 回归分析结果显示,高表达 ITGA2 与胰腺癌总生存时间缩短显着相关。风险比(HR)为 4.089,95% 置信区间(CI)为 1.732-9.651(p<0.001)。为探讨 ITGA2 与其他临床因素(如年龄、T 分期、N 分期)的独立性,在 R 中也进行了多变量 Cox 回归分析。根据多变量 Cox 回归分析的结果,ITGA2-高表达与整体显着相关。胰腺癌患者的生存率作为连续变量(HR:4.137;95% CI:1.623-10.547;p=0.003),并且独立于其他临床因素,这表明 ITGA2是胰腺癌的预后相关因素。在我们的分析中,其他传统的预后因素,如TNM分期和等级,不被视为总生存期的预后指标。
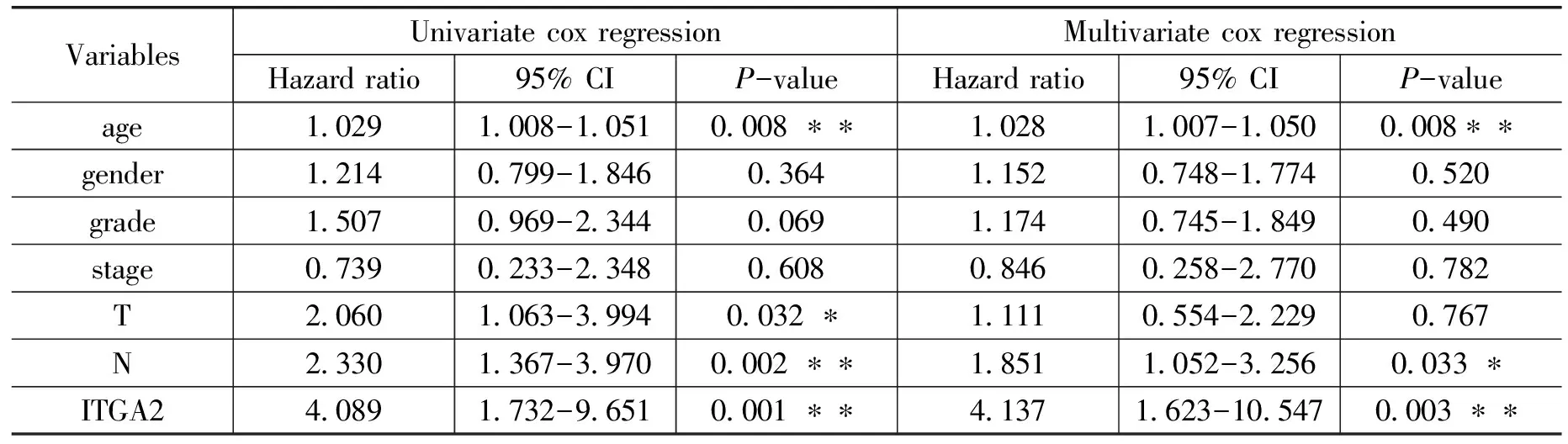
表3 TCGA队列中总生存期的单因素和多因素分析
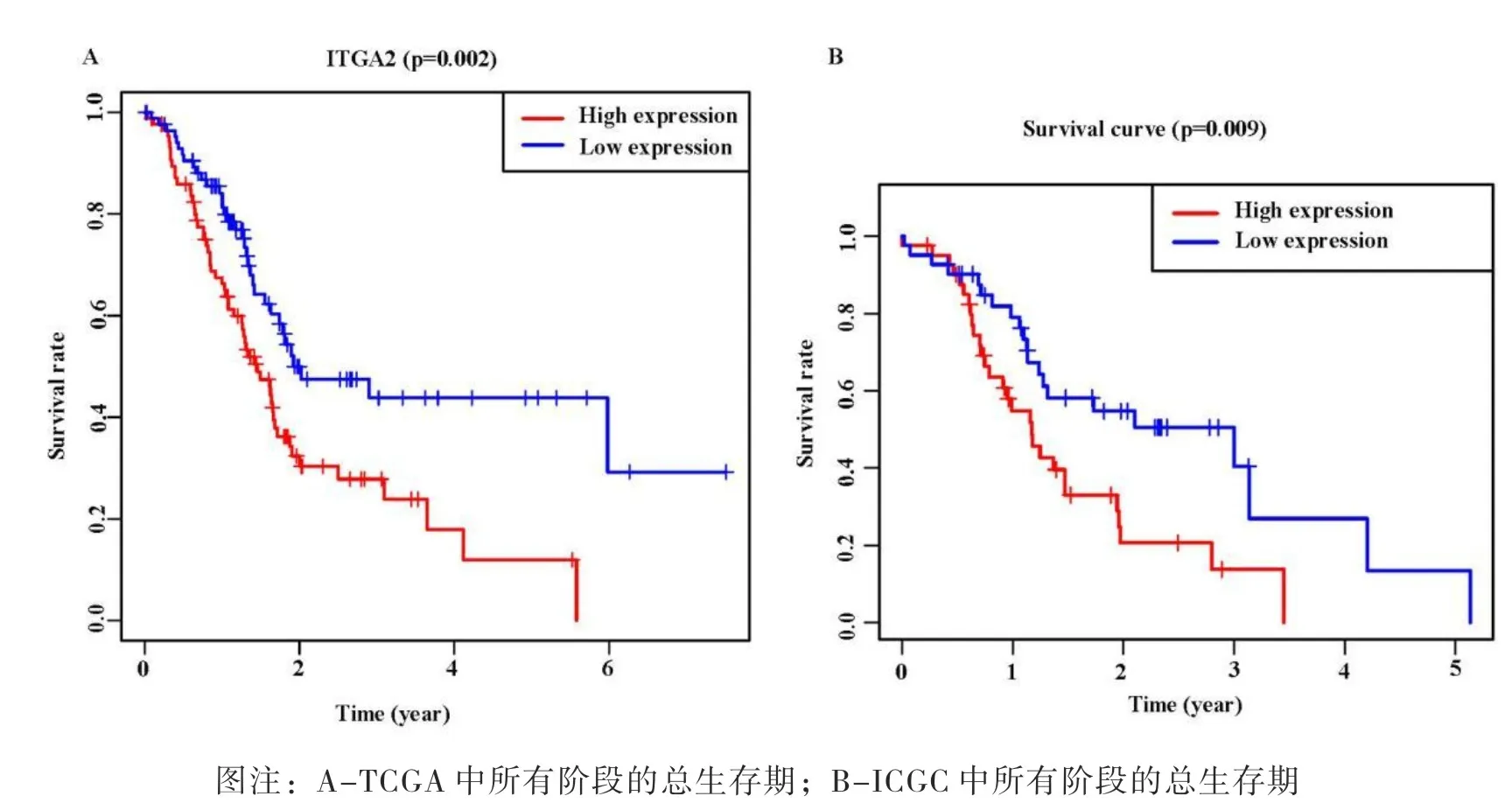
图3 根据 ITGA2 表达水平,胰腺癌患者的 Kaplan-Meier生存曲线
2.4 富含ITGA2的信号通路
在TCGA队列中,根据ITGA2的中位表达值将胰腺癌患者分为高表达组和低表达组。为了识别在ITGA2高表达组中显着富集的信号通路,在高ITGA2组和低ITGA2组之间进行了s-GSEA。结果显示,11个基因组在FDR<25%时显著富集,如表4所示。包括其中一些与癌症发生和发展密切相关的KEGG通路也显著富集,如胰腺癌(图4A)、子宫内膜癌(图4B)、前列腺癌(图4C)、癌症中的通路(图4D)、甲状腺癌(图4E)、膀胱癌(图4F)、肾细胞癌(图4G)、紧密连接(图4H)等。
3 讨论
胰腺癌在世界范围内是一种极其严重的致命性恶性肿瘤,胰腺癌患者所有阶段的总体5年生存率都很低。目前还没有有效的治疗方法来降低胰腺癌的死亡率。此外,鉴于到2030年胰腺死亡率预计将成为癌症相关死亡的第二大原因,因此迫切需要阐明详细的发病机制,并寻找新的预后相关标志物和治疗靶点。通过对测序数据的生物信息学分析,发现了一个属于整合素家族的蛋白质 ITGA2。ITGA2 编码胶原蛋白和相关蛋白的跨膜受体的 α 亚基,它与 β 亚基形成异二聚体[22]。许多研究报告提出,ITGA2 在多种肿瘤中表达量显着上调。Peng Guo 发现 ITGA2 的高表达与胶质母细胞瘤患者存活率降低密切相关[22]。据报道,SPARC 通过黑色素瘤中的 β2β1 整合素促进组织蛋白酶 B 介导的黑色素瘤侵袭性[23]。但ITGA2在胰腺癌中的作用仍然是个谜。在本研究中,我们从 TCGA、ICGC 和 GTEx 数据库下载基因表达数据,通过生物信息学分析探讨 ITGA2 在胰腺癌中是否具有基因表达量变化和潜在预后价值。我们发现与正常组织相比,胰腺癌组织中ITGA2基因的表达显着增加。ITGA2 表达变化的结果与 Oncomine 数据库中的结果一致。ITGA2表达与临床特征的相关性分析结果表明,胰腺癌中IFGA2的高表达与TNM分期、分级和癌症状态相关,表明ITGA2具有潜在的预后价值。在 TCGA 和 ICGC 队列中,通过生存分析,我们发现 ITGA2 在胰腺癌患者中显示出良好的预测能力,即低表达组的总时间明显长于高表达组患者(p= 0.002,p = 0.009 分别)。为了研究ITGA2在胰腺癌中的作用,用TCGA数据进行了单基因GSEA。结果显示,在 FDR < 25% 的 ITGA2 高表达组中有 11 个基因组显着富集,包括子宫内膜癌、癌症通路、轴突引导、前列腺癌、肾细胞癌、甲状腺癌、泛素介导的蛋白水解、内吞作用、紧密连接,膀胱癌,胰腺癌。此外,我们发现 ITGA2 可能参与与 E-cadherin 的紧密连接途径。E-cadherin 是一种被广泛接受的 EMT 生物标志物,在肿瘤转移中起着至关重要的作用。以往的研究表明,EMT在胰腺癌的转移中起重要作用。例如,FOXO3a 通过诱导上皮间质转化促进胰腺导管腺癌的转移[24]。一些长链非编码 RNA(lncRNA),如 MEG8,可诱导 EMT 相关的细胞形态变化并增加胰腺癌细胞的细胞运动能力[25]。几项研究表明,ITGA2 与上皮-间质转化过程存在千丝万缕的关系。例如Ferraro A 揭示 EZH2 通过靶向整合素 α2 基因控制结肠癌细胞的上皮间质转化[26]。董家强的研究表明,ITGA2通过调节耐药转移性胃癌的上皮-间质转化与远处转移有关[18]。尽管没有直接证据表明 ITGA2 在胰腺癌转移过程中起作用。考虑到过去的研究结果和我们这次的分析,我们有理由相信 ITGA2 可能参与 EMT 促进胰腺癌转移,从而导致预后不良。这与 ITGA2 高表达的患者比 ITGA2 低表达的患者具有更短的总生存时间一致。总之,我们的研究表明,ITGA2 有可能成为胰腺癌的治疗靶点。
