紫杉醇纳米制剂的研究进展
2022-10-17刘颖慧李昆钊代英辉王东凯
刘颖慧,李昆钊,代英辉,王东凯*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016;2. 沈阳药科大学 中药学院,辽宁 沈阳 110016)
引言
紫杉醇(paclitaxel, PTX)是目前临床使用最广泛的抗肿瘤药物之一,常用于治疗乳腺癌、卵巢癌、头颈癌、肺癌等[1-3]。紫杉醇是从太平洋红豆杉的树皮中提取出的活性成分[1],不同于秋水仙碱和鬼臼毒素等抑制微管组装的植物成分,紫杉醇通过促进微管组装并抑制其解聚,阻止细胞有丝分裂而显示出抗肿瘤活性[4]。
尽管紫杉醇具有良好的抗癌活性,但其水溶性很差,传统的紫杉醇制剂依赖于 Cremophor®EL(聚氧乙烯蓖麻油, CrEL),一种合成的、非离子型表面活性剂做增溶剂,但由于聚氧乙烯蓖麻油会引起严重的副作用,如超敏反应、肾毒性、神经毒性和心脏毒性等[5],会给患者造成极大的痛苦。有学者曾尝试用 PEG(聚乙二醇)作为 CrEL 替代品,但在动物实验中发现,这种物质似乎降低了紫杉醇的抗肿瘤活性[6]。溶解性差这一特性极大地限制了紫杉醇的临床使用,也给制剂研发带来不小的挑战。几十年来,研发替代 CrEL 的紫杉醇新型制剂一直是国内外研究的热点。目前已上市的纳米制剂有脂质体、白蛋白纳米粒、聚合物胶束等,笔者对国内外已上市或仍在临床试验中的经典的紫杉醇纳米制剂进行了回顾与总结(见表 1),也整理了部分具有代表性的新型紫杉醇纳米载体的设计与研究现状,希望能为读者带来有益思考。
1 传统紫杉醇注射剂-Taxol®
1992 年上市的紫杉醇注射液 Taxol®来自美国 BMS 公司[1],也是第一个上市的紫杉醇制剂,使用 Cremophor®EL 和无水乙醇(1∶1,v / v)增溶。但由于聚氧乙烯蓖麻油会引起组胺释放,产生严重的副作用,如超敏反应、肾毒性、神经毒性和心脏毒性等[5-8]。延长药物输注时间似乎可以在一定程度上降低、但不能避免发生超敏反应的风险[6]。治疗前患者常需预先使用皮质类固醇激素和抗组胺药物[9-10]来将过敏风险降到最低,但仍有近 40% 的患者会出现轻微的不良反应如潮红和皮疹,近 3% 的患者会经历潜在的、危及生命的严重不良反应[11]。CrEL 对补体系统的激活或许可解释紫杉醇治疗患者出现的危及生命的急性超敏反应[12]。由轴突脱髓鞘和肿胀引起的神经毒性也可能是 CrEL 的作用[13]。此外,Cremophor®EL 试剂还会导致 PVC 输液袋和注射器中的增塑剂 DEHP(邻苯二甲酸二乙基己酯)渗出到药物溶液中,引发毒性反应[14]。因此,Taxol®必须在玻璃瓶或非 PVC 输液系统中制备,并要求具有在线过滤功能,以防止 CrEL 和溶剂沉淀[15]。
2 纳米粒
2.1 白蛋白结合纳米粒-Abraxane®
Abraxane®(nab-paclitaxel)是全球唯一上市的白蛋白结合型紫杉醇纳米粒(见图 1),也是目前临床上首选的紫杉醇制剂。Abraxane®是由 6~7 个 PTX 分子非共价结合到白蛋白分子上,形成 4~14 nm的紫杉醇-白蛋白一级聚集体。然后这些物质进一步聚集,形成直径约 130 nm 的白蛋白-紫杉醇颗粒[16]。将白蛋白颗粒混悬在生理盐水中来递送紫杉醇[17],以白蛋白作为载体,不使用 CrEL 溶剂系统,消除了与溶剂相关的毒性,也避免了类固醇和抗组胺药物的预先服用[18]。此类药物的特殊外层,可以避开免疫系统的攻击[19]。依赖于 EPR 效应,静脉注射后,纳米颗粒通过渗漏和渗透的肿瘤血管和受损的淋巴系统有针对性地将药物精确输送到肿瘤细胞[19-20]。白蛋白结合纳米技术使得紫杉醇的载药量提高了一半[21],最大耐受量 300 mg·m-2也比 Taxol®175 mg·m-2提高了近一半[20]。一项对 454 名转移性乳腺癌患者进行的 III 期试验结果表明,Abraxane®组的有效率和肿瘤进展时间(TTP)显著高于 Taxol®组。尽管紫杉醇剂量增加了 49%,但服用 Abraxane®的 4 级中性粒细胞减少症的发生率明显降低[17]。虽然 Abraxane®的建议输液时间相当短(即 30 min / 2~4 h)[22],但另有研究表明,将 Abraxane®的输液时间从 30 min 延长至 2 h,可能会在不影响疗效的情况下显著降低患者周围神经病变的频率和严重程度[18]。
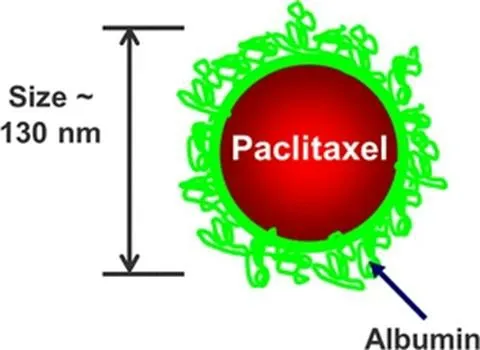
Fig. 1 Schematic of Abraxane® (nab-paclitaxel)[20] 图 1 Abraxane® (nab-paclitaxel) 示意图[20]
3 脂质体
脂质体(见图 2)代表了先进、多功能的药物输送系统,可以用作不溶性药物的无毒载体[23-24]。脂质体是以脂质为基础的微观球形囊泡系统,在适当的水条件下,它们之间的相互作用会导致闭合双分子层的自发形成[24],其中亲脂性双层被夹在两层亲水层之间。磷脂具有生物可降解性和生物相容性,与细胞膜中的脂质相似,因其与组织结构的组装相关的药物输送潜力而被广泛探索[25]。脂质体递药系统可以通过增加肿瘤细胞中的药物浓度或减少正常宿主组织中的药物暴露来提高抗癌药物的治疗指数[26]。
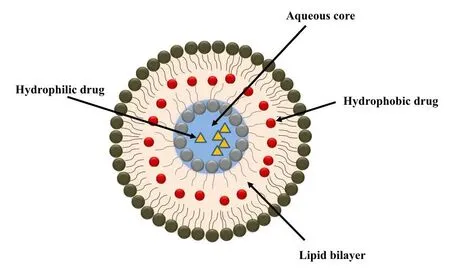
Fig. 2 Schematic of liposomes[27] 图 2 脂质体示意图[27]
3.1 Lipusu®
Lipusu®是由中国开发的紫杉醇脂质体注射液,已于 2003 年经国家食品药品监督管理局批准上市,广泛用于静脉注射治疗卵巢癌和非小细胞肺癌[28]。PTX 溶解在由卵磷脂和胆固醇按质量比 87∶13的比例混合制成的脂质体中,平均粒径约为 400 nm[16,28]。有关 PTX 脂质体的临床前药动学研究指出,PTX 制成脂质体与传统注射液相比显著降低了血药浓度,消除相半衰期明显延长[29]。与相同剂量的 Taxol®静脉注射液相比,具有相似的抗肿瘤活性,较低的骨髓毒性和系统毒性[28]。动物组织分布实验表明,脂质体制剂具有一定的组织靶向性,并能长时间在脏器中保持在较高的浓度[29]。Lipusu®在临床治疗乳腺癌和非小细胞肺癌患者时,与传统紫杉醇相比,具有相似的疗效和更少的严重过敏反应发生率[28]。
3.2 LEP-ETU®
LEP-ETU®(Liposome Entrapped Paclitaxel Easy to Use)是采用改进的薄膜水合法制备的直径约 150 nm 的脂质体[16],制剂是由 DOPC(二油酰基磷脂酰胆碱)、胆固醇和心磷脂按物质的量比 90∶5∶5 组成的。DOPC 是一种两性离子天然磷脂,由于其相变温度(-22 °C)较低,因此被选为 LEP-ETU®配方中的脂质成分之一,也因此 DOPC 可以形成更灵活的脂质体来包裹高度疏水的分子。此外,LEP-ETU®配方中还含有胆固醇,用来提高脂质体的稳定性。LEP-ETU®的最大耐受量为325 mg·m-2,与常规紫杉醇 175 mg·m-2相比,能够降低中性粒细胞减少的发生率。在小鼠模型中,与 Taxol®相比,LEP-ETU®在几种肿瘤类型中具有同等或更好的抑制肿瘤生长的效果[26,30]。
3.3 Endo TAG®-1
Endo TAG®-1 是第一个进入临床试验的脂质包埋紫杉醇的阳离子脂质体制剂,靶向带负电荷、活化的肿瘤内皮细胞[31]。该制剂的辅料由 DOTAP(2, 3-二油酰基-丙基)-三甲胺)和DOPC(二油酰磷脂酰胆碱)组成,磷脂辅料的用量摩尔比大约为 109。DOTAP 是一种阳离子合成脂质,其头部含有一个正电荷[26]。由于载体系统表面阳离子分子对肿瘤微血管中的糖蛋白、阴离子磷脂和蛋白多糖等阴离子分子具有天然亲和力,使药物只攻击肿瘤血管,不伤害正常血管,因此阳离子脂质体具有选择性靶向肿瘤血管的固有能力[32]。然而,临床试验显示,新一代阳离子脂质体与游离药物或常规脂质体相比治疗效果相当甚至更差。当 EndoTAG®-1 与其他化疗药物如吉西他滨或 Taxol®联合使用时,抗肿瘤活性最高[31-32]。
4 聚合物胶束
该类制剂使用聚合物胶束(见图 3)代替 CrEL 作为疏水性紫杉醇的载体,纳米尺寸的聚合物胶束具有良好的溶解性和药代动力学特性、增强药效和降低毒性等强大优势。聚合物胶束是由两亲嵌段共聚物在水溶液中组装而成的具有壳核结构的纳米载体[33],即由两个独立的功能段组成:内核和外壳。外壳控制体内药代动力学行为,内核负责载药量、稳定性和药物释放行为[34]。将活性药物成分(API)通过化学结合或物理包埋的方式加入到疏水核心中。胶束的大小可以控制在 20~100 nm 的直径范围内,以确保胶束不会穿过正常的血管壁。此外,由于分布体积的减少,药物副作用的发生率可能会降低[35]。
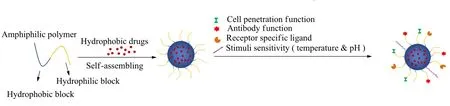
Fig. 3 Schematic of drug-loaded micelles[27] 图 3 载药胶束示意图[27]
4.1 Genexol®-PM
Genexol®-PM市场名称为 Cynviloq,是韩国 Samyang 公司开发的聚合物胶束制剂。将紫杉醇溶解于直径约 25 nm 的 mPEG-PDLLA 嵌段共聚物胶束中[16],嵌段共聚物包括用于非免疫原性载体的聚乙二醇,以及疏水药物增溶所需的可生物降解的成核聚(D, L-乳酸)[15]。最佳的 mPEG-PDLLA 两嵌段共聚物质量比为 60∶40,在该体系中,载药量可高达 25%;若采用固体分散技术制备,载药量约为 16.7%[34]。Genexol®-PM 平均分子量为 1 766~2 000 Da。该制剂中不含白蛋白,避免了白蛋白供体的使用,降低了微生物生长的风险[16]。Genexol®-PM 在裸鼠体内最大耐受剂量几乎是 Taxol®的三倍,PTX 在肝、脾、肾、肺等组织中的生物分布几乎是 Taxol®的 2~3 倍[11]。在一项为期 3 周的 I 期临床试验中,Genexol®-PM 最大耐受剂量为 390 mg·m-2,远高于Taxol®175 mg·m-2[36]。其中性粒细胞减少的风险也比含 CrEL 的紫杉醇低[13,15]。
4.2 Nanoxel®
Nanoxel®是基于 PVP-b-PNIPAAM(聚乙烯吡咯烷酮与 N-异丙基丙烯酰胺嵌段共聚物)合成的纳米制剂,已于印度批准上市。这种基于聚合物的药物是两亲性的,既有亲水基团,也有疏水基团。当暴露在水环境中时,会形成纳米尺寸的胶束。胶束的核心区域由疏水基团组成,用作紫杉醇的储库。当聚合物表面被侵蚀时,药物缓慢释放,较小的药物颗粒选择性进入高血管通透性的肿瘤细胞。由于不使用 CrEL 增溶,几乎不会导致输液反应[37]。纳米粒制剂 Nanoxel®和 Abraxane®是通过细胞内吞囊泡对紫杉醇进行摄取的,摄取情况相似,均明显优于 Taxol®,拥有更高的将药物输送到靶细胞的效率[38]。
4.3 PICN
紫杉醇纳米分散体注射浓缩物(Paclitaxel injection concentrate for nanodispersion, PICN)已在印度获批。与使用生物来源的白蛋白的 Abraxane®不同,PICN 使用的是聚合物和脂质混合物[39]。该制剂基于印度太阳制药(Sun Pharma)的 Nanotecton®技术,由聚合物(聚乙烯吡咯烷酮)和脂质(硫酸胆固醇和辛酸)稳定紫杉醇,形成 100~150 nm 的颗粒[16]。一项 Ⅱ/Ⅲ 期临床试验显示 PICN 和 Abraxane®治疗组在 ORR(客观缓解率)或中位 PFS(无进展生存期)放射评估方面没有显著差异,二者一样有效且耐受性良好,并且还具有减少预先皮质类固醇使用的潜在优势[39]。在一项 I 期试验中,PICN 与卡铂联合使用也显示出良好的耐受性结果[16]。
4.4 Paclical
Paclical 商品名为 Apealea®,该制剂的基础是专利赋形剂 XR-17,这是一种维生素 A 类似物、表面活性剂,由 N-(全反式维甲酸)-L-半胱酸甲酯钠盐和 N-(13-顺式维甲酸)-L-半胱酸甲酯钠盐组成,可形成粒径 20~60 nm 的胶束[16]。据报道,Paclical 具有与 Abraxane®相似的药代动力学参数[40]。一项针对犬血管肉瘤(HSA)细胞株的试验观察到该胶束有明显的细胞毒作用,使 HSA 细胞株的早期和晚期凋亡显著增加,药物 IC50在不同时间点均可见明显的细胞迁移抑制作用,对HSA 细胞 VEGFA、VEGFR1、bFGF、FGFR2 的表达无明显影响[41]。两项针对犬肥大细胞瘤(MCT)的试验认为该药似乎是治疗犬肥大细胞肿瘤的一种安全有效的临床治疗方法[42-43]。一项针对卵巢癌患者的 Ⅲ 期临床试验显示,与 Taxol®加卡铂相比,Paclical 联合卡铂可提高患者的总体存活率[16]。
4.5 NK105
NK105 聚合物胶束直径约 85 nm,由 PEG-p(aspartate)两亲共聚物组成,其中 PEG 为亲水嵌段,经 4-苯基-1-丁醇酯化改性的聚天冬氨酸为疏水嵌段[16]。利用 PTX 与嵌段共聚物聚天冬氨酸链之间的疏水相互作用,将 PTX 引入物理包埋形成的聚合物胶束中,通过促进聚合物与 PTX 的自缔合制备 NK105[33,35]。该微环境能够实现良好的载药量,冷冻干燥后,PTX 载药量为23%。NK105 的 MTD 为 180 mg·m-2,此剂量下的血浆 AUC 大约是传统紫杉醇制剂的 30 倍[35]。在携带 HT-29 结肠癌细胞的 BALB/c 小鼠进行的体内抗肿瘤试验显示,NK105 在 PTX 当量剂量为 25 mg·kg-1时的抗肿瘤活性与给予游离 PTX 100 mg·kg-1时的抗肿瘤活性相当,给予 NK105 100 mg·kg-1的小鼠比给予相同剂量的游离 PTX 的小鼠体重减轻更少。NK105 比游离紫杉醇具有更小的神经毒性和更强的放射增敏作用[35]。目前 NK105 已在日本完成乳腺癌患者的 Ⅲ 期临床试验,但因未达到相关临床试验终点而宣告失败。
4.6 Paxceed
Paxceed是一种载 PTX 的 PEG-b-PDLLA 胶束配方,PTX 载药量为 25%,将 PTX 和共聚物在乙腈中溶解,然后挥发溶剂,用预热水溶解生成的基质,得到胶束溶液[33]。目前 Paxceed 已完成对类风湿性关节炎的 Ⅱ 期临床试验和银屑病的 Ⅱ 期临床试验,暂无抗肿瘤试验的数据,故不再赘述。
5 口服制剂-DHP107
虽然不是严格依赖纳米技术,但口服 PTX 制剂的开发是紫杉醇制剂的一大突破。口服紫杉醇的生物利用度较低,因为胃肠道粘膜中存在 P-糖蛋白(P-glycoprotein, P-gp)、细胞色素 P450和其他膜蛋白。因此,将口服紫杉醇制剂与 P-gp 抑制剂结合可以提高其生物利用度,然而这种结合有可能与伴随的药物或辅料相互作用[44]。DHP107 是由韩国大华制药公司开发的一种脂类成分和 PTX 的新型口服制剂,已在韩国获批[45]。该配方由 PTX、单油酸、三辛酯和吐温 80 按质量比 1∶55∶27.5∶16.5 组成,超声作用后混合在一起形成乳状液[16],不含 P-gp 抑制剂或CrEL[46]。它在雌性 BALB/c 裸鼠和卵巢癌原位小鼠模型中显示出很强的抗肿瘤效果[44]。一项DHP107 对大鼠周围神经病变相关行为的影响研究认为,与 Taxol®治疗组相比,DHP107 给药组大鼠的疼痛行为明显降低,氧化应激、细胞凋亡、疼痛和神经病变相关的分子蛋白改变也明显减少。因此,DHP107 可能是一种很有前途的化疗药物,因为与静脉注射紫杉醇制剂(如 Taxol®)相比,DHP107 产生的周围神经病变更少[47]。DHP107 作为晚期胃癌的二线治疗方案在 PFS 方面不逊于 Taxol®,抗肿瘤效果与 Taxol®相当,但引起的周围神经病变更少,无过敏反应,可能是由于避免了 CrEL 的使用。DHP107是第一个被证实有效、安全的治疗晚期胃癌的口服紫杉醇[45]。
6 新型紫杉醇纳米载体设计思路
简略列举了几项较新的紫杉醇纳米递药载体的设计思路,递送载体涉及功能性脂质体、聚合物胶束、单壁碳纳米管、金属有机骨架、环糊精、水凝胶、壳聚糖等多种材料,它们良好的递送效率及治疗效果表明纳米递送系统仍然具有强大的开发潜力。
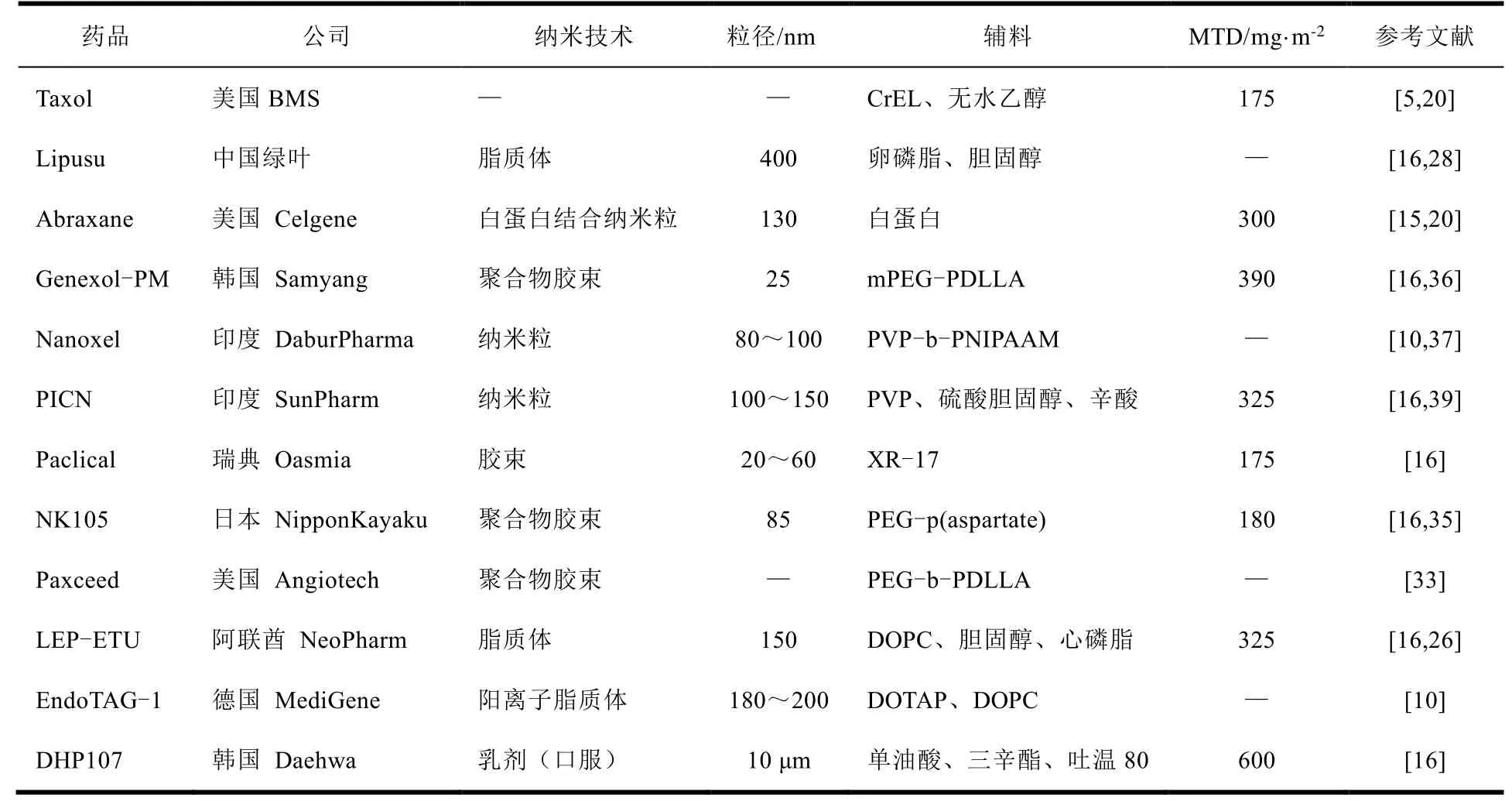
Table 1 Key information about paclitaxel nanopreparations in marketed / clinical trials 表 1 已上市或临床试验中的紫杉醇纳米制剂的关键信息
6.1 脂质体
Jiang 等[48]设计了同时载有 PFTBA(全氟三丁胺)和 PTX 的核壳结构的多效性脂质体(见图 4),并在表面修饰了 DSPE-PEG2000,以提高肿瘤的放射敏感性。脂质体可以增加药物在肿瘤组织中的蓄积,PTX 可诱导肿瘤细胞周期停滞于放射敏感期,而 PFTBA 可增加肿瘤部位的氧浓度,从而改善辐射诱导的肿瘤损伤。动态光散射法测得脂质体的平均粒径约为 100 nm,具有良好的缓释性能,延长了在体内停留的时间。为了评价不同治疗方法对荷瘤小鼠缺氧的影响,给荷 CT26 肿瘤的小鼠静脉注射生理盐水、lip(PFTBA)、lip(PTX)和 lip(PFTBA + PTX)24 h 后,免疫组化法检测肿瘤组织中 HIF-1α 的表达,相比之下 lip(PFTBA + PTX)组的肿瘤组织中 HIF-1α 的表达显著降低,这表明含有 PFTBA 的制剂可以逆转肿瘤内的缺氧。通过联合放射疗法(RT),并测量 14 天后的肿瘤体积来监测其抗肿瘤作用,与 lip(PTX)组和 lip(PFTBA)+ RT 组相比,lip(PFTBA + PTX)+ RT 组肿瘤生长明显延迟,表明了当与 RT 联合使用时,与各自的单一疗法相比,lip(PFTBA + PTX)提供了最有效的协同抑制肿瘤生长的作用。综上,与 RT 联合使用时,它们在肿瘤靶向、滞留和抑制方面是有效的。
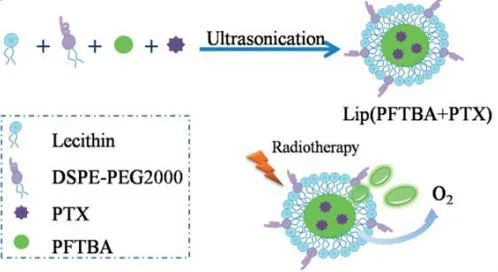
Fig. 4 Schematic of preparation of lip(PFTBA + PTX) [48] 图 4 lip(PFTBA + PTX)的制备示意图[48]
6.2 金属材料
Dizaji 等[49]将亲水性 NaY 沸石、疏水性 ZSM-5 沸石和金属有机骨架(metal organic frameworks, MOFs)ZIF-8、MIL-101 引入 PLGA/壳聚糖纳米纤维中,成功合成了 PLGA/壳聚糖/NaY、PLGA/壳聚糖/ZSM-5、PLGA/壳聚糖/ZIF-8、PLGA/壳聚糖/MIL-101 载体(见图 5),用于控制紫杉醇药物的体内外释放和前列腺癌的治疗。四者的平均直径分别为 410、395、340 和 370 nm,载药率分别为(81.2 ± 1.1)%、(83.9 ± 1.1)%、(91.2 ± 0.8)%、(87.3 ± 1.2)%,与沸石相比,MOF 对紫杉醇分子的载药量更高。药物释放曲线表明,与 pH 为 7.4 相比,所有合成载体在酸性 pH 下的药物释放速率都较高。PLGA/壳聚糖/ZIF-8 和 PLGA/壳聚糖/ZSM-5 纳米纤维释放效果最好,在酸性和生理 pH 下分别在 360 h、480 h 和 600 h、720 h 内缓释紫杉醇。PLGA/壳聚糖/ZIF-8/紫杉醇纳米纤维对 LNCaP 癌细胞的杀伤率在 72 h 达到最大 86%。流式细胞仪分析表明,与沸石/紫杉醇纳米纤维相比,MOF/紫杉醇纳米纤维对 LNCaP 癌细胞的凋亡有更强的协同化疗作用。此外,PLGA/壳聚糖/ZIF-8/紫杉醇组肿瘤体积在 20 d 后生长最小。研究结果表明,与沸石纳米纤维相比,载药 MOF 纳米纤维具有更高的 PTX 载药量、更好的药物缓释性能和抗肿瘤治疗性能。
Shima 等[50]合成了一种基于介孔磁铁(Fe3O4)纳米簇的靶向给药系统(见图 6),介孔 Fe3O4纳米团簇平均尺寸约为 120 nm,具有优异的水分散性、超顺磁性和快速的磁响应性。这些团簇具有疏松的介孔结构和较大的比表面积,是吸附药物分子的理想材料,PTX 等药物分子可以很容易地穿透并沉积在 Fe3O4纳米团簇的多孔通道内。因此,PTX 的有效载药量达到了 17%。在负载 PTX 的Fe3O4纳米团簇于生理 pH(PBS, pH = 7.4)和酸性 pH(醋酸盐缓冲液,pH = 5.2)中的药物释放行为的研究中,观察到介孔 Fe3O4纳米簇的 pH 响应性药物释放行为对其靶向治疗的应用非常有利,因为癌细胞的胞外 pH 比正常细胞偏酸性。在生理 pH(pH = 7.4)下观察到的较低的药物释放速率,可以避免 PTX 在给药过程中在血液循环中的不良释放。在酸性 pH(pH = 5.2)下观察到的较高的药物释放速率,可以促进它们在肿瘤组织内的释放。
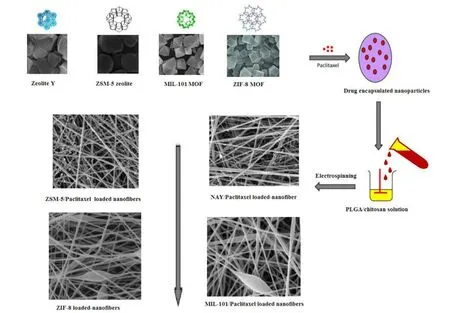
Fig. 5 Schematic of the synthesis of NMOFs/nanozeolites-Paclitaxel loaded-nanofibers[49] 图 5 负载紫杉醇的金属有机骨架/沸石的纳米纤维合成示意图[49]
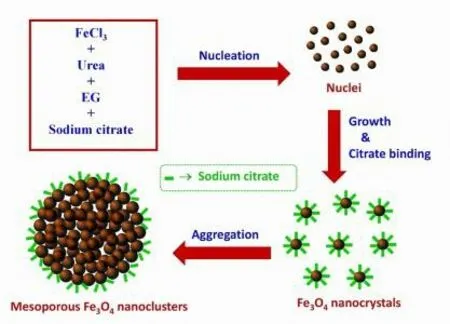
Fig. 6 Schematic of formation of mesoporous Fe3O4 nanoclusters by a two-step growth process[50] 图 6 通过两步生长过程形成介孔Fe3O4纳米团簇的示意图[50]
6.3 单壁碳纳米管
Tohidifar 等[51]采用全原子分子动力学模拟方法研究了 PTX 在未修饰的单壁碳纳米管(SWCNTs)以及经(-OH)、(-COOH)和 PW3 肽功能化的 SWCNTs 上的吸附行为。PW3 表面活性多肽具有良好的增强 SWCNTs 在水介质中分散性的潜力,有望在未来的纳米生物医学应用,特别是在药物输送和癌症治疗方面成为修饰 SWCNTs 的一个良好的候选材料。SWCNTs 适当功能化可促进其在水环境中的分散。可通过计算分子间氢键的数量来评估所研究的纳米载体的溶解性。模拟结果表明,PTX 分子主要通过芳环的 π-π 堆积作用在碳纳米管和改性碳纳米管表面得到很好的吸附。范德华力、PTX 药物芳环到纳米载体的平均质心距离、原子接触数和径向分布函数也表明,PW3 肽链修饰 SWCNT 将为 PTX 与纳米载体侧壁的相互作用提供更有利的条件,从而提高药物的吸附效率。另外,结合焓和自由能的定量计算结果表明,PTX 分子在原始和官能化的 SWCNTs 上的负载是放热的和自发的,SWCNT-PW3 体系由于其较负的结合能而表现出最好的药物吸附性能。除此之外,SWCNT-PW3 系统与水分子之间的氢键数目越多,给药系统的水溶性越强。总之,通过 PW3 肽链对原始的 SWCNTs 进行适当的功能化,可以帮助设计和优化合适的基于 SWCNTs 的 PTX 药物转运载体,为开发和设计合适的给药载体提供了依据。
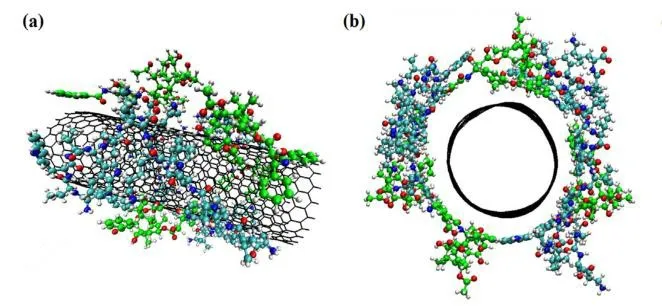
Fig. 7 Schematic of the adsorption four PTX molecules on the SWCNT-PW3 nano-vector. (a) Front view, (b) Side view[51] 图 7 四个PTX分子在SWCNT-PW3纳米载体上的吸附示意图. (a) 前视图, (b) 侧视图[51]
6.4 经修饰的嵌段共聚物胶束
Wang 等[52]开发设计了一种生物素修饰的完全 pHPMAm 为基础的抗癌药物输送系统。通过可逆的加成-断裂链转移聚合合成了 p(HPMAm)-b-p(HPMAm-Bz)嵌段共聚物,将其用于生物素修饰的胶束的形成。通过测定与计算得出,生物素化和非生物素化胶束的大小分别为(63 ± 5)nm 和(62 ± 3)nm,并且在 PBS(pH 7.4)中 37 °C 孵育 48 h 后大小几乎没有变化,显示出良好的胶体稳定性。负载 PTX 的胶束尺寸比空胶束略大,在 61~70 nm之间。PTX 水溶性约 < 0.3 μg·mL-1,通过在胶束中负载该药物,其溶解度可增加到 0.5 mg·mL-1。用高表达生物素受体的 A549 人肺癌细胞和缺乏生物素受体的 HEK293 肾细胞,评价负载 PTX 胶束的细胞摄取和细胞毒性。结果在 HEK293 细胞中,观察到生物素和非生物素化胶束的内化程度都很低,在 A549 细胞中,生物素化的聚合物胶束的荧光强度明显高于非生物素化的胶束,证实了生物素化的聚合物胶束的内化增强。当 PTX 浓度 > 1 μg·mL-1时,负载 PTX 的胶束在 HEK293 细胞中的细胞毒性与未经生物素化的胶束相比无显著差异。在 10 和 100 μg·mL-1的 PTX 浓度下,生物素修饰的胶束对 A549 细胞的细胞毒作用明显强于未修饰的胶束。因此,生物素修饰的胶束比非靶向胶束更有效地内化,并在靶细胞内发挥更强的细胞毒作用。总之,基于 pHPMAm 骨架的生物素化聚合物胶束有望用于生物素受体过表达肿瘤的靶向治疗。
Li 等[53]设计了一种水溶液中自组装的 pH 和氧化还原双响应胶束,即甲氧基聚乙二醇-半胱胺-聚(L-谷氨酸)-咪唑(mPEG-SS-PGA-IM)两亲性聚合物。考虑到肿瘤细胞或组织表现出的低 pH 值和高谷胱甘肽(GSH)浓度,mPEG-SS-PGA-IM 胶束在肿瘤组织的 pH 值下具有电荷转换作用,可以促进肿瘤细胞的摄取。此外,mPEG-SS-PGA-IM 胶束可以通过质子海绵效应从内涵体或溶酶体中逃逸,随后被胞浆中较高浓度的 GSH 降解。制备出的胶束尺寸为 108~236 nm。在药物释放实验中,PTX 的释放表现出 pH 依赖的行为,当 pH 为 7.4 时,PTX 的释放量小于20%,而在 pH 6.8 和 pH 5.5 时,PTX 的释放量分别为累积释放量的 30% 和 60%。pH 5.5 时,10 mmol·L-1的 GSH 条件下的载 PTX 的 mPEG-SS-PGA-IM 胶束释药速度相较于 2 mmol·L-1的 GSH条件下显著提升。说明 PTX 在 mPEG-SS-PGA-IM 胶束中的释放受低 pH 值和高 GSH 水平的控制。细胞实验中,载 PTX 的 mPEG-SS-PGA-IM 胶束对 HCT116 细胞的杀伤活性明显高于载 PTX 的 mPEG-PBLG 和 mPEG-SS-PBLG 胶束。
6.5 β-环糊精
Yan 等[54]采用改进的乳化溶剂挥发法制备了一种生物素和精氨酸修饰的羟丙基-β-环糊精(生物素-精氨酸-HP-β-CD)纳米给药系统(见图 8)。环糊精(cyclodextrin, CD)具有疏水空腔和亲水表面,疏水药物可以被包裹在内部,形成水溶性更强的复合物。以精氨酸为功能间隔基,将 HP-β-CD 主面上的羟基与生物素的羧基偶联。以生物素-精氨酸-HP-β-CD 为载体,优化后的载药纳米粒子的平均粒径为 121.9 nm,载药量为 11.2%,包封率为 83.9%。此外,体外溶血试验表明,载药生物素-精氨酸-HP-β-CD 纳米粒具有良好的血液相容性,适合在较宽的药物浓度范围内静脉注射。体内抗肿瘤实验中 PTX 纳米粒组肿瘤体积明显小于 Cremophor®EL 制剂组,二者肿瘤抑制率分别为 72.6% 和 63.9%,说明载 PTX 纳米粒具有优异的抗肿瘤活性。细胞摄取实验证实了生物素的引入可以通过特异性受体介导的内吞作用促进药物在肿瘤中的蓄积,精氨酸可以提高纳米粒子的细胞膜通透性,这两种修饰都能增强系统的抗肿瘤效果。总之,生物素-精氨酸-HP-β-CD 纳米粒是一种有效的肿瘤靶向给药系统。
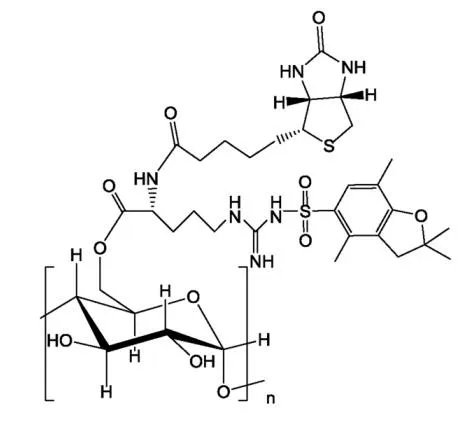
Fig. 8 Schematic of structure of biotin-Arg-HP-β-CD[54] 图 8 生物素-精氨酸-羟丙基-β-环糊精结构示意图[54]
6.6 纳米乳
Chen 等[55]将 PTX 的聚乙二醇(PEG400)溶液与质量分数 10%的不同粒径的空白脂质乳剂(blank lipid emulsions, BLEs)混合,制备了粒径分别为 110 nm、220 nm 和 380 nm 的紫杉醇脂质纳米乳剂 TPLE-1、TPLE-2 和 TPLE-3,并对其药效学、药代动力学、生物分布、体内外抗肿瘤效果进行了比较评价。其中,粒径最小的 TPLE-1 具有较高的 PTX 负载量、较慢的 PTX 释放速度和较大的油相分布,以脂质纳米粒的形式在血浆中的分布相对较高,被 RES 器官提取较少,显著增加了肿瘤摄取,对 MCF-7 细胞有较强的细胞毒作用和较强的抗肿瘤作用,在 SD 大鼠的血浆 AUC0-∞值较高,血浆清除率(CL)较小,平均滞留时间(MRT)和消除半衰期(T1/2)较长。它在体内也表现出与 Taxol®相同的疗效,甚至毒性更低,溶血和静脉刺激反应更少。此外,其 LD50是 Taxol®的 4.3 倍。以上结果表明,TPLE-1 具有较高的肿瘤蓄积率和有效性,毒性低,安全性和可药性好,是一种很有前途的肿瘤治疗候选药物。
6.7 前药
Zhou 等[56]以偶氮苯(Azo)为连接剂,设计并制备了低氧激活的紫杉醇前药(PTX2-Azo,见图 9),制备的纳米粒子直径约 100 nm,具有良好的球状形貌,稳定性良好。PTX2-Azo 在 Ce6/PTX2-Azo纳米粒中的负载率为 92.0%,载药量为 24 wt%。在低氧条件下,PTX2-Azo 将通过过表达的硝基还原酶和偶氮还原酶以及随后的 1, 6-消除和脱羧反应进行生物还原,形成有效的 PTX。为了实现 PTX2-Azo 的控释和活化释放,用光敏剂修饰的多肽共聚物 mPEG-Poly(Ser-Ce6)包裹 PTX2-Azo,得到 Ce6/PTX2-Azo 纳米粒,并加入两亲性 F127 调节 Ce6 和 PTX2-Azo 的含量。在该处方中,二聚体 PTX2-Azo 不仅显著增加了载药量,而且阻止了意外的药物释放。静脉给药后,Ce6/PTX2-Azo 纳米粒可以通过长循环效应聚集在肿瘤部位。由于肿瘤的缺氧环境,PTX2-Azo中的偶氮接头部分被还原,部分 PTX 被释放。在激光照射下,共包裹的 Ce6 被激活以产生单线态氧(1O2),从而诱导细胞凋亡。同时,光动力疗法对氧的消耗加剧了缺氧,从而进一步增加了 PTX 的释放。最后,释放的 PTX 可以迁移到微管破坏细胞分裂,与 Ce6 产生的1O2协同抑制肿瘤生长。Ce6/PTX2-Azo 纳米粒对 HeLa、MCF-7 和 C643 细胞具有较强的细胞毒作用,体内抗肿瘤效果较好,无明显全身毒性。同时,光动力疗法与化疗的协同作用可以达到最大的疗效和最小的副作用,在临床上是很有前途的。
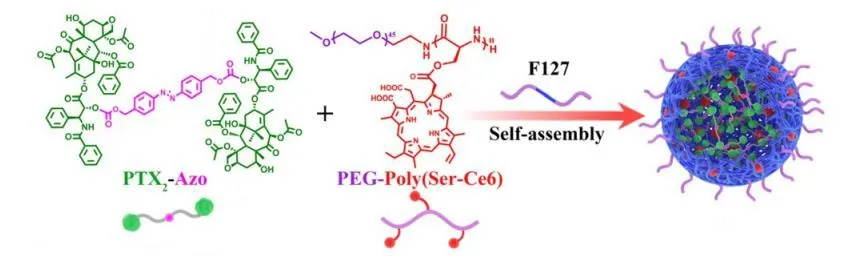
Fig. 9 Schematic of structure of Ce6/PTX2-Azo nanoparticle[56] 图 9 Ce6/PTX2-Azo 纳米粒的结构示意图[56]
Zhai 等[57]开发了一种具有酸可裂解缩醛(Ace)键的聚乙二醇-聚己内酯(mPEG-PCL)二嵌段聚合物,新型体内 pH 敏感紫杉醇前药胶束 mPEG-PCL-Ace-PTX,其中 mPEG-PCL 是一种可酸裂解的二嵌段聚合物。mPEG-PCL-Ace-PTX5具有两亲性,在磷酸盐缓冲液(pH 7.4)中自组装成平均粒径为 68.5 nm的纳米胶束,载药量为 23.5%。体外释药研究表明,mPEG-PCL-Ace-PTX5胶束对 pH 高度敏感,在 pH 7.4、6.0 和 5.0 时,48 h 分别有 16.8%、32.8% 和 48.2%的母体游离 PTX 从 mPEG-PCL-Ace-PTX5胶束中释放出来。MTT 法试验表明,pH 敏感的 PTX 前药胶束对 MCF-7 细胞的治疗效果优于游离 PTX,PTX 前药胶束和游离 PTX 的 IC50值分别为 0.49 和 0.65 μg·mL-1。细胞存活率数据表明乙烯基醚功能化的 mPEG-PCL 对 MCF-7 细胞实际上是无毒的,具有良好的生物相容性,是安全的药物纳米载体。
与缩醛相比,无环酮通常对酸更敏感,Mu 等[58]利用酸响应型丙酮基无环缩酮键构建了不同长度聚乙二醇(PEG)的紫杉醇前药。聚乙二醇丙酮基无环酮键联紫杉醇前药(PKPs)自组装成纳米粒,在正常生理环境下稳定,但在肿瘤内弱酸性环境下能迅速释放紫杉醇。PEG 的长度对 PKP 纳米粒的大小和临界胶束浓度有很大影响,从而影响 PKP 纳米粒的前药水解动力学、药代动力学、生物分布和抗肿瘤活性,当 PEG 嵌段的分子量大于 750 g·mol-1时,可以得到稳定的 PKP纳米粒;由相对较短的 PEG 构建的 PKP 纳米粒尺寸小,CMC 低,血液循环时间长,肿瘤聚集率高。TEM 结果表明 PKP 纳米粒子呈球形,DLS 分析显示 PKP750、PKP1000和 PKP2000纳米粒子的尺寸分别约为 13、22 和 48 nm。在 A2780 荷瘤小鼠模型中,PKP 纳米颗粒较 PTX 表现出改善的药代动力学和优越的抗肿瘤效果。未治疗组小鼠肿瘤生长迅速,第 14 天平均肿瘤体积为 2 200 mm3,而 PTX 处理组小鼠肿瘤体积中度抑制,第 18 天平均肿瘤体积为 1 700 mm3。PKP750、PKP1000和 PKP2000纳米粒治疗组小鼠第 18 天肿瘤平均体积分别为 610 mm3、1 100 mm3和 1 200 mm3,显示出比 PTX 更强的抗肿瘤活性。作者推测,以酸敏感的丙酮基无环缩酮为键的聚乙二醇化的 PTX 前药纳米粒可能由于有效的酸引发的肿瘤转化而显示出良好的抗肿瘤效果。
6.8 水凝胶经皮给药
Xu 等[59]设计了一种布洛芬修饰的甲氧基聚乙二醇-聚乙烯亚胺(mPEG-PEI-IPF)聚合物,制备紫杉醇胶束(PTX-M)和含 PTX-M 的卡波姆 940 水凝胶(PTX-Gel),以改善紫杉醇对皮肤局部黑色素瘤的缓释作用。PTX-M 的平均粒径为(221.7 ± 4.76)nm,加入 5 mg PTX 制备 PTX-M 制剂,载药量为 4.38%,包封率为 91.98%,水溶性达到 498.29 μg·mL-1,是 PTX 固有溶解度(0.3 μg·mL-1)的 1 660 倍。用 Cou6 代替 PTX 来制备载药胶束和水凝胶,用于皮肤渗透和保留性评价,结果 Cou6-M 组和 Cou6-Gel 组的皮肤渗透量和皮肤保留量均优于 Cou6 组。FT-IR 分析表明,PTX-M 或 PTX-Gel 主要改变了皮肤脂质和角蛋白的空间结构,从而增加了角质层脂质分子的流动性,聚合物带正电荷,促进了皮肤的渗透和沉积。此外,正电荷还促进了 B16 黑色素瘤细胞对 PTX-M 的摄取,从而提高了 PTX-M 对 B16 细胞的体外细胞毒作用。在体外细胞毒性试验中,48 h 时,PTX-M 对 B16 细胞的 IC50值为 0.51 μg·mL-1,低于 Taxol®组的 2.16 μg·mL-1,显示出更明显的抗肿瘤活性。在体内抗 B16 细胞实体瘤实验中,PTX-M/Gel 联合治疗组的最终相对肿瘤体积及肿瘤重量均小于 Taxol®、PTX-M 或 PTX-Gel 单独治疗组。PTX-M/Gel 联合治疗组对黑色素瘤细胞的破坏更为明显,说明 PTX-M/Gel 联合治疗作为一种化疗方法对皮肤黑色素瘤有较好的治疗效果。
6.9 口服制剂
口服紫杉醇发展的关键障碍是由于肠道细胞中的 P-糖蛋白的主动排泄,导致紫杉醇的口服生物利用度低。人参皂苷是 P-gp 的底物,可与 PTX 形成竞争抑制,减少 P-gp 对 PTX 的主动排泄,提高 PTX 的肠吸收。单爽[60]等采用转相-超声乳化结合的方法制备了供口服的紫杉醇-人参皂苷亚微乳。以大豆油为油相、人参皂苷水溶液为水相、吐温 80 为表面活性剂、甘油为助表面活性剂,共制备了 10 mg/10 g 和 25 mg/10 g 两种剂量亚微乳,包封率均大于 90%。其中低剂量组紫杉醇-人参皂苷亚微乳稳定性更好,较对照组 PTX 亚微乳小肠吸收百分比提高了 2%。
Chen 等[61]设计了一种新型的壳聚糖衍生物:将没食子酸(GA)、壳聚糖(CS)、D-α-生育酚聚乙二醇 1000 琥珀酸酯(TPGS)合成了 GA-CS-TPGS 共聚物(见图 10),并构建了多功能的 PTX-胶束,旨在增强对粘液的生物粘附,抑制 P-gp 的外排,降低 CYP3A 介导的代谢,同时胶束还增加了 PTX 溶解度,共同作用以提高 PTX 的生物利用度和抗肿瘤效果。由于 GA-CSTPGS 的两亲性,其具有很强的自组装能力,CMC 低至(15.6 ± 1.0)μg·mL-1。PTX-胶束粒径约为(134.9 ± 10.2)nm,载药量约为(8.2 ± 0.3)%,包封率约为(80 ± 3)%。与 Taxol®相比,PTX-胶束表现出缓释行为,这可能归因于胶束内核的疏水性和分子间的氢键等因素,PTX-胶束将 PTX 的生物利用度提高了约 3.80 倍,对 A569 荷瘤裸鼠的抗肿瘤效果优于 Taxol®,毒性低于 Taxol®。
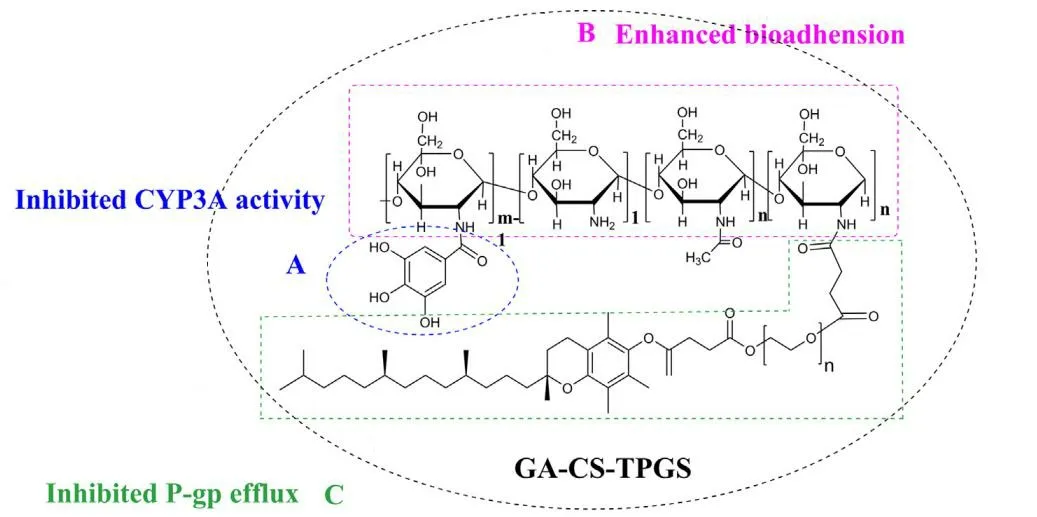
Fig. 10 Schematic of structure of GA-CS-TPGS polymer[61] 图 10 GA-CS-TPGS共聚物结构示意图[61]
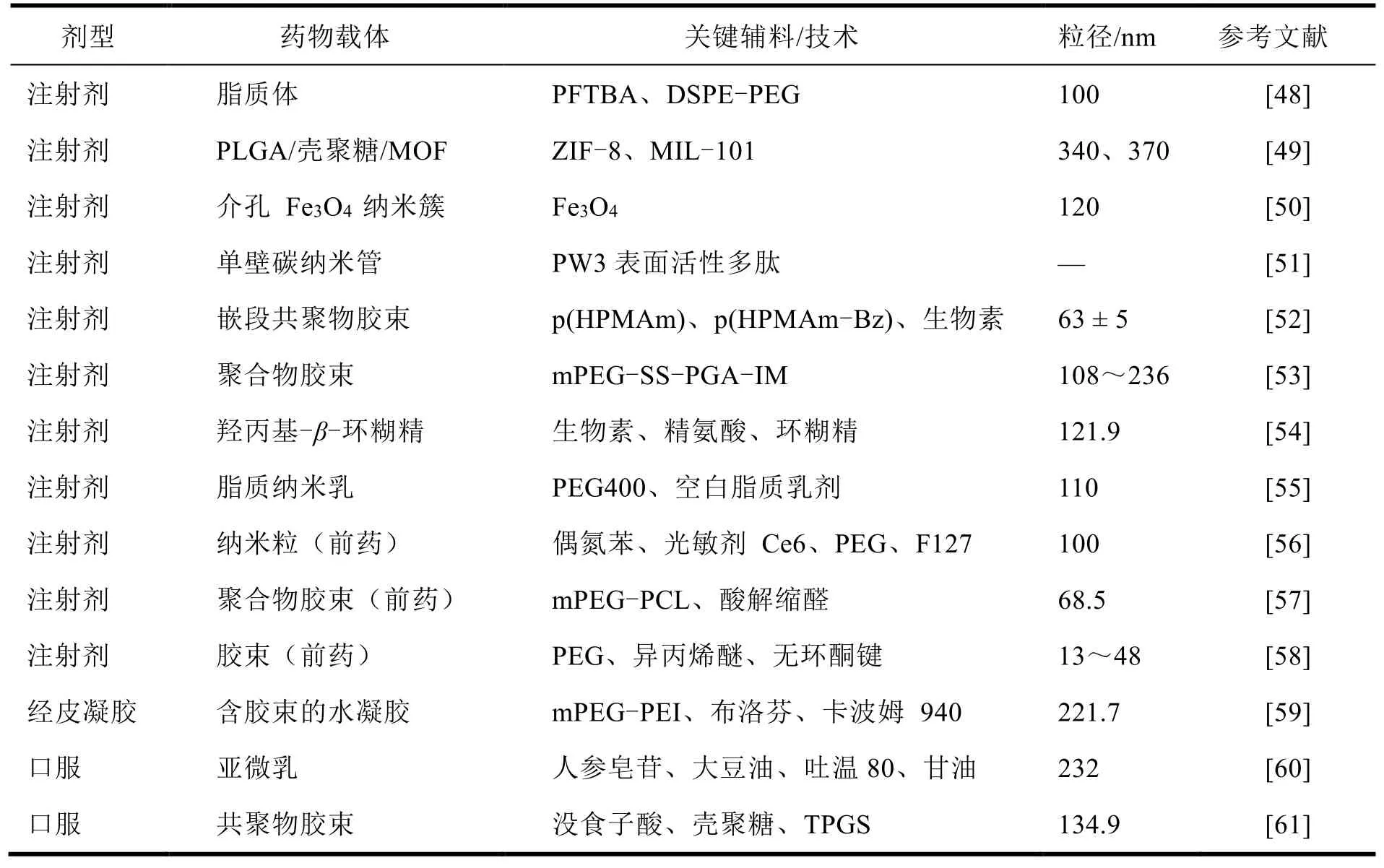
Table 2 Key information about novel paclitaxel nanopreparations 表 2 新型紫杉醇纳米制剂的关键信息
对以上内容进行梳理(见表 2)可一窥当前 PTX 新型制剂开发趋势,注射剂仍占很大比重,除此之外,口服制剂、经皮给药制剂也在研发之列。注射剂需要克服 PTX 溶解度、溶媒毒性等难题;口服制剂虽大大提高了患者依从性,但在兼顾抗肿瘤效果的同时提高溶解度和生物利用度也存在不小的挑战;经皮给药制剂也极大提高了患者依从性,然而,药物传递的效率受到从皮肤到肿瘤的生理屏障的高度限制,不易达到预期的治疗效果。正在开发的新型 PTX 递药载体包括但不仅限于以上所列举的材料,并可以在其设计基础上进一步修饰、功能化,随着药剂学、高分子材料科学和其他智能技术的发展,未来还会有更多功能性的新型 PTX 制剂进入临床,造福患者。
结语
第一个紫杉醇制剂 Taxol®上市距今已近 30 年,笔者回顾了目前已上市或仍在临床试验中的 PTX 制剂,尽管由于制剂配方和毒副作用等问题导致各类 PTX 的治疗效果不尽如人意,但PTX 对多种恶性肿瘤杀伤作用极强,仍是临床一线强有力的抗肿瘤药物,具有良好的开发前景,或可带来巨大的经济效益。各类制剂平台和新型药物递送系统的开发,包括脂质体、纳米粒、聚合物胶束、金属有机骨架、环糊精、水凝胶、壳聚糖、前药等均不同程度地改善了 PTX 的溶解性和安全性,并实现了 PTX 的给药途径多样化,但对 PTX 临床肿瘤治疗效果的改善仍有限,未来仍需对纳米给药进行更系统和详细的研究。新型制剂开发过程中除了要把握住药物的高效、精准递送,还应加强纳米制剂在肿瘤早期诊断、避免多药耐药、智能辅助个性化用药等方面的应用。随着药剂学、高分子材料科学以及智能技术的发展,未来还会有更多功能性的新型 PTX 制剂进入临床。综上所述,尽管 PTX 新型制剂开发仍存在不少挑战,但纳米技术平台仍然是未来提高抗肿瘤临床疗效的药物递送系统的希望所在。
