慢性阻塞性肺疾病病人慢性支气管炎和肺气肿表型转录组学数据的生物信息学分析
2022-10-17高丽娟秦江月申永春文富强
高丽娟,秦江月,徐 丹,申永春,陈 梅,陈 磊,文富强
1.四川大学华西医院 呼吸与危重症医学科/生物治疗国家重点实验室呼吸病学研究室(成都610041);2.成都市第五人民医院 呼吸与危重症医学科(成都 611130)
慢性阻塞性肺疾病(简称慢阻肺)是一种以持续存在的呼吸系统症状以及不完全可逆的气流受限为特征的常见慢性呼吸系统疾病,目前慢阻肺是全球排名前三位致死原因的疾病之一[1-2]。慢性支气管炎(简称慢支炎)和肺气肿是慢阻肺两个经典临床表型[3]。慢阻肺病人的慢支炎表型通常定义为每年慢性咳嗽、咳痰大于或等于3 个月,至少连续两年。慢支炎病理特征包括持续气道炎症,气道粘液高分泌[4],气道重塑及狭窄[5-6]。慢阻肺病人的肺气肿则是由于肺实质的破坏,随后终末细支气管远端的气道弹性下降,导致肺过度膨胀引起的[7-9]。慢支炎和肺气肿病人的临床症状和治疗反应存在明显差异。与慢支炎病人相比,肺气肿病人肺功能更差,呼吸困难症状更严重[10-11]。并且以肺气肿为主的慢阻肺病人对吸入性糖皮质激素和长效β受体激动剂的治疗反应欠佳,对于肺功能和呼吸困难的改善有限[12]。以上研究提示,慢支炎和肺气肿病人的发病机制可能并不完全相同。然而目前关于慢阻肺病人慢支炎表型和肺气肿表型的发生发展机制尚未完全阐明。而深入探索慢阻肺病人不同临床表型发病的分子机制,对于慢阻肺病人的精准治疗具有重要的临床意义。因此,本研究将通过分析数据库GSE69818中慢阻肺病人的肺组织转录组信息,探究慢支炎表型和肺气肿表型发生发展过程中可能的关键基因和信号通路。
1 资料与方法
1.1 资料来源
基因表达数据库(Gene Expression Omnibus,GEO)http://www.ncbi.nlm.nih.gov/geo是目前最完善的公共基因表达数据储存库,我们从中下载转录组数据GSE69818,数据是基于Affymetrix Human Genome U219 Array所获得的人转录组生物信息。GSE69818包含70个慢阻肺病人肺组织样本,其中包括38例肺气肿表型和32例慢支炎表型病人[13-16]。
1.2 获取差异表达基因
利用R 语言的Rank Pord 软件包分析慢支炎表型和肺气肿表型的差异表达基因,认为P<0.05为表达差异具有统计学意义。
1.3 差异表达基因的基因本体及通路富集分析
对筛选出的差异表达基因,利用DAVID(http://david.abcc,ncifcrf.gov)在线分析软件进行基因本体(gene oncology,GO)分析以及京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。P及错误发现率(false discovery rate,FDR)均小于0.05即视为具有统计学意义。
1.4 差异表达基因的蛋白相互作用网络图
STRING 数据库(http://http://www.string-db.org/)是一个包含多种蛋白质互作关系的数据库。对差异基因编码的蛋白利用STRING进行蛋白-蛋白相互作用网络分析。并将结果导入Cytoscape 软件导出编码蛋白互作用网络图(PPI)。
2 结果
2.1 差异表达基因分析
比较肺气肿组和慢支炎组,筛选得到3 734个差异表达基因,其中肺气肿组表达下调的基因2 073 个,表达上调的基因1 661个(见表1)。用差异基因绘制热图(见图1),与慢支炎组相比,红色表示上调基因,绿色表示下调基因。火山图则直接反映出差异基因的表达情况,如图1 所示,肺气肿组的基因大部分下调,这与下调的基因数的结果相符。
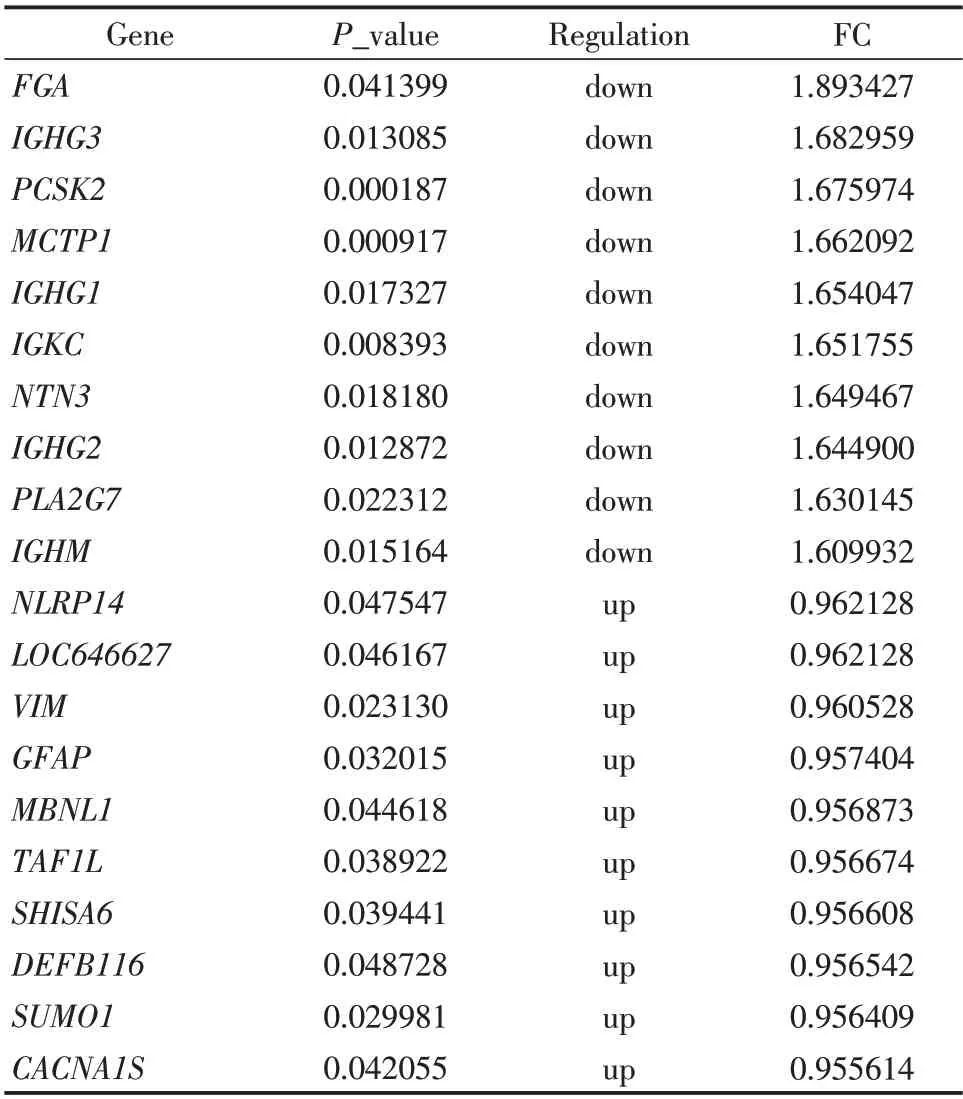
表1 前10名上调及下调差异表达基因Table1 The top 10 up-regulated and down-regulated mRNAs

图1 差异基因的火山图Figure 1 The volcanic map of DEGs
2.2 差异表达基因的GO分析
将筛选出的差异表达基因利用DAVID 进行GO 分析。GO分析获得了生物过程、分子功能、细胞组成3个部分的结果。其中在生物学过程中,差异基因主要涉及生物行为、生物黏附和生物相,分子功能中主要富集到抗氧化活性和催化活性,细胞组成主要包括细胞连接、细胞外区域和大分子络合物(见图2)。其中在生物学过程中,上调基因主要涉及表皮的发育、运动节律和嘌呤碱基转运,分子功能主要涉及抗原结合、B细胞分化、和碱性磷酸酶活性,细胞组成主要包括T细胞受体复合体、高密度脂蛋白粒子和ABC 转运体复合物。而对于下调的差异基因,在生物学过程中主要富集于无损侧枝发芽、轴突中线选择点识别和平滑内质网钙离子稳态。分子功能主要涉及肽酶激活活动、胶原蛋白绑定和细胞骨架蛋白绑定。细胞组成主要包括基底膜、血小板α颗粒腔和顶体内膜。

图2 差异基因本体分析Figure 2 GO analysis
2.3 差异表达基因的KEGG分析
根据KEGG 分析结果,差异基因主要富集到流体剪切应力,动脉粥样硬化,小细胞肺癌和ECM 受体连接(见图3)。差异表达基因中上调部分主要富集于甘油磷脂代谢、原发性免疫缺陷、甘油酸代谢,而下调部分主要涉及细菌侵袭上皮细胞、细胞外基质(ECM)-受体相互作用和cGMP-PKG信号通路。

图3 差异基因KEGG信号通路富集分析Figure 3 KEGG analysis
2.4 差异表达基因的蛋白相互作用网络图
选择P小于0.01差异表达基因构建蛋白互作用网络图,其中包含738 个节点,通过Cyoscape 软件筛选出排名前10的关键基因,包括ACTB、ITGB1、RHOA、FN1、SRSF1、CAV1、CTNNA1、VEGFA、HNRNPA1、APP(见图4),其中有9 个下调基因(APP、ITGB1、FN1、RHOA、CAV1、CTNNA1、VEGFA、HNRNPA1、SRSF1),1 个上调基因(ACTB)。
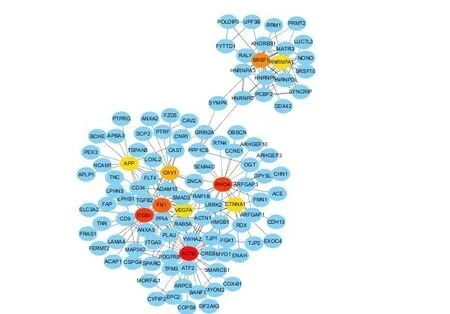
图4 差异表达基因的蛋白互作网络图Figure 4 PPI analysis
3 讨论
慢阻肺是一种慢性进行性疾病,而慢支炎和肺气肿是其重要临床表型,不同临床表型的慢阻肺病人对治疗反应以及临床结局存在明显差异。近年来,转录组学技术被广泛应用于研究疾病的遗传信息改变[17-18],进而了解疾病发生的分子机制。本研究表明,肺气肿和慢支炎表型病人的肺组织在转录组水平上存在显著差异。通过深入分析慢支炎和肺气肿表型病人肺组织的转录组学数据,有助于探索不同表型慢阻肺的分子机制的异质性,为其精准治疗提供新思路。
本研究通过Rank Pord软件包对GSE69818转录组数据进行分析,获得慢支炎表型和肺气肿表型慢阻肺病人肺组织差异表达的3 734 个基因,其中1 661 个上调基因,2 073 个下调基因。根据PPI 结果,筛选出10个关键基因,包括ACTB、ITGB1、RHOA、FN1、SRSF1、CAV1、CTNNA1、VEGFA、HNRNPA1、APP(图4)。大量研究表明FN1编码的纤连蛋白作为肺基质结构的重要组成成分,在慢阻肺小气道重塑中发挥着重要作用[19-20]。同时,筛选出的关键基因ITGB1可以编码蛋白质整合素β1,而整合素β1在肺发育过程中参与调节分支形态形成和肺泡形成[21]。并且有研究报道ITGB1基因突变小鼠肺组织在老年阶段表现出慢阻肺样改变,包括肺气肿改变、淋巴结增生和巨噬细胞浸润增加[22],提示ITGB1可能与慢阻肺肺气肿的发生发展密切相关,但具体机制尚不完全清楚。同时,本研究筛选出的关键基因CAV1的编码蛋白是细胞质膜结构成分之一,有报道发现CAV1敲低后,香烟烟雾刺激诱导的肺上皮细胞的细胞凋亡明显增加,此外,慢性香烟烟雾暴露后,CAV1基因敲除小鼠肺组织的细胞自噬和凋亡水平显著增加,肺气肿改变更明显[23],提示CAV1可能参与调控香烟诱导的肺气肿发生发展。但是,这些基因参与慢阻肺病人肺气肿表型的具体致病机制仍需进一步研究。
通过GO富集分析,我们发现差异基因富集于B细胞分化等免疫反应、内质网钙离子稳态等生物过程。有报道提出吸烟慢阻肺病人肺组织中记忆B细胞水平显著增加,并可能与抗原特异性免疫反应相关[24]。同时ROCA 等[14]报道指出在慢阻肺合并肺气肿病人肺组织中存在B 细胞相关基因的富集,而在慢支炎病人中却并没有相关基因富集。因此,B细胞相关免疫反应可能与慢阻肺肺气肿表型的发展密切相关,但是其相关的分子机制仍需进一步研究。同时,有研究证实病毒刺激可以诱导支气管细胞中内质网内钙离子减少,从而扰乱细胞内钙稳态,而细胞内钙离子流量变化可以触发NLRP3等炎症小体激活以及炎症因子IL-1β的分泌[25],IL-1β则在慢阻肺的气道炎症发展过程中起着重要作用,这提示本研究内质网钙离子稳态可能参与慢阻肺慢支炎表型的发生发展,但暂无相关研究报道其中具体机制。因此,本研究筛选到的相关生物学过程可以为今后更进一步研究慢阻肺不同临床表型的发病机制提供了新的可能和方向。
通过KEGG 路径富集分析,本研究发现在慢支炎表型中上调的基因富集到了细胞外基质(ECM)-受体相互作用和cGMP-PKG 信号通路。以往的研究表明,异常的ECM 沉积可以驱动气道炎症、修复、细胞迁移和增殖,也是慢阻肺小气道重塑的关键结构改变[26-28]。本研究发现FN1、COL4A1、COL4A2、COL6A3等基因均富集在了ECM 信号通路。其中COL4A1、COL4A2和FN1编码蛋白都是ECM 的重要组成部分[29-30]。同时FRANCIS 等[31]研究发现COL6A3 参与细胞外基质(ECM)的锚定和重塑。而本研究筛选出的关键基因SRSF1则是富含精氨酸/丝氨酸的剪接因子蛋白家族的成员,它们与ECM 组装有着密切的关系[32]。SUN 等[33]发现沉默SRSF1 可以抑制TGF-β1 诱导的人胎肺成纤维细胞增殖、分化和ECM沉积。以上参与调控ECM重塑的基因在慢支炎表型病人肺组织中上调,表明气道和肺实质中ECM 异常沉积可能参与影响慢支炎表型病人的气道重塑,但具体机制目前尚未完全阐述清楚。此外,有研究指出在肺部炎症病人的支气管上皮细胞中,cGMP-PKG通路显著下调[35],提示cGMP-PKG通路可能影响肺部炎症的发生,但其是否参与慢阻肺病人慢支炎的调控目前尚不清楚。因此,需要更多的研究探索慢阻肺病人慢支炎和肺气肿表型的具体分子机制。
4 结论与启示
本研究通过对GEO数据库中慢阻肺病人慢支炎和肺气肿表型肺组织的基因芯片数据进行深入挖掘与生物信息学分析,初步明确了调控慢阻肺病人慢支炎表型和肺气肿表型的可能关键基因及相关通路,为慢阻肺的精准诊治提供了潜在靶点,但后续还需要开展进一步的基础与临床研究,以探索慢阻肺病人的发病机制与临床治疗靶点。
(利益冲突:无)
