不同龋敏感性儿童口腔变异链球菌信号分子AI-2活性检测
2022-10-17韩林秀刘兴容
陈 岚,韩林秀,吴 菊,徐 皑,刘兴容
1.西南医科大学附属口腔医院儿童口腔科(泸州646000);2.重庆市开州区人民医院口腔科(开州405400);3.西南医科大学口颌面修复重建和再生实验室(泸州646000);4.西南医科大学附属口腔医院牙体牙髓科(泸州 646000)
群体感应(quorum sensing,QS)是细菌与细菌间进行信息交流,用以感受种群密度变化并协调种群间行为改变的重要通讯系统[1],QS系统有不同的类型,其中LuxS/AI-2广泛存在于革兰氏阳性菌和阴性菌中,是种间通用的交流系统[2]。LuxS/AI-2群体感应系统调控着细菌的多种重要生理过程,如生物发光、毒素的分泌、抗生素的合成、生物膜的形成、生物膜内质粒的转移以及耐药性等[3-7],因此深入研究AI-2 分子具有重要意义。
龋病是由牙表面致病性菌斑生物膜引起的一种典型口腔感染性疾病[8],菌斑生物膜中存在着多种细菌,变异链球菌(Streptococcus mutans,S.mutans)作为其中的关键细菌[9],能产生利于致龋生物膜形成和种间相互作用的信号分子[10]。研究发现牙菌斑中存在信号分子AI-2,能调节相关毒力因子的表达,在致龋过程发挥重要作用[11-12]。变异链球菌不同菌株之间致龋力存在很大差异[13],而不同致龋性变异链球菌信号分子AI-2的产生情况目前尚未见相关研究报道。本实验以课题组前期分离保存的不同龋敏感性儿童口腔变异链球菌临床分离株为实验对象,采用简便易行的哈维弧菌BB170生物学发光法定量检测[14]不同菌株间AI-2的表达差异,为进一步研究AI-2如何调节变异链球菌的致龋作用奠定基础。本研究经西南医科大学附属口腔医院伦理委员会审核同意。
1 材料与方法
1.1 实验菌株
不同龋敏感儿童口腔变异链球菌临床分离株(高龋株、中龋株、无龋株)均由本实验课题组前期分离,保存于西南医科大学口颌面修复重建和再生实验室;变异链球菌国际标准株UA159(简称UA159标准株)由四川大学华西口腔医学院国家级重点实验室提供;哈维弧菌BB170(vibrio harveyiBB170)购自北纳创联生物技术有限公司。
1.2 主要试剂及仪器
BHI 培养基、2216E 培养基(青岛高科园海博生物技术有限公司);甘露醇、蜜二糖、棉子糖、山梨醇、精氨酸双水解酶肉汤细菌微量生化鉴定管、七叶苷培养基(北京陆桥技术有限责任公司);总RNA 提取试剂盒(天根生化科技有限公司);逆转录试剂盒、SYBR Green荧光定量PCR 试剂盒(TOYOBO 公司,日本);Luxs引物、pfs引物、16SrRNA引物(上海生工生物科技有限公司)。
低温高速离心机,RT-qPCR 仪(Thermo 公司,美国);多功能酶标仪(Bio-Tek 公司,美国);核酸蛋白检测仪(凯奥公司)。
1.3 实验方法
1.3.1 细菌的复苏、培养及体外非应激条件下生长曲线的测定 将3 组变异链球菌及UA159 标准菌株复苏后,于BHI固体培养基上平板划线,37 ℃厌氧(80%N2、10%H2、10%CO2)培养至24 h 时进行革兰染色和生化鉴定。挑选每组菌株的单菌落至BHI 液体培养基中,每组3 管,37 ℃厌氧(80% N2、10% H2、10% CO2)培养24 h。3000 r/min 离心15 min,弃上清液,PBS 液漂洗,重复3 次,重悬,调节吸光度(optical density,OD)600=1;37 ℃厌氧培养18 h,每隔2 h从每组中各取出1管放置于4 ℃冰箱保存。每组每管分别吸取100 μL加入标准96 孔板,每管样本取3 次,多功能酶标仪测每组OD600值,绘制细菌生长曲线。
1.3.2 各组变异链球菌信号分子AI-2的活性检测
1.3.2.1 各菌株无菌上清液的制备 将各菌株按2%接种于BHI 液体培养基中,37 ℃厌氧培养至16 h(稳定期),3 000 r/min 离心15 min,收集上清液,用0.22 μm滤菌器过滤除菌;将哈维弧菌BB170 接种于AB 培养基,28 ℃连续培养12 h,以相同方法收集无菌上清液作为阳性对照;用0.22 μm 的滤菌器分别过滤AB 培养基和BHI 液体培养基,作为阴性对照和介质对照。各组滤液标记后于-80 ℃保存。
1.3.2.2 信号分子AI-2 的活性检测 将哈维弧菌BB170菌株接种于AB培养基中,28 ℃、90 r/min连续振荡培养12 h调节至OD600为0.8~1,菌液用新鲜AB培养基按照1∶5 000 的比例稀释,振荡混匀,将各组变异链球菌无菌上清液及阳性、阴性、介质对照与与上述稀释过的哈维弧菌BB170 培养液按照1∶100 的比例混合均匀,28 ℃振荡培养。1~6 h 内每间隔1 h,吸取200 μL于96孔全黑酶标板中,用多功能酶标仪检测其荧光强度值,样品与对照均取3个复孔,实验重复3次。
在6 h内,以阴性对照组的荧光强度值降到最低的时间点为基准,阴性对照组的相对荧光强度值为1,信号分子AI-2用相对荧光强度表示。以时间为横坐标,对应时间点的荧光强度值为纵坐标,然后根据得出的数据绘制曲线。计算公式如下:
待测组的相对荧光强度值=待测样品的荧光强度值/介质对照组的荧光强度值;
阳性对照组的相对荧光强度值=阳性对照的荧光强度值/阴性对照组的荧光强度值。
1.3.3 不同生长时期AI-2的活性检测
1.3.3.1 变异链球菌高龋株不同生长时期AI-2的活性检测 将高龋株按2%的比例接种于BHI 液体培养基中,共3 管,37 ℃厌氧(80%N2、10%H2、10%CO2)培养16 h,3 000 r/min 离心15 min,PBS 洗涤,重复3 次,BHI液体培养基重悬调节OD600为1,按1.3.2 方法收集在各生长时期(迟缓期、对数前期、对数中期、对数后期、稳定期)的无菌上清液,菌体用于总RNA 的提取。将各组上清液以同样方法进行AI-2的活性检测。
1.3.3.2 不同时间点信号分子AI-2与OD600的关系 将接种于BHI 液体培养基中的高龋菌株在37 ℃厌氧(80%N2、10%H2、10%CO2)培养4 h、8 h、12 h、16 h、20 h、24 h后,各时间点各3管,测定OD600值。并测定在不同时间点信号分子AI-2 的活性,收集数据,比较OD600与信号分子AI-2的关系。
1.3.4 RT-qPCR法检测LuxS和pfs基因的转录水平
1.3.4.1 细菌总RNA的提取及浓度测定 取不同生长时期的变异链球菌高龋株菌体,采用细菌总RNA 提取试剂盒提取菌株的RNA,在核酸蛋白检测仪上测定RNA浓度。
1.3.4.2 引物设计与合成 在NCBI Genbank 上搜索LuxS及pfs基因的DNA全长序列,应用Oligo7设计内参引物(16SrRNA-F和16SrRNA-R)及特性引物(LuxS-F和LuxS-R,Pfs-F和Pfs-R),由上海生工生物股份有限公司合成,具体见表1。

表1 16SrRNA、LuxS、Pfs引物序列Table 1 Primer sequences of 16SrRNA,LuxS and pfs
1.3.4.3 实时荧光定量PCR 根据cDNA逆转录试剂盒说明书配制20 μL反应体系,配制过程均在冰上进行,20 μL反应体系:ddH20 2.5 μL、Forward Primer 3 μl、Reverse Primer 3 μL、Template cDNA1.5 μL、SYBR qPCR Mix 10 μL。冰浴条件下行RT-qPCR,反应参数:95 ℃1 min,循环1 次,95 ℃15 s,60 ℃10 s,72 ℃30 s,循环45次,72 ℃5 min,循环1次。分析各个时间点的菌株LuxS、pfs及内参16SrRNA基因的溶解曲线、扩增曲线,数据分析采用相对定量分析—2-△△Ct法计算LuxS、pfs基因的表达水平。
1.4 统计学分析
采用SPSS 17.0对各组数据进行统计分析,实验结果用表示,多样本比较采用单因素方差分析,两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 形态学和生化鉴定结果
各组变异链球菌经革兰染色,光镜下(×100)观察细菌形态基本一致,均呈长短不一、链状排列,革兰染色均为紫色阳性,见图1。

图1 高龋株(1A)、中龋株(1B)、无龋株(1C)及UA159标准株(1D)(革兰染色,×100)Figure 1 High caries strains(1A),medium caries strains(1B),caries free strains(1C)and ua159 standard strains(1D)(Gram staining,×100)
如表2 所示,高、中、无龋株及UA159 标准株均可分解山梨醇、甘露醇、蜜二糖、棉子糖使其指示剂变黄,水解七叶苷使指示剂生成黑色沉淀,但均不能水解精氨酸。三组变异链球菌株的生化鉴定结果与变异链球菌标准株UA159的生化性状一致。

表2 生化鉴定结果Table 2 Biochemical identification results
2.2 体外非应激条件下生长曲线测定
在非应激环境下,四组变异链球菌株生长曲线趋势基本一致,见图2。在0~4 h生长缓慢,处于生长迟缓期;在4~8 h增殖速度加快,处于对数生长期;从8 h开始,速度减缓,12 h进入稳定期。高龋株各时间点的菌液浓度均高于无龋株,其差异有统计学意义(P<0.05);在4 h后,中龋株、UA159标准株菌液浓度均高于无龋株,差异具有统计学意义(P<0.05)。

图2 四菌株生长曲线测定结果Figure 2 Growth curves of four strains
2.3 各组变异链球菌AI-2的活性检测结果
以哈维弧菌BB170为阳性对照,AB培养基为阴性对照,利用哈维弧菌BB170测各组菌株AI-2的产生情况。由图3可知,在0~3 h内,随着培养时间的延长,阳性对照、阴性对照、介质对照的荧光强度均在不断降低,在3 h时阴性对照的荧光强度降到最低,随后开始升高,说明时间达到3 h时,指示菌产生的信号分子AI-2浓度达到诱导发光的时间阈值。因此,以3 h时的荧光强度值为基准计算相对荧光强度,表示信号分子AI-2活性。

图3 不同培养时间各样品的荧光强度值Figure 3 Fluorescence intensity values of samples at different culture times
三组变异链球菌均可以产生信号分子AI-2,相对荧光强度均大于阴性对照(图4)。其中高龋株的相对荧光值最大,不仅高于中龋株和无龋株,还明显高于阳性对照(P<0.05),因此在后续实验中选择高龋株作为高产信号分子AI-2菌株。
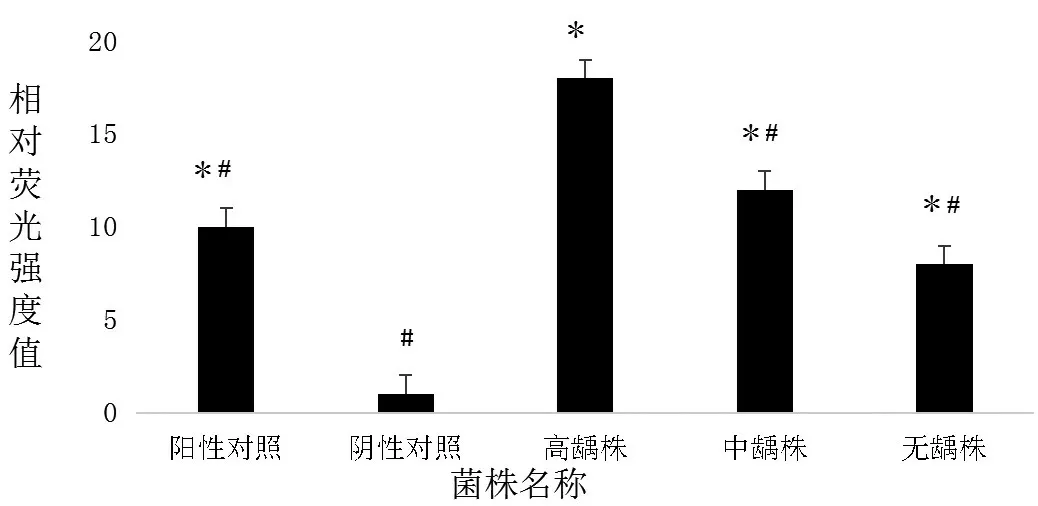
图4 各组变异链球菌相对荧光强度比较Figure 4 Comparison of relative fluorescence intensity of Streptococcus mutans in each group
2.4 不同生长时期高龋株AI-2的活性检测
对高龋株不同生长时期AI-2活性检测结果表明,在不同生长时期均有AI-2 产生,但在迟缓期、对数前期其产生AI-2 较少,从对数中期开始逐渐增加,到对数后期达峰值,显著高于其他生长时期(P<0.05),产生的AI-2 为阴性对照的19 倍,并在稳定期开始下降,如图5所示。
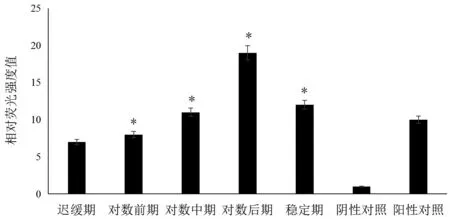
图5 高龋株不同生长时期相对荧光强度比较Figure 5 Comparison of relative fluorescence intensity of high caries strains at different growth stages
由图6 可知,在4~16 h 内,高龋株的OD600随着培养时间不断上升,在16 h 后达到一个稳定的状态。而在4~12 h内,AI-2信号随着培养时间不断增加,在12 h之后开始下降。

图6 高龋株上清液相对荧光强度与OD600的关系Figure 6 Relationship between relative fluorescence intensity of supernatant of high caries strains and OD600
2.5 不同生长时期LuxS 基因和pfs 基因的mRNA 转录水平
应用2-△△CT法分析不同时期LuxS基因、pfs基因的mRNA 水平。从表3、图7 中可知,LuxS和pfs基因的相对表达量随时间的增加趋势大致相同,在迟缓期到对数后期的过程中,LuxS和pfs的mRNA 水平逐渐升高,至对数后期达最高,LuxS为10.47 ± 0.35,大约为迟缓期的10.5倍,pfs为7.22±0.06,为迟缓期的7.2倍,均在稳定期开始下降。

图7 高龋株不同生长时期LuxS基因、pfs基因mRNA转录水平Figure 7 mRNA transcription levels of LuxS gene and pfs gene in different growth stages of high caries strains
表3 变异链球菌高龋株不同生长时期LuxS、pfs基因表达量(,n=3)Table 3 LuxS and pfs gene expressions of high caries strains of Streptococcus mutans at different growth stages(,n=3)

表3 变异链球菌高龋株不同生长时期LuxS、pfs基因表达量(,n=3)Table 3 LuxS and pfs gene expressions of high caries strains of Streptococcus mutans at different growth stages(,n=3)
3 讨论
儿童龋病是一项全球性的健康问题,患病率从23%到90%不等[15],变异链球菌作为首要的致龋菌[16],与多种细菌一起定植在口腔牙菌斑生物膜内,在儿童龋病中发挥重要作用。变异链球菌不同菌株间生长特性略有差异。在体外非应激条件下,不同龋敏感儿童口腔变异链球菌与UA159 标准株的生长周期基本相似,均有迟缓期、对数期、稳定期。高龋株与标准株生长速度相近,明显快于中龋株和无龋株(P<0.05)。说明在相同基因型不同龋敏感性的变异链球菌中,致龋敏感性高的变异链球菌,生长繁殖速度较快。
以哈维弧菌BB170作为报告菌株检测不同龋敏感儿童口腔变异链球菌临床分离株AI-2的表达情况,结果致龋敏感性越高的变异链球菌株,产生的AI-2 越多,说明密度感应系统调控变异链球菌致龋能力,然而具体是通过何种机制进行识别和调控目前还尚不清楚。研究发现,AI-2 可诱导变异链球菌葡糖基转移酶(glucosyltransferase,GTF)的表达,GTF 所合成的非水溶性葡聚糖是变异链球菌致龋的主要毒力因子之一[17-18]。因此我们推测本实验中高龋株产生的AI-2更多可能是与GTF表达更多有关。
在对许多细菌密度感应系统的研究中发现,胞外AI-2 的活性在对数中晚期达到峰值,在稳定期开始下降[19]。如曹素芳在奶牛隐性乳房炎大肠杆菌AI-2的研究结果表明,从对数中期开始细菌开始大量表达AI-2,到对数后期达到高峰,为阴性对照的12 倍[20]。在本实验中,高龋株在整个生长时期均有AI-2 产生,在对数后期生成的AI-2 达到最高峰。与上述的研究是相符的。AI-2在稳定期开始下降可能是因为变异链球菌生长繁殖的过程中,胞外AI-2 不断增加,当积累到一定程度,细菌周围的AI-2 可能会发生内化作用,从而参与调控某些重要功能[21]。目前研究较为清楚的是弧菌、大肠杆菌和沙门氏菌的AI-2信号分子的传递及内化途径。而有关变异链球菌的AI-2 的内化途径目前尚不清楚。
已知LuxS基因在细菌中高度保守,信号分子AI-2的合成途径也高度保守[22],是以pfs蛋白和LuxS蛋白催化底物S-腺苷高半胱氨酸酸(S-adenosylhomocysteine,SAH)合成的。也有研究利用纯化表达的LuxS 蛋白和pfs 蛋白在体外成功合成了具有生物活性的变异链球菌的AI-2 信号分子,证实了两种酶的生物学活性[23]。本实验为了研究变异链球菌产生的AI-2 信号分子与LuxS、pfs基因转录水平间的关系,检测了变异链球菌高龋株在不同生长时期的LuxS基因和pfs基因的转录水平,发现AI-2产生水平与LuxS转录水平具有高度相关性,而与pfs转录水平相关性相对略低,结果与白灏等[24]在禽致病性大肠杆菌的AI-2 产生水平与LuxS基因的转录水平具有高度相关性的研究保持一致。推测原因可能是LuxS是直接合成AI-2的酶,可直接与S-核苷高半胱氨酸(S-ribosylhomocysteine,SRH)底物发生反应,直接反应了LuxS的转录水平,而pfs 是在底物SAH 的作用下生成SRH,然后间接形成AI-2,在这过程中可能与细胞的代谢状态有关,也有可能本身pfs的表达相对较低,具体机制仍需进一步研究。目前龋病致病性生物膜中微生物间相互作用机制尚不明确[25],因此深入研究AI-2 信号通路有助于进一步研究牙菌斑生物膜的形成,发现群体感应系统与变异链球菌致龋性基因的关系,为龋病的防治找到新的方向。
4 结论
本实验结果发现不同龋敏感性儿童口腔变异链球菌临床分离株均能产生信号分子AI-2,致龋敏感性越高的菌株AI-2 产量越高。而该高龋株在不同生长时期AI-2 的生成与LuxS、pfs基因相关,且与LuxS基因的相关性更高。本结论可为进一步研究群体感应系统调控变异链球菌致病性的具体机制提供参考。
(利益冲突:无)
