补肺汤靶向调控PI3K/AKT/mTOR信号通路抑制骨肉瘤细胞增殖及侵袭机制
2022-10-17蒋沈君吴辛刚王思平徐叶峰刘云霞
蒋沈君 吴辛刚 王思平 徐叶峰 刘云霞
杭州市第三人民医院 杭州 310009
骨肉瘤是骨骼最常见的原发性恶性肿瘤,发病率约为3/100万[1],我国每年新增病例约0.65万例[2]。骨肉瘤细胞多呈高度恶性,远处转移率高,约80%~90%的患者确诊时就同时存在潜在转移灶,远处转移大多在肺,骨肉瘤肺转移的患者5年生存率低于20%[3]。因此,肺转移是骨肉瘤治疗失败的最常见原因,也是现阶段骨肉瘤治疗领域的瓶颈和最重要的突破方向。骨肉瘤属于中医“骨瘤病”范畴,机体正气亏耗,浊邪随经走络,深入骨髓,导致气虚血瘀,伤筋蚀骨,结毒成瘤,继而客于脏腑,日久成积,致复发转移。骨肉瘤肺转移以肺气虚为本,痰阻为标,形成骨肉瘤细胞易于生长的肺组织微环境,最终成为肿瘤细胞定植生长的“沃土”。本课题组在既往临床研究中,采用补肺汤(出自《永类钤方》)加减配合化疗防治骨肉瘤肺转移,获得较好的临床疗效[4],但作用机制尚不明确。本研究以大鼠骨肉瘤细胞为对象,研究补肺汤对骨肉瘤细胞增殖及侵袭的调控作用,并探讨其作用机制。
1 材料和方法
1.1 细胞 大鼠骨肉瘤细胞UMR-106细胞株由浙江中医药大学动物实验研究中心提供。细胞接种于含10%胎牛血清、链霉素100 U·mL-1、青霉素100 U·mL-1的洛斯维尔帕克纪念研究所(Roswell Park Memorial Institute,RPMI)1640培养液中,置于5%CO2、37 ℃的培养箱内,1~2 d换液1次,当细胞融合至80%左右传代,取对数生长期细胞用于实验。
1.2 主要药物与试剂 补肺汤由6味中药组成,生黄芪30 g(产地内蒙古,批号:210304)、党参10 g(产地甘肃,批号:201224)、五味子6 g(产地辽宁,批号:210227)、熟地黄15 g(产地河南,批号:210221)、紫菀10 g(产地河北,批号:201203)、桑白皮10 g(产地浙江,批号:210119),所有中药饮片均购于华东医药股份有限公司。将中药饮片放入煎锅中,加5倍水,浸泡1 h,保持沸腾30 min;加3倍水,再煎20 min,过滤、旋转蒸发得浓缩滤液,质量浓度调节至70%,沉淀24 h,离心去沉淀,浓缩成2.0 g·mL-1的中药水煎剂,调至pH值7.0~7.2,过滤灭菌,分装备用。Prime Script RT Master Mix逆转录试剂盒购于日本TaKaRa公司(批号:RR821A);实时荧光定量聚合酶链式反应 (Real-time quantitative polymerase chain reaction,Real-time qPCR) 预混液(Power Up SYBR Green Master Mix)试剂盒购于美国Sigma公司(批号:01030034);抗蛋白激酶B(protein kinase B,AKT)抗体、抗哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体、抗磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)抗体均购于美国Abcam公司(批号:ab32028、ab179463、ab191606)。
1.3 主要仪器 BD FACScan型流式细胞仪购于美国BD公司;qTOW-ER3G IVD型Real-time qPCR仪为德国耶拿分析仪器股份有限公司产品。
1.4 方法
1.4.1 实验分组 分为对照组和补肺汤低浓度组、补肺汤中浓度组和补肺汤高浓度组。对照组细胞以含10%胎牛血清、链霉素100 U·mL-1、青霉素100 U·mL-1的RPMI 1640培养液常规培养;补肺汤各浓度组细胞进入对数生长期后,分别用5%补肺汤 (低浓度组)、10%补肺汤(中浓度组)、15%补肺汤(高浓度组)干预48 h。预实验发现,10%的补肺汤对骨肉瘤细胞UMR-106增殖转移具有较强的抑制作用。因此本研究以浓度10%为中位值,选取浓度5%为低浓度组,浓度15%为高浓度组,分3个浓度阶梯进行研究。
1.4.2 噻唑蓝(methyl thiazolyl tetrazolium,MTT)比色法检测细胞增殖率 取对数生长期的UMR-106细胞,调整细胞浓度至1×105个·mL-1,接种于96孔培养板中。待细胞单层铺满孔底(贴壁)后,各实验组分别加入100 mL条件培养液,对照组各孔加入正常培养液继续培养。中药组各孔分别加入不同浓度的补肺汤,另设6个复孔,仅含培养液。各组细胞培养48 h后,更换新鲜培养液,每孔再加入5 mg·mL-1的MTT溶液20 mL。培养4 h后吸弃上清液,加入二甲基亚砜150 μL,用酶标仪检测490 nm和630 nm双波长吸光度(absorbance,A)值。计算不同浓度补肺汤干预后细胞增殖率,细胞增殖率(%)=(实验组A值/对照组A值)×100%。
1.4.3 划痕实验检测细胞迁移能力 操作前直尺及记号笔以紫外线灭菌30 min,用记号笔在6孔板背后均匀划横线,横穿过孔,每0.5~1 cm一道,保证至少3条线穿过同一孔。收集对数生长期的各组细胞,用RPMI 1640培养液重悬并计数,调整细胞数量约为5×105个/孔,细胞铺满孔底后,以10 μL的移液器头垂直于横线划痕,洗涤3次,洗去脱落细胞,补肺汤各浓度组分别用5%、10%、15%不同浓度的补肺汤干预48 h。分别于0、24、48 h,光镜下拍照,每组随机取5个视野,应用Image-Pro Plus Version 6.0软件测量迁移距离。在活细胞工作站下观察并用Image J软件测量划痕后0、24、48 h划痕面积,计算划痕面积百分比(%)=(划痕0 h划痕面积-其余各时相点划痕面积)/划痕0 h划痕面积×100%。
1.4.4 Transwell实验检测细胞侵袭能力 向Transwell下室各孔加入600 μL含低血清培养24 h的内皮细胞的条件培养液,上室每孔分别加入以上三组细胞浓度为2.5×105·mL-1的细胞悬液200 μL,具体操作按Corning Transwell说明书进行,用0.1%结晶紫染色30 min,光镜下观察并拍照计数,实验重复3次。
1.4.5 免疫印迹检测PI3K、AKT、mTOR蛋白表达 收集干预48 h后的各组细胞,提取总蛋白并以Lowry法测定蛋白浓度,上样后十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,完成电泳后,转膜并封闭过夜,分别加入PI3K、AKT、mTOR一抗孵育,洗涤后再加入二抗,增强型化学发光(enhanced chemiluminescence,ECL)检测,显影定影后以凝胶成像分析系统拍照。以β-actin为内参,采用SensiAnsys软件分析条带的灰度值,计算目的蛋白相对表达量。
1.4.6 Real-timeqPCR检测PI3K、AKT、mTOR 的mRNA表达 收集干预48 h后的各组细胞,提取总RNA,使用PrimeScript RT Master Mix逆转录试剂盒合成cDNA, 配制体系为RNA 500 ng,5×PrimeScript Mix 2 μL,焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水补充至10 μL,进行荧光定量PCR,用2-ΔΔCt法计算PI3K、AKT、mTOR mRNA相对表达水平。所用引物均由PrimerBank网站设计,由上海生工生物科技有限公司合成,引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.5 统计学分析 采用SPSS 20.0统计软件进行统计学分析,符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,满足方差齐性的资料组间两两比较采用最小显著性差异(least significant difference,LSD)法,方差不齐的资料采用Dunnett's T3法;非正态分布的资料组间比较采用非参数检验法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖比较 MTT结果表明,补肺汤干预48 h后,与对照组比较,补肺汤低、中、高浓度组细胞增殖率均显著下降(P<0.001,P<0.0001)。 与补肺汤低浓度组比较,中、高浓度组细胞增殖率均显著下降(P<0.0001)。与补肺汤中浓度组比较,高浓度组细胞增殖率显著下降(P<0.0001)。见图1。以上结果提示,补肺汤对UMR-106细胞增殖具有抑制作用。
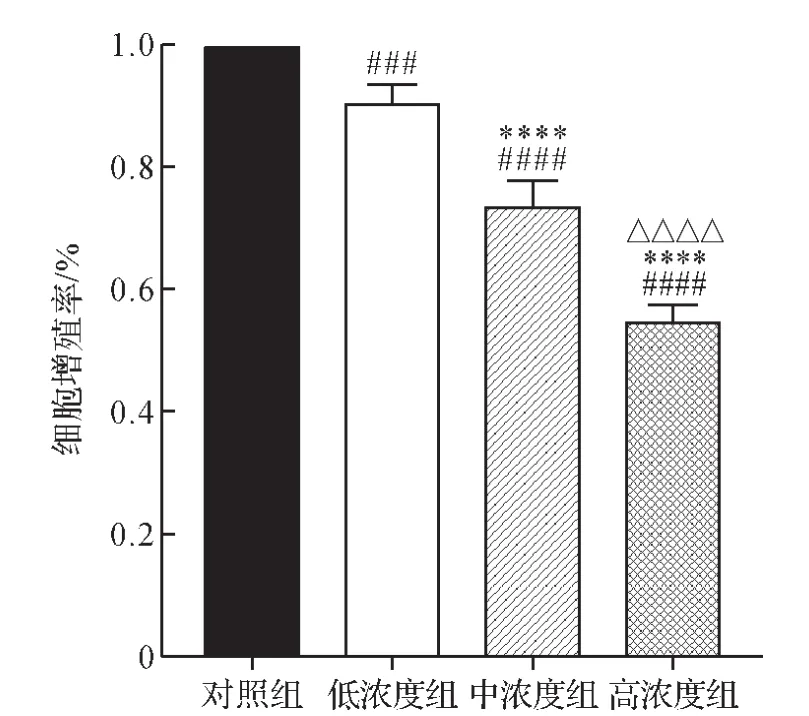
图1 各组细胞增殖比较Fig.1 Comparison of cell proliferation of each group
2.2 划痕实验中各组细胞迁移能力比较 划痕实验结果显示,与对照组比较,补肺汤低浓度组细胞迁移数量差异无统计学意义(P>0.05),而中、高浓度组细胞迁移数量明显减少(P<0.0001)。与补肺汤低浓度组比较,中、高浓度组细胞迁移数量明显减少(P<0.0001)。与补肺汤中浓度组比较,高浓度组细胞迁移数量减少(P<0.05)。见图2~3。以上结果提示,中、高浓度的补肺汤能够抑制UMR-106细胞迁移。

图2 划痕实验中各组细胞迁移能力(40×)Fig.2 Migration ability of each group in scratch test(40×)
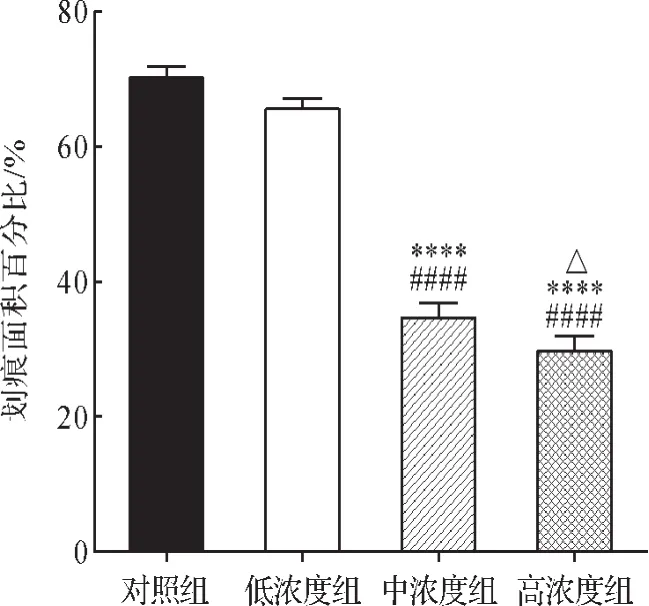
图3 划痕实验中各组细胞迁移能力比较Fig.3 Comparison of migration ability of each group in scratch test
2.3 Transwell实验中各组细胞迁移能力比较 Transwell实验结果显示,与对照组比较,补肺汤低浓度组穿过小室的细胞数量无统计学意义(P>0.05),而中、高浓度组细胞穿过小室的细胞数量明显减少(P<0.0001)。与补肺汤低浓度组比较,中浓度组细胞穿过小室的细胞数量减少(P<0.01),高浓度组细胞穿过小室的细胞数量明显减少(P<0.0001)。与补肺汤中浓度组比较,高浓度组细胞穿过小室的细胞数量差异无统计学意义(P>0.05)。见图4~5。以上结果提示,中、高浓度补肺汤能够抑制UMR-106细胞迁移。

图4 Transwell实验中各组细胞迁移能力(HE染色,20×)Fig.4 Migration ability of each group in Transwell test(HE staining, 20×)

图5 Transwell实验中各组细胞迁移能力比较Fig.5 Comparison of migration ability of each group in Transwell test
2.4 各组PI3K、AKT、mTOR蛋白表达比较 与对照组比较,补肺汤低、中、高浓度组PI3K蛋白相对表达量差异均无统计学意义(P>0.05)。与对照组比较,补肺汤低浓度组AKT、mTOR蛋白相对表达量差异无统计学意义(P>0.05);而中、高浓度组AKT、mTOR蛋白相对表达量均明显下调(P<0.05,P<0.001)。 与低浓度组比较,补肺汤中浓度组的AKT、mTOR蛋白相对表达量差异无统计学意义(P>0.05);而高浓度组AKT、mTOR蛋白相对表达量均明显下调(P<0.01)。与补肺汤中浓度组比较,高浓度组AKT蛋白相对表达量无统计学差异(P>0.05),而高浓度组mTOR蛋白相对表达量明显下调(P<0.01)。 见图6。
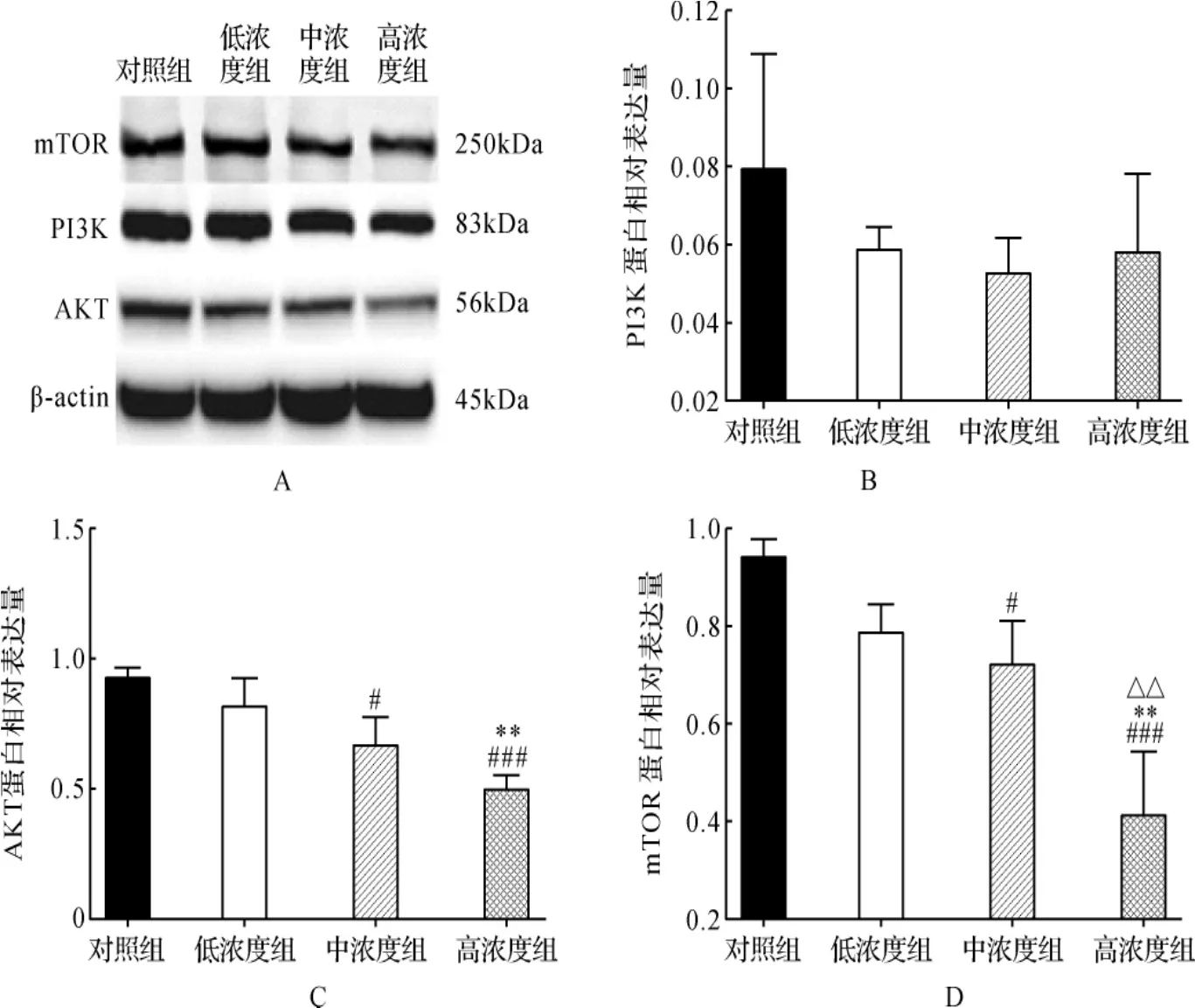
图6 各组PI3K、AKT、mTOR蛋白表达比较Fig.6 Comparison of PI3K,AKT and mTOR protein expression in each group
2.5 各组PI3K、AKT、mTOR mRNA表达比较 与对照组比较,补肺汤低、中、高浓度组PI3K mRNA相对表达量均差异无统计学意义(P>0.05);低浓度组AKT、mTOR mRNA相对表达量差异无统计学意义(P>0.05);中、高浓度组AKT、mTOR mRNA相对表达量均明显下调(P<0.05,P<0.01,P<0.001,P<0.0001)。与低浓度组比较,中浓度组AKT mRNA相对表达量差异无统计学意义(P>0.05),而mTOR mRNA相对表达量下调 (P<0.05);高浓度组AKT、mTOR mRNA相对表达量均明显下调 (P<0.01,P<0.001)。与中浓度组比较,高浓度组mTOR mRNA相对表达量无统计学差异(P>0.05),而AKT mRNA相对表达量下调(P<0.05)。 见图7。

图7 各组PI3K、AKT、mTOR mRNA表达比较Fig.7 Comparison of mRNA expression of PI3K,AKT and mTOR in each group
3 结论
骨肉瘤是最常见的骨原发性恶性肿瘤,年发病率为(2~3)/100万[1],占原发性骨肿瘤的11.7%[1]。 早期可发生血行转移,大约90%的转移发生于肺,转移多见于2年之内[5]。目前综合治疗下,中晚期患者5年总生存率(overall survival,OS)低于20%[6]。 肺转移已成为骨肉瘤治疗失败及低生存的最主要原因,探寻有效安全的药物,改变适合骨肉瘤细胞在肺组织定植的微环境,减少肺转移的发生,已成为当前研究的主要方向。
肾主骨生髓,骨瘤病久,由腑入脏,耗伤肾精。《素问·玉机真脏论》说:“五脏受气于其所生,传之于其所胜,气舍于其所生,死于其所不胜。”即子病及母,肾为肺之子,故而肾(骨)病及肺。肺主呼吸运动,需肾纳气来协助,肾气充盛,才能通过肺的肃降功能将所吸清气下藏于肾。肾气亏虚,肾失摄纳,致肺失宣肃,津液不布,痰浊内生,痰瘀互结,癌毒邪居于肺,肺积乃成,导致骨肉瘤肺转移的发生。肺为贮痰之器,主通调水道,输布津液,若肺失宣肃,则易痰湿停留。肿瘤转移与痰浊、癌毒、血瘀、正气密切相关,无论是津液的运行还是气血的走行,均上达于肺,因此“贮痰之器”的肺首当其冲地成为骨肉瘤最易转移的脏器[7]。故在临床实践中,本课题组选用补肺汤防治骨肉瘤的复发转移。
骨肉瘤患者经化疗和手术治疗后脾胃损伤,失于健运,气血生化乏源,肾精亏耗,肺气虚弱,因此综合治疗后患者以肺肾两虚最为常见。在肿瘤治疗中,中医治未病思想“未病先安未受邪之地”与西医特异性地保护靶器官微环境的理念非常契合。本课题组在临床实践中选用《永类钤方》的补肺汤加减配合化疗防治骨肉瘤肺转移,获得较好的疗效[4]。该方由黄芪、人参(党参代)、熟地黄、五味子、紫菀、桑白皮组成,组方特点在于肺肾双补,无论是肾虚在先,继而肺虚;还是肺虚在先,引起肾虚,皆可使用。人参多由党参代,党参具有气阴双补之效,与黄芪共伍,益气养阴、益肺补脾,二药同为补气要药,走守兼顾,益阴鼓中,强心助肺;熟地黄补肾阴,补肾纳气;紫菀温肺下气、化痰止咳;五味子酸温而润,生津涩精、敛肺滋肾;桑白皮性味甘寒,清肺降气,诸药共用,共奏肺肾双补、金水相生之效。
研究发现,通过PI3K/AKT/mTOR信号通路调控尿路上皮相关基因1、p53基因、miR-32及mTOR,能抑制骨肉瘤细胞增殖和转移[8-11]。宋瑞鹏等[9]研究发现,41.8%(82/196)的骨肉瘤组织中mTOR高表达,与血管、黏膜侵袭,淋巴结转移,临床分期相关;且骨肉瘤早期与晚期的mTOR表达率存在显著差异。mTOR mRNA高表达的骨肉瘤细胞,侵袭及转移性显著增强,而且容易发生耐药[12]。上述研究显示,PI3K/AKT/mTOR信号通道在骨肉瘤细胞的增殖迁移中有极其重要的作用,通过药物靶向调控该信号通路能够在一定程度上抑制骨肉瘤细胞的侵袭。研究发现,黄芪能通过PI3K/AKT信号通路抑制肺癌、乳腺癌细胞的增殖[13-15];人参皂苷能通过PI3K/AKT/mTOR自噬通路,延缓卵巢早衰,并能够抑制肺癌侵袭[16-17];五味子的活性成分也具有抑制肿瘤细胞增殖的作用[18]。上述研究结果与本研究证实的补肺汤调控骨肉瘤细胞增殖的机制基本一致。
本研究设置补肺汤低、中、高浓度组,是为了判断药物作用是否具有量效关系,从而明确补肺汤临床应用的最佳剂量。本研究设置了5%、10%、15%终浓度作为低、中、高3个浓度梯度。如按照等比倍增关系,应以20%终浓度作为高浓度组,前期预实验研究发现在此浓度下,骨肉瘤UMR-106细胞凋亡明显增加,不利于观察药物对细胞迁移的影响,因此本研究以15%作为高浓度组,确保实验结果的可重复性和科学性。本研究发现补肺汤水煎剂各浓度组均能够抑制骨肉瘤UMR-106细胞的增殖,划痕实验和Transwell实验证实中、高浓度补肺汤水煎剂能够抑制UMR-106细胞迁移。中、高浓度补肺汤还能显著抑制AKT、mTOR蛋白和mRNA表达,且高浓度组抑制作用更显著。由此可见,补肺汤能够较好地抑制骨肉瘤细胞增殖迁移,其作用可能与调控PI3K/AKT/mTOR信号通路活性相关。
综上所述,本研究初步探讨了补肺汤发挥抗骨肉瘤作用的分子机制,但补肺汤是否能够应用于临床防治骨肉瘤肺转移,有待进一步深入研究。本研究探讨了中医药靶向治疗的科学内涵和可行性,为临床更好地应用补肺汤提供了实验佐证。
