玉米秸秆制备Ⅰ、Ⅰ/Ⅱ、Ⅱ晶型纳米纤维素
2022-10-17宋文瑜史康杰李大纲王海莹
宋文瑜,史康杰,李大纲,王海莹
玉米秸秆制备Ⅰ、Ⅰ/Ⅱ、Ⅱ晶型纳米纤维素
宋文瑜,史康杰,李大纲,王海莹
(南京林业大学 材料科学与工程学院,南京 210037)
为了制备纤维素Ⅱ晶型的高长径比纳米纤维素,并与纤维素Ⅰ、Ⅰ/Ⅱ晶型的纳米纤维素进行性能的对比。文中以玉米秸秆纤维为原料,通过化学处理和机械研磨法制得纤维素Ⅰ、Ⅰ/Ⅱ、Ⅱ晶型的纳米纤维素,分别记为CNF–Ⅰ、CNF–Ⅰ/Ⅱ、CNF–Ⅱ。透射电镜观察表明,CNF–Ⅰ、CNF–Ⅰ/Ⅱ和CNF–Ⅱ的直径分布范围为5~50 nm、5~60 nm和5~80 nm。紫外可见分光光度计测试表明,3种CNF薄膜都具有良好的透光率。力学测试表明,CNF–Ⅰ膜的拉伸强度(184.7 MPa)较高,而CNF–Ⅱ膜则韧性较好,具有更高的断裂伸长率(12.5%)。在CNF–Ⅱ的制备中,脱木素技术对晶型转化(纤维素Ⅰ晶型转化为纤维素Ⅱ晶型)和后续机械纳米化影响较大;通过化学处理结合机械研磨法可制得高长径比的CNF–Ⅱ,一次研磨法产率高达80%,工艺简便,操作难度和制取成本较低。
玉米秸秆;纳米纤维素;纤维素Ⅰ;纤维素Ⅱ;晶型
纤维素是自然界中储量极为丰富的可再生资源,来源广泛、价格低廉、性能优异[1],具有良好的生物降解性和生物相容性[2-3]。近年来,纳米纤维素(CNF)作为纤维素的一种结晶形式,由于其优良的特性(比表面积大、力学性能高、长径比高、可生物降解等)而受到广泛关注[4],在食品包装、阻隔包装、智能包装及可降解包装等领域都具有良好的应用前景。纤维素有Ⅰ、Ⅱ、Ⅲ和Ⅳ等4种不同的晶型[5]。纤维素Ⅰ和Ⅱ是研究最多的纤维素晶型[6]。纤维素Ⅱ可经碱液丝光处理或溶解再生得到[7]。与纤维素Ⅰ相比,在纤维素Ⅱ中的链具有平行取向,以相反的极性堆叠,因此纤维素Ⅱ也被称为反平行链结构,是较稳定的纤维素多晶型物[8-9]。含有纤维素Ⅱ的丝光纤维素或再生纤维素的结晶度低于含有纤维素Ⅰ的天然纤维素[10]。纤维素Ⅱ结晶过程的改进可为丝光纤维素或再生纤维素的广泛应用提供一些帮助。Yue等[11]通过化学处理,从甘蔗渣中制得纤维素Ⅰ、Ⅰ/Ⅱ、Ⅱ晶型的微米级纤维素,实验结果显示经过质量分数为20%的NaOH丝光处理,可成功将纤维素Ⅰ转化为纤维素Ⅱ。Gao等[12]以小麦秸秆为原料,发现在NaOH的质量分数(10%)较低时,机械处理更有助于纤维素的分离和结晶转化。He等[13]发现通过高质量分数(18%)的碱性溶液提取的纤维素Ⅱ比低质量分数(4%)的碱性溶液提取的纤维素Ⅰ具有更致密的表面、更小的粒径和更高的热稳定性。纤维素Ⅰ广泛应用于服装、化妆品、医药等行业,纤维素Ⅱ的应用领域则更广泛,主要包括智能材料、包装材料、生物医学、增强材料和生物燃料生产等[11, 14]。
纳米纤维素(CNF)的尺寸和性能主要取决于原料来源和制备方法。以前,关于CNF的研究主要围绕纤维素Ⅰ晶型,基于Ⅱ晶型结构的CNF的研究也逐渐展开。Sèbe等[15]通过硫酸水解法从棉微晶纤维素中制得纤维素Ⅱ晶型纳米晶须(短棒状),并对其进行表征。Wang等[16]以木粉为原料,通过丝光处理制备了纤维素Ⅱ晶型CNF,其直径分布范围约为15~90 nm。Yue等[17]通过硫酸水解结合高压均质法从棉纤维中制得纤维素Ⅰ、Ⅱ型纳米晶须,并进行了比较。纤维素Ⅱ晶型的CNF比纤维素Ⅰ晶型的CNF的比表面积更大,表面有更多的羟基和还原性链端,易于进行后续的表面功能化修饰,在纳米复合材料、食品包装、药物释放、光电器件、生物传感等领域具有更广泛的应用前景[15]。
迄今为止,学者们发表了很多制备纤维素Ⅰ晶型CNF的方法,但对纤维素Ⅱ晶型的高长径比CNF的制备有待进一步研究。以玉米秸秆为原料,采用强碱丝光处理对纤维素Ⅰ进行晶型转变,通过化学机械法制备了3种不同晶型的高长径比的CNF,包括纤维素Ⅰ,Ⅰ/Ⅱ和Ⅱ晶型的纳米纤维素(简写为CNF–Ⅰ、CNF–Ⅰ/Ⅱ、CNF–Ⅱ),并对这3种晶型的CNF进行比较研究,包括对其化学成分、晶型结构、表面形貌、透光性能和拉伸性能的表征与比较。这将有助于阐明这3种类型的CNF在经历化学机械处理过程中的化学、物理和形态的演变,并有助于拓宽CNF的潜在应用范围。
1 实验
1.1 材料
材料:玉米秸秆粉(自制,80目);亚氯酸钠(NaClO2,质量分数为80%),上海麦克林生化科技有限公司;氢氧化钾(KOH)、冰醋酸、氢氧化钠(NaOH),南京市化学试剂有限公司。
1.2 不同晶型纳米纤维素的制备
玉米秸秆粉经烘箱在105 ℃条件下处理48 h,分别称取50 g粉末用于CNF的制备。CNF–Ⅰ(S2K1N)、CNF–Ⅰ/Ⅱ(0.5S1A2N)、CNF–Ⅱ(S1A2N)的制备方法流程见图1,样品编号分别为1#、2#、3#。其中S代表样品,S前面的数字代表了NaClO2酸的质量分数,S后面的数字代表了NaClO2酸处理的次数,K代表KOH处理,A代表NaOH强碱处理,N代表一次研磨机械纳米化。如1S2K1N代表玉米秸秆在经过质量分数为1%的NaClO2酸处理2次后洗至中性,然后经KOH处理,再进一步用质量分数为1%的NaClO2酸处理1次,最后进行一次研磨处理得到;1S2K1N前面若是1,可略去,简化为S2K1N。第1步将样品置于质量分数为1%的NaClO2溶液中进行酸处理时,配置的溶液质量为1 000 g,溶液中包括10 g NaClO2,在酸性条件下(滴定冰醋酸调节溶液酸性,pH保持在4~5),置于75 ℃的水浴锅环境中加热搅拌1 h。第2步将样品置于质量分数为15%的NaOH溶液中进行碱处理时,配置的溶液质量为600 g,其中NaOH的质量为90 g。
1)样品S2K1的制备。先将玉米秸秆粉用质量分数为1%的NaClO2在75 ℃下处理1 h,并将此过程重复2次。然后,将样品洗至中性,在室温条件下置于质量分数为5%的KOH溶液中浸泡12 h,再继续在95 ℃水浴条件下浸泡2 h。最后,将样品洗至中性,再用质量分数为1%的NaClO2溶液在75 ℃下处理1 h,进一步去除样品中残留的木质素。
2)样品0.5S1A2的制备。先将玉米秸秆粉用质量分数为0.5%的NaClO2在75 ℃下处理1 h。然后,将样品洗至中性,在25 ℃下置于质量分数为15%的NaOH溶液中浸泡12 h。再将样品洗至中性,在75 ℃下用质量分数为1%的NaClO2溶液处理1 h,并将此过程重复2次,进一步去除样品中残留的木质素。
3)样品S1A2的制备。先将玉米秸秆粉用质量分数为1%的NaClO2在75 ℃下处理1 h。然后,将样品洗至中性,在25 ℃下置于质量分数为15%的NaOH溶液中浸泡12 h。再将样品洗至中性,用质量分数为1%的NaClO2溶液在75 ℃下处理1 h,并将此过程重复2次,进一步去除样品中残留的木质素。
以上整个操作过程纤维始终保持水润涨状态。将3组纯化纤维素(S2K1、0.5S1A2和S1A2)配制成质量分数为0.8%的水悬浮液(质量计为0),通过相同的机械研磨法处理得到3种不同晶型的纳米纤维素1#、2#、3#,即置于石臼超细研磨机(MKCA6–3型,Masuko Sangyo,日本)中进行1次研磨,向左调整磨盘之间的间隙至0.25 mm,转速为1 500 r/min,研磨时间约为10 min。称取1次研磨后(松开磨石之前)的出料口溶液的质量,计为,算得到1次研磨后的得率(即/0)约为80%。
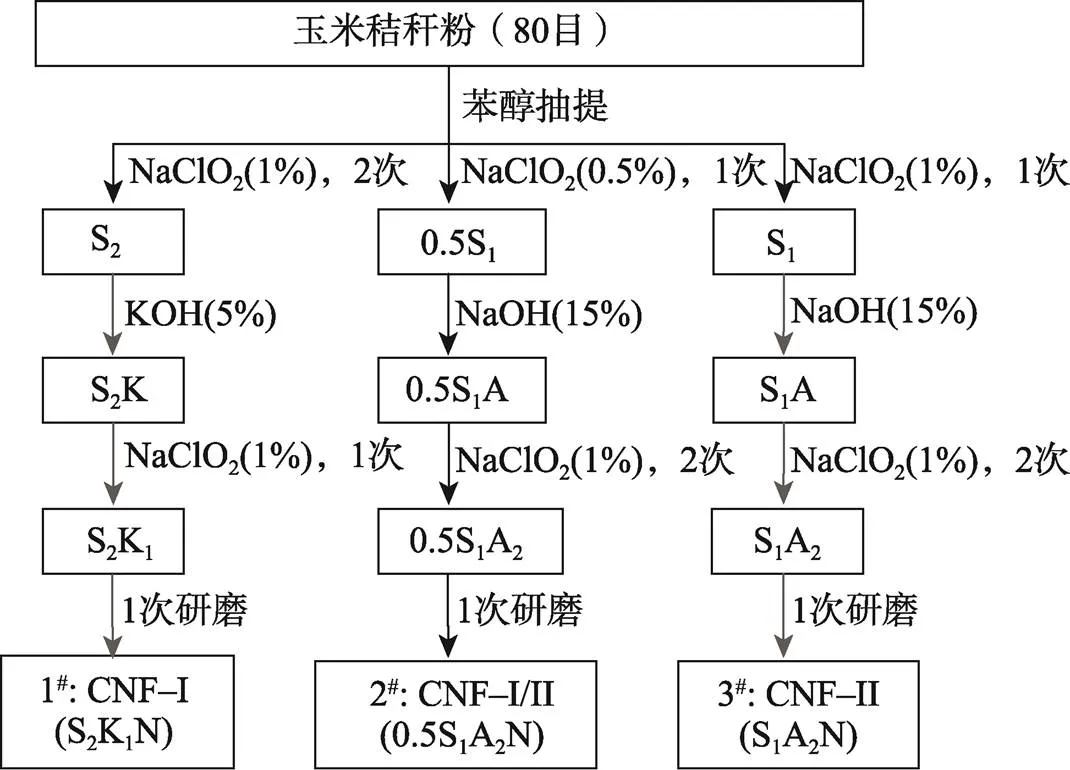
图1 不同晶型纳米纤维素的制备方法流程
1.3 纳米纤维素薄膜的制备
在CNF悬浮液中加入蒸馏水稀释至质量分数为0.2%,通过真空抽滤法得到CNF湿膜(使用孔径为0.2 µm的滤纸)。将CNF湿膜置于2片光滑的金属丝网之间,再夹在2片滤纸之间,最后置于2片玻璃板中,玻璃板上加一定的重量,置于60 ℃的烘箱中干燥48 h。干燥后CNF膜厚度约为40 µm,密度为1.36 g/cm3。
1.4 性能表征
1)化学成分测量。对经过苯醇抽提和化学处理的样品进行木质素、α–纤维素和综纤维素的测定。木质素的测定采用制浆造纸工业技术协会TAPPi–T222om–88的方法。综纤维素的测定采用TAPPi–T19m–54的方法。α–纤维素的测定方法:称取干燥后的样品1 g,在25 ℃下,将样品放入质量分数为17.5%的NaOH溶液中静置处理45 min;稀释后将溶液倒入坩埚中洗至中性,剩余未被溶解的物质即为α–纤维素;将装有未被溶解物质的坩埚移入烘箱中进行烘干至质量不变(105 ℃、12 h)。每组样品各取5组,数据取平均值。
2)X–射线衍射(XRD)分析。采用 Ultima Ⅳ型X射线衍射仪进行XRD分析,加速电压为40 kV、加速电流为30 mA、扫描角度为5°~40°、扫描速度为5(°)/min。利用压片机将未研磨前的粉末样品压成片状,将研磨后的纳米纤维素制作成薄膜,均选取长度为20 mm、宽度为20 mm的样品进行测试,所有样品在测试前需保持干燥。
3)透射电子显微镜(TEM)测试。将一滴稀释的CNF悬浮液(质量分数为0.04%~0.05%)滴于200目的铜网上。用滤纸吸收多余的液体,样品干燥后,在80 kV的加速电压下用透射电子显微镜(JEOL, JEM–1400)进行观察。
4)透光测试。将研磨后的纳米纤维素制作成薄膜,用于透光测试;选取表面平整无灰尘颗粒等缺陷的薄膜,厚度约为40 μm。利用紫外可见分光光度计(U–4100型,Hitachi公司,日本)进行测试,积分球直径为60 mm,测量的波长范围为200~800 nm,每个样品取3个不同的位置进行测试。
5)力学性能测试。使用万能材料试验机(GMT4204,深圳市新三思材料检测有限公司,中国)以1 mm/min的速度进行拉伸试验。将研磨后的纳米纤维素制作成薄膜,用于力学测试。样品长度为30 mm、宽度为6 mm、厚度约为40 μm、标距为20 mm。每个试样至少测试5组,取平均值。
2 结果与分析
2.1 化学成分测量
为了分析玉米秸秆纤维经过化学处理后其中化学成分的变化,对部分样品的木质素、α–纤维素和综纤维素进行了测试,见表1,包括玉米秸秆原料(S0)、经质量分数为0.5%的NaClO2酸处理1次的样品(0.5S1)、经质量分数为1%的NaClO2酸处理1次的样品(S1)、经质量分数为1%的NaClO2酸处理2次的样品(S2),以及经后续碱处理和进一步NaClO2酸处理后的样品(S2K1、0.5S1A2、S1A2)。以上样品在进行化学成分测量之前均经苯醇抽提过。
玉米秸秆原料S0有较高含量的木质素(23.1%)、较低含量的α–纤维素(32.1%)和综纤维素(73.0%)。经质量分数为0.5%的酸处理后得到的0.5S1,木质素含量降低到17.7%,α–纤维素、综纤维素均有少量增加。经质量分数为1%的酸处理后得到S1,其木质素质量分数从23.1%降低到了11.4%,去除了约一半;S1的α‒纤维素和综纤维素较0.5S1也有部分提升。经质量分数为1%的酸处理2次得到S2,木质素质量分数显著减少,仅为6.7%;α–纤维素和综纤维素的质量分数明显提升,分别为47.5%和85.6%。说明随着酸处理质量分数和次数的增加,玉米秸秆的木质素含量呈下降趋势,α–纤维素和综纤维素含量则呈上升趋势。经碱处理和进一步NaClO2酸处理后,S2K1、0.5S1A2、S1A2的木质素质量分数分别下降至4.9%、3.4%和1.9%,而α–纤维素质量分数分别显著增加了85.7%、84.9%、89.5%。前期的化学处理步骤和木质素脱除量对后续机械纳米化难易的影响,在形貌观察分析部分作进一步讨论。
表1 玉米秸秆纤维在不同化学处理阶段的成分含量
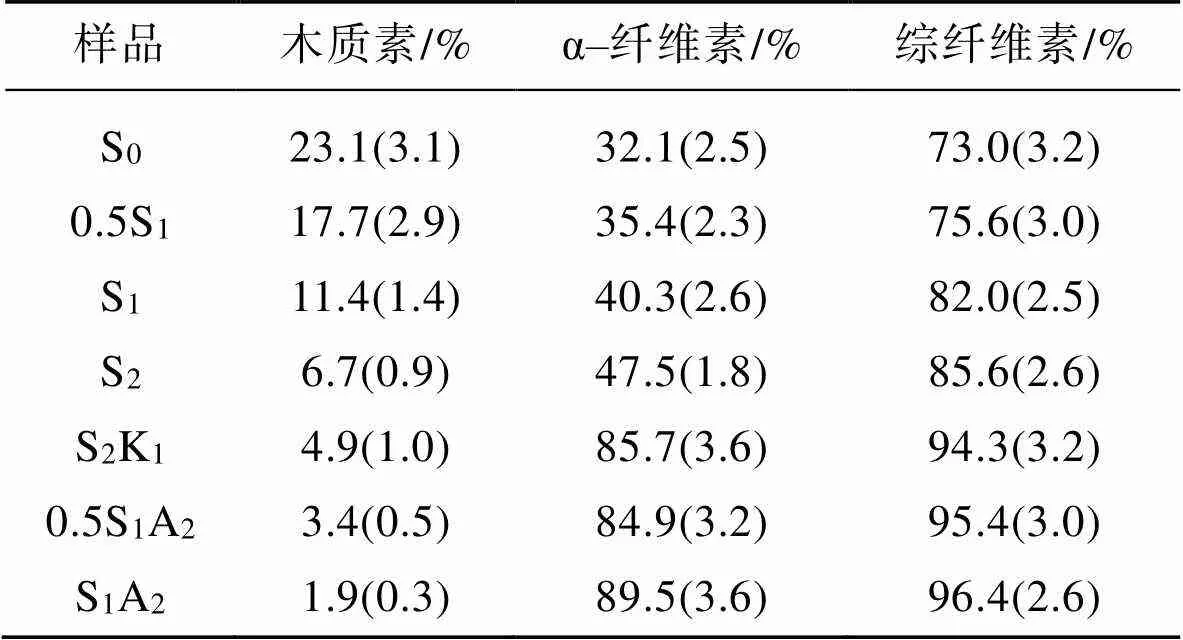
Tab.1 Component content of corn straw fibers in different chemical treatment stages
注:表中括号内的数字表示标准差。
2.2 X–射线衍射(XRD)分析
自然界中的植物纤维素主要以纤维素Ⅰ晶型存在。文中利用XRD分析强碱(NaOH质量分数为15%)丝光处理后样品的晶型结构变化,图2为不同化学处理下样品的XRD图谱。如图2a所示,玉米秸秆原料S0为纤维素Ⅰ晶型,主要在2为15.8°和22.5°出现衍射峰[18]。将S0经过质量分数为1%的NaClO2酸处理1次或2次,再经过质量分数为15%的NaOH处理后,得到S1A或S2A在2为12.3°、20.1 °和21.9°出现的衍射峰,即为纤维素Ⅱ晶型的特征峰。当样品经过质量分数为0.3%、0.5%、0.7%、0.8%的酸处理,再经过强碱处理后,可见0.3S1A、0.5S1A、0.7S1A、0.8S1A虽然在2为12.3°、20.1°和21.9°出现了纤维素Ⅱ晶型的特征峰,但是在2=15.8°处属于纤维素Ⅰ晶型的特征峰仍未消失,是Ⅰ/Ⅱ晶型共存状态。0.3S1A、0.5S1A、0.7S1A、0.8S1A未能成功转化成Ⅱ晶型的原因主要是酸处理脱除木质素含量较少。由表1可得,0.5S1仅脱除了原料中23.4%的木质素,而S1已经脱除了原料中50.6%(约一半)的木质素,S2已经脱除了原料中71.0%的木质素。如图2b所示,经过强碱丝光处理,以及进一步酸处理脱除木质素后,S2K1、0.5S1A2分别对应纤维素Ⅰ晶型、Ⅰ/Ⅱ晶型共存状态。S1A2和S2A1主要在2为12.3°、20.1°和21.9°时出现衍射峰,即为纤维素Ⅱ晶型的特征峰。图2a、b说明第1步酸处理质量分数为1%以下的样品难以在第2步碱处理后完全转化成纤维素Ⅱ晶型,基本以Ⅰ、Ⅱ晶型共存状态存在,证明第1步酸处理后残留过多木质素会阻碍纤维素Ⅰ晶型完全转化成纤维素Ⅱ晶型。由此可见,脱木素技术在纤维素晶型转化过程中的重要性[11],残留木质素的含量对晶型转化存在影响,这可能导致只有一部分平行的纤维素微原纤维可以重排至纤维素Ⅱ。如图2c所示,经一次研磨法得到样品1#、2#、3#的晶型结构并未发生变化,说明机械解纤处理对纤维素晶型的影响较小。
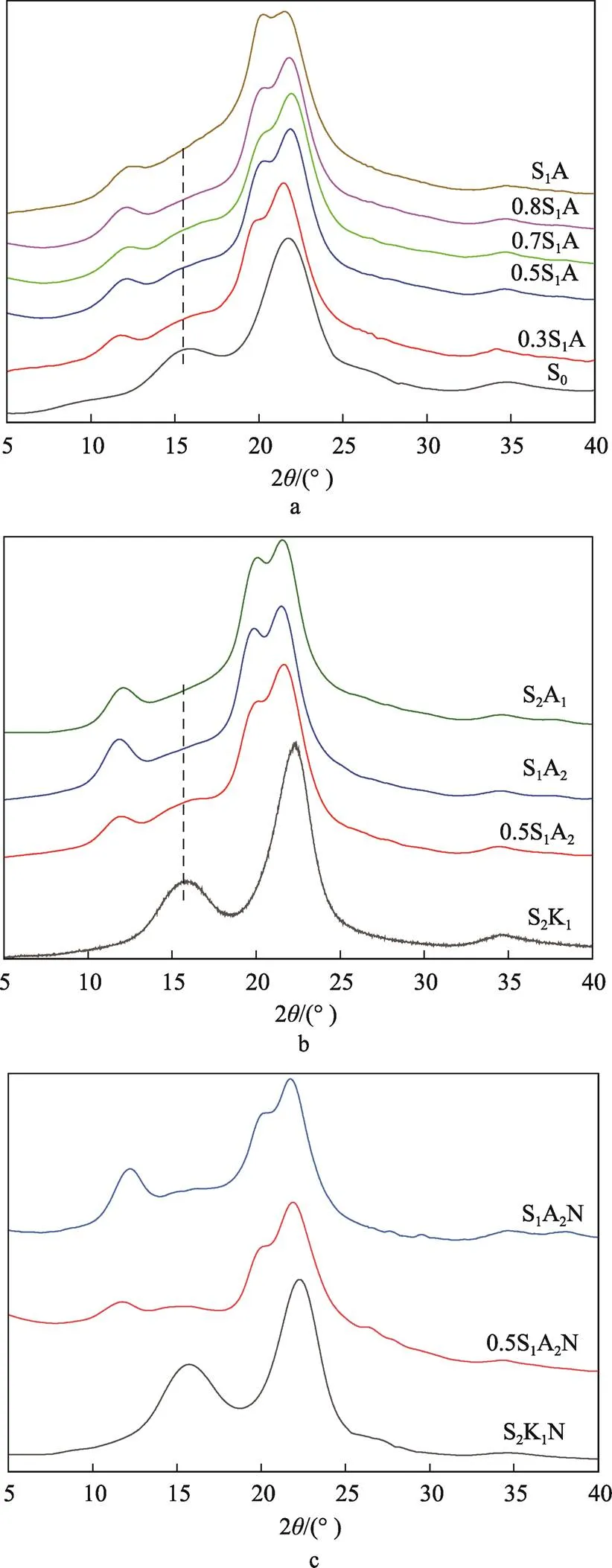
图2 不同化学处理下样品的XRD图谱
2.3 透射电子显微镜(TEM)分析
经过一次机械研磨处理后样品1#、2#、3#和S2A1N的透射电镜图见图3,可见3种CNF都表现出高长径比和三维网状结构。根据图3a—b所示,样品1#的直径为5~50 nm。图3c—d显示样品2#的直径分布范围为5~60 nm,且纤维分布较为均匀。图3e—f显示样品3#的纤维直径分布范围为5~80 nm,证明从玉米秸秆纤维中成功制备出了CNF–Ⅱ。
如图2b中XRD显示S1A2和S2A1已经转化为纤维素Ⅱ晶型,但两者的机械纳米化效果不同。图3e—f、图3g—h主要比较了样品3#和S2A1N中第1步酸处理后剩余木质素对后续的机械纳米化的影响,从图3g—h中可以发现S2A1N的纤维直径分布不均,有的纤维直径较大,纤维未均匀纳米化。这可能归因于前面表1中S2已经脱除了原料总木质素的71.0%,在强碱丝光处理过程中,细胞壁的微纤维更容易彼此交错结合,团聚在一起,从而导致后续机械纳米化变得困难[19]。如图3e—f所示,S1A2N的纤维直径分布相对均匀,这可能是因为S1A2N在第1步酸处理只脱除了一半木质素,而剩下的一半木质素在一定程度上阻止了丝光过程中相邻纳米纤丝的结合团聚,从而有利于后续的机械纳米化。
在先前的研究中,已经有通过其他方法生产得到纤维素Ⅱ纳米晶须。Yue等[17]硫酸水解丝光棉纤维后高压均质;所得的棒状纤维素Ⅱ纳米晶体(CNC–Ⅱ)的长度为(76±20)nm、宽度为(14.2±3.0)nm。在该研究中,获得的3种晶型的CNF均显示出高长径比,长度可达数微米;与棒状CNC相比,高长径比的CNF可以为增强复合材料性能提供更好的效果。
2.4 透光性能测试
3种晶型结构的CNF薄膜的透光率见图4,薄膜厚度约为40 μm。可见1#、2#、3#薄膜在200~800 nm波长内的透光率分别为75.5%、70.3%、61.3%。表明,通过一次研磨法所制得的这3种CNF薄膜都具有良好的透光率,这个结果与Wang等[16]的研究结果基本一致,其中,CNF–Ⅰ薄膜的透光率最高,其次是CNF–Ⅰ/Ⅱ薄膜、CNF–Ⅱ薄膜。这可能是由于图3a的CNF–Ⅰ薄膜较图3e的CNF–Ⅱ薄膜的纤维直径更小,而导致其透光率更高[20]。CNF薄膜的透明性也证明了通过适当的化学处理结合机械一次研磨法,可从玉米秸秆粉中获得直径分布相对均匀的CNF。Chen等[21]利用玉米皮制备了CNF薄膜,通过表面涂覆法使薄膜具备更大的透光性和更好的透明度。这种具有较高透光率的CNF薄膜有望取代塑料薄膜,应用在食品包装、生物医药、光电器件和电子设备等领域[22]。
2.5 力学性能测试
3种晶型的CNF薄膜的拉伸性能的对比见图5。CNF–Ⅰ薄膜的拉伸强度和弹性模量较高,分别为184.7 MPa和8 GPa,但断裂伸长率最低,为7.1%。CNF–Ⅰ/Ⅱ薄膜的拉伸强度、弹性模量和断裂伸长率介于CNF–Ⅰ薄膜和CNF–Ⅱ薄膜的之间,分别为128.2 MPa、6.5 GPa和11.3%。CNF–Ⅱ膜的拉伸强度(121.8 MPa)和弹性模量(5.6 GPa)虽然较CNF–Ⅰ膜低,但是CNF–Ⅱ膜韧性较好,断裂伸长率(12.5%)较高。CNF–Ⅱ膜的高断裂伸长率有望提升复合材料的性能,增加其韧性。结果表明,拉伸性能受CNF膜中晶体结构变化的影响,这与Wang[16]的研究相符,经碱处理后的CNF膜的模量降低了,但韧性明显提高了。CNF–Ⅰ/Ⅱ和CNF–Ⅱ膜的高韧性可能归因于CNF的晶型结构变化,经过强碱处理后纤维素Ⅱ晶体无定形组分增加,导致韧性高[16]。

图3 不同化学处理后样品的TEM照片
注:a、b为样品1#;c、d为样品2#;e、f为样品3#; g、h为S2A1N
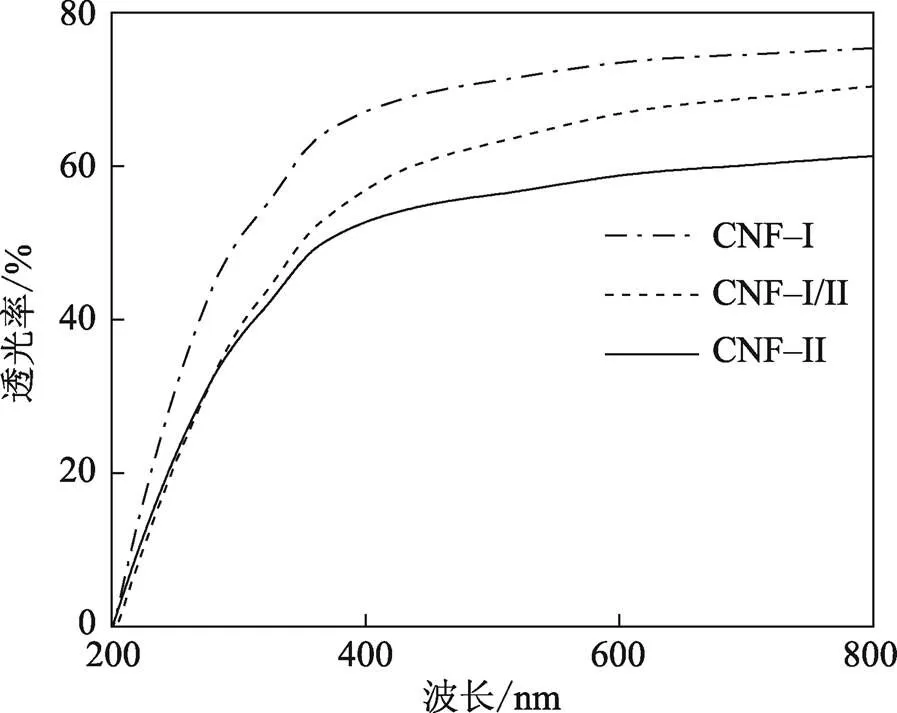
图4 3种纳米纤维素膜的透光率
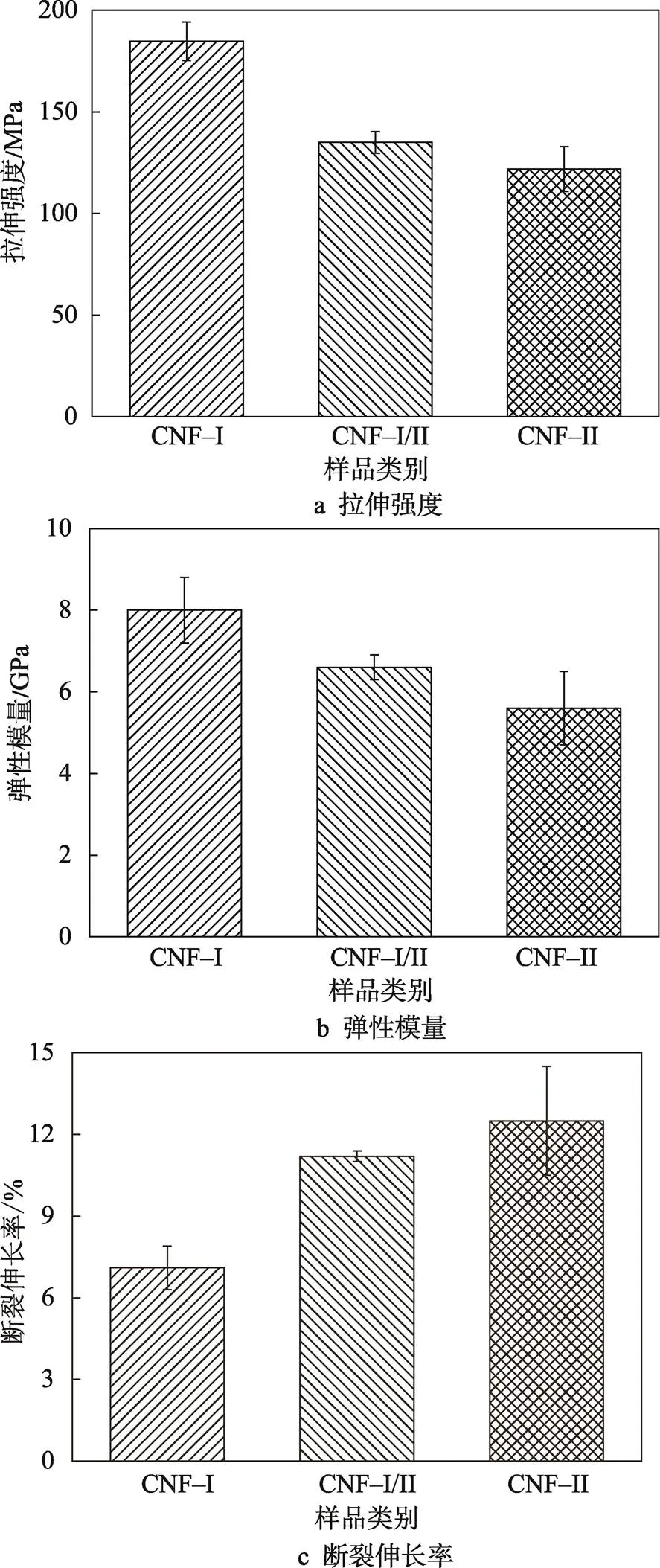
图5 3种CNF薄膜的力学性能
3 结语
采用脱木素技术制备玉米秸秆CNF–Ⅱ,对其晶型转化和后续机械纳米化影响较大。XRD分析表明,第1步酸处理浓度直接影响脱木质素的含量。当原料经过质量分数为1%酸处理1次后,可脱除近一半木质素,然后经过强碱丝光化处理可成功转化成纤维素Ⅱ晶型。最后采用简易的一次研磨法成功制得高长径比的CNF–Ⅱ。此方法工艺简便,一次研磨法产率高达80%,操作难度和制取成本较低。
当第1步酸处理质量分数小于1%时,再经过强碱处理后,纤维素晶型将转化为纤维素Ⅰ/Ⅱ晶型共存状态。另外,机械纳米化对晶型的改变影响不大。TEM表明,利用玉米秸秆粉制得的CNF–Ⅰ、CNF–Ⅰ/Ⅱ 和CNF–Ⅱ的直径分布范围为5~50 nm、5~60 nm和5~80 nm,呈现高长径比和三维网状结构。紫外可见分光光度计测试表明,3种CNF制成的薄膜都具有良好的透光性能;CNF的直径越小,透光率越高。力学分析表明,CNF–Ⅰ膜拉伸强度较高,而CNF–Ⅱ膜则韧性较好。这些不同晶型的纳米纤维素在食品包装、生物医药、光电器件和电子设备等领域都具有较好的发展前景。
[1] 孟傲杰, 赵辉, 郭丽芳, 等. 打浆–高压均质法制备与调控多尺度纤维素微纳米纤丝[J]. 林产化学与工业, 2020(4): 100-106.
MENG Ao-jie, ZHAO Hui, GUO Li-fang, et al. Preparation and Control of Multi-Scale Cellulose Microfibril by Beating-High Pressure Homogenization Process[J]. Chemistry and Industry of Forest Products, 2020(4): 100-106.
[2] 姚曜, 孙振炳, 李晓宝, 等. 羧甲基纤维素复合膜的研究现状[J]. 包装工程, 2022, 41(1): 10-16.
YAO Yao, SUN Zhen-bing, LI Xiao-bao, et al. Research Status of Carboxymethyl Cellulose Composite Film[J]. Packaging Engineering, 2022, 41 (1): 10-16.
[3] 王希, 郭露, 冯前, 等. 聚乙烯醇/纳米纤维素/石墨烯复合薄膜的制备与性能[J]. 林业工程学报, 2018, 3(5): 84-90.
WANG Xi, GUO Lu, FENG Qian, et al. Preparation and Properties of Polyvinyl Alcohol/Cellulose Nanofiber/ Graphene Composite Films[J]. Journal of Forestry Engineering, 2018, 3(5): 84-90.
[4] KEDZIOR S A, GABRIEL V A, DUBÉ M A, et al. Nanocellulose in Emulsions and Heterogeneous Water-Based Polymer Systems: A Review[J]. Advanced Materials (Deerfield Beach, Fla), 2021, 33(28): 2002404.
[5] SAIFULAZRY S O A, CHUAH T G, PARIDAH M T, et al. Influence of Cellulose Ⅱ Polymorph Nanowhiskers on Bio-Based Nanocomposite Film from Jatropha Oil Polyurethane[J]. Materials Research Express, 2020, 8(1): 1-11.
[6] ABDEL S K S M, IBRAHIM S Y. Physicochemical Characterization of Different Cellulose Polymorphs/Graphene Oxide Composites and Their Antibacterial Activity[J]. Turkish Journal of Chemistry, 2018, 42(2): 562-571.
[7] WADA M, WAKIYA S, KOBAYASHI K, et al. Three-Dimensional Alignment of Cellulose II Microcrystals under a Strong Magnetic Field[J]. Cellulose, 2021, 28(11): 6757-6765.
[8] AGARWAL U P, RALPH S A, BAEZ C, et al. Detection and Quantitation of Cellulose II by Raman Spectroscopy[J]. Cellulose, 2021, 28(14): 9069-9079.
[9] 黄丽婕, 张晓晓, 徐铭梓, 等. 木薯渣纳米纤维素的制备与表征[J]. 包装工程, 2019, 40(15): 16-23.
HUANG Li-jie, ZHANG Xiao-xiao, XU Ming-zi, et al. Preparation and Characterization of Cassava Residue Nanocellulose[J]. Packaging Engineering, 2019, 40(15): 16-23.
[10] ASTRUC J, GRANDBOIS M, LAROCHE G, et al. Rod- and Sphere-Shaped Cellulose Nanocrystals (CNCs) Type-Ⅱ Derived from Asclepias Syriaca Stem Residues: Composition, Morphology, and Thermal Properties[J]. Canadian Journal of Chemistry, 2021,99(3): 295-302.
[11] YUE Yi-ying, HAN Jing-quan, HAN Guang-ping, et al. Characterization of Cellulose I/II Hybrid Fibers Isolated from Energycane Bagasse during the Delignification Process: Morphology, Crystallinity and Percentage Estimation[J]. Carbohydrate Polymers, 2015, 133: 438-447.
[12] GAO C, YANG J, ZHANG H, et al. Quantitative and Qualitative Characterization of Dual Scale Mechanical Enhancement on Cellulosic and Crystalline-Structural Variation of NaOH Treated Wheat Straw[J]. Bioresource Technology, 2020, 312: 123535.
[13] HE H, AN F, WANG Y, et al. Effects of Pretreatment, NaOH Concentration, and Extraction Temperature on the Cellulose from Lophatherum Gracile Brongn[J]. International Journal of Biological Macromolecules, 2021, 190: 810-818.
[14] 王小英, 唐淑玮, 吴正国, 等. 生物质基高阻隔复合膜的研究现状[J]. 林业工程学报, 2021, 6(6): 13-22.
WANG Xiao-ying, TANG Shu-wei, WU Zheng-guo, et al. Research Status of Biomass-Based Composite Films with High Barrier Properties[J]. Journal of Forestry Engineering, 2021, 6(6): 13-22.
[15] SÈBE G, HAM-PICHAVANT F, IBARBOURE E, et al. Supramolecular Structure Characterization of Cellulose II Nanowhiskers Produced by Acid Hydrolysis of Cellulose I Substrates[J]. Biomacromolecules, 2012, 13(2): 570-578.
[16] WANG H, LI S, WU T, et al. A Comparative Study on the Characterization of Nanofibers with Cellulose I, I/II, and II Polymorphs from Wood[J]. Polymers, 2019, 11(1): 153.
[17] YUE Yi-ying, ZHOU Cheng-jun, FRENCH A D, et al. Comparative Properties of Cellulose Nano-Crystals from Native and Mercerized Cotton Fibers[J]. Cellulose, 2012, 19(4): 1173-1187.
[18] FRENCH A D. Idealized Powder Diffraction Patterns for Cellulose Polymorphs[J]. Cellulose, 2014, 21(2): 885-896.
[19] WANG H, CHEN C, FANG L, et al. Effect of Delignification Technique on the Ease of Fibrillation Of Cellulose Ⅱ Nanofibers From Wood[J]. Cellulose, 2018, 25(12): 7003-7015.
[20] LIN C, WANG Q, DENG Q, et al. Preparation of Highly Hazy Transparent Cellulose Film from Dissolving Pulp[J]. Cellulose, 2019, 26(6): 4061-4069.
[21] CHEN Q, XIONG J, CHEN G, et al. Preparation and Characterization of Highly Transparent Hydrophobic Nanocellulose Film Using Corn Husks as Main Material[J]. International Journal of Biological Macromolecules, 2020, 158: 781-789.
[22] QI Y, ZHANG H, XU D, et al. Screening of Nanocellulose from Different Biomass Resources and Its Integration for Hydrophobic Transparent Nanopaper [J]. Molecules (Basel, Switzerland), 2020, 25(1): 227.
Preparation of Nanofibers with Cellulose Ⅰ, Ⅰ/Ⅱ and Ⅱ Polymorphs from Corn Straw
SONG Wen-yu, SHI Kang-Jie, LI Da-gang, WANG Hai-ying
(College of Materials Science and Engineering, Nanjing Forestry University, Nanjing 210037, China)
The work aims to prepare cellulose Ⅱ nanofibers with high aspect ratio, and compare their properties with those of cellulose Ⅰ, Ⅰ/Ⅱ nanofibers. Cellulose Ⅰ, Ⅰ/Ⅱ and Ⅱ nanofibers (CNF-Ⅰ, CNF-Ⅰ/Ⅱ and CNF-Ⅱ, respectively) were prepared by chemical treatment and mechanical grinding with corn straw as the raw material. Transmission electron microscopy showed that the diameter distribution range of CNF-Ⅰ, CNF-Ⅰ/Ⅱ and CNF-Ⅱ were about 5~50 nm, 5~60 nm and 5~80 nm, respectively. Ultraviolet-visible spectrophotometer test exhibited that the three CNF films all had good transmittance. Mechanical tests showed that CNF-Ⅰ film had higher the tensile strength (184.7 MPa), while CNF-Ⅱ film was more ductile and had higher elongation at break (12.5%). During preparation of CNF-Ⅱ, the delignification technology has a great influence on the crystal transformation (from cellulose Ⅰ to cellulose Ⅱ) and subsequent mechanical nano-fibrillation. CNF-Ⅱ with high aspect ratio can be prepared by chemical treatment combined with mechanical grinding method. The yield rate of once grinding is up to 80%. It has the advantages of simple process, easy operation and low production cost.
corn straw; nanofibers; cellulose Ⅰ; cellulose Ⅱ; crystal type
O636.11
A
1001-3563(2022)19-0113-07
10.19554/j.cnki.1001-3563.2022.19.012
2022–01–22
国家自然科学基金(31800488);南京林业大学青年科技创新基金(CX2017003)
宋文瑜(1997—),女,硕士生,主攻生物质纳米材料、复合材料。
王海莹(1987—),女,博士,副教授,主要研究方向为生物质纳米材料、复合材料。
责任编辑:曾钰婵
