Hippo 通路核心蛋白在小鼠出生后不同时间点脑皮质中的表达变化
2022-10-16陈禹李希凡李凯璇陈晨黄希仕方方
陈禹,李希凡,李凯璇,陈晨,黄希仕,方方*
1.桂林医学院人体解剖学教研室,桂林 541004;2.桂林医学院科学实验中心,桂林 541004
Hippo 信号通路是一个调控组织器官大小及细胞增殖、分化和凋亡的高度保守的重要信号通路[1],于1995年因果蝇Warts(Wts)基因突变引起器官过度增长而被人发现[2]。这一通路在果蝇中的核心成分有Hpo、SAV(Salvador)、Wts、Mats 及Yki,它们在哺乳动物中的同源蛋白分别是MST1/2(Mammalian Ste20-like kinases 1/2)、SAV1、LATS1/2(Larger tumor suppressor 1/2)、MOB1(MOB kinase activator 1A/B)和YAP(Yes-associated protein)[3],在哺乳动物经典Hippo信号通路被激活后,MST1/2 会与SAV1 形成复合物,当MST1/2 在Thr183/Thr180 磷酸化会激活LATS1/2-MOB1A/B,激活的复合物随后磷酸化MOB1-Thr35 并使YAP 的Ser127 磷酸化,磷酸化的YAP 进入细胞质从而抑制其下游基因的转录表达导致细胞增殖受到抑制[4],反之,当Hippo 信号通路受到抑制、YAP 就会在核中聚集形成多种与转录激活相关的复合物。目前关于哺乳动物出生后早期Hippo 信号通路与神经发生相关的中文和英语文献,多是胚胎发育期的研究,本文通过对出生后不同时间点小鼠皮质中Hippo信号通路核心蛋白MST1、LATS1 的表达变化以及YAP 在皮质小胶质细胞中的定位,对Hippo 信号通路在小鼠出生后神经发生中的作用进行初步研究。
1 材料与方法
1.1 试剂
兔抗MST1 多克隆抗体、兔抗LATS1 多克隆抗体、兔抗YAP 单克隆抗体购自Cell Signaling Technology,鼠抗GAPDH 单克隆抗 体、兔抗IBA1 多克隆抗体购自Proteintech,辣根过氧化物酶标记山羊抗兔IgG 和辣根过氧化物酶标记山羊抗小鼠IgG 均购自Jackson Immuno Research Laboratories。多重荧光免疫组化染色试剂盒、ECL 化学发光检测试剂盒购自爱必信生物科技有限公司。Western 及IP 细胞裂解液、BCA 蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司,SDS-PAGE 蛋白上样缓冲液购自北京康为世纪生物有限公司、PageRuler 预染蛋白Marker购自Thermo Fisher Scientific Inc.公司,PAGE 凝胶快速制备试剂盒购自上海雅酶生物医药科技有限公司。
1.2 实验动物及处理
本实验所用健康成年C57BL/6 小鼠购买于湖南斯莱克景达实验动物有限公司(实验动物生产许可证SCXK 湘2019-0004),饲养于桂林医学院SPF级动物实验中心(实验动物使用许可证SYXK 桂2020-0005)。按照雌雄比2:1 合笼,待雌鼠怀孕后,将雌鼠单独饲养,雌鼠产下的子代用做实验,子代雌雄随机。在子代出生后(postnatal,P)3 d、6 d、9 d、3 周和8 周时取材,其中,P3d、P6d 和P9d 为出生后早期[5],P3 周为断乳期,P8 周为成体期。每个时间点取8 只,4 只开颅后立即称脑重再进行脑区分离用于后续Western Blotting 检测,4 只灌流用于后续免疫组织化学以及脑横径检测。
1.3 Western Blotting 检测蛋白表达水平
在研磨器中加蛋白裂解液至于冰中,冰上操作分离1.2 中用于Western Blotting 检测的小鼠的皮质区,放入已加入蛋白裂解液的研磨器中研磨,研磨充分后将蛋白移入EP 管中,超声3 次,超声间隙置冰上孵育,充分裂解后,BCA 法进行蛋白定量。后续步骤如文献[6]所述,使用NC 膜,10%分离胶,一抗稀释浓度分别为GAPDH 1:50000、MST1 1:1000、LATS1 1:1000,ECL 发光显影。
1.4 多重荧光免疫组化染色
酪胺信号放大(Tyramide signal amplification,TSA)技术采用HRP 标记的二抗,HRP 催化加入体系的荧光素底物,生成活化荧光底物,活化底物可与抗原上的酪氨酸共价结合,使样品上稳定地共价结合荧光素。之后用热修复洗去非共价结合的抗体,再换下一种一抗来第二轮孵育,换另一种荧光素底物,如此往复可实现使用同一种属来源的一抗多重标记。YAP 和IBA1 分别孵育TSA 单色荧光染料520 和570,具体实验步骤参照多重荧光免疫组化染色试剂盒说明书。染色脑片选取耳间冠状面前2.5 mm 至2.3 mm 间的脑片,共聚焦拍摄时选取紧邻正中线两侧的额叶部。
1.5 统计学处理
Western Blot 目的条带用Image LabTM software Version 3.0 进行分析,以目的条带/内参条带的比值代表目的蛋白表达的相对水平,每组实验以对照组为标准,将所测值进行标准化处理。利用Image pro plus对免疫荧光图片进行阳性细胞计数。最终统计结果均使用SPSS 19.0 进行统计学分析,两组之间进行ttest 法分析,多组间进行ANOVA 法分析,当P<0.05 时即具有统计学意义。
2 结果
2.1 小鼠在出生后五个不同时间点的脑重变化情况
脑重是衡量小鼠脑组织生长发育状况的重要指标之一,在P3d、P6d、P9d、P3 周和P8 周时对小鼠进行脑重测量,结果显示:除P3 周和P8 周组比较无显著性差异外,其余各组两两比较均有显著性差异(图1,表1),小鼠出生后早期到P3 周,脑重呈逐渐升高态势、增速显著,从断乳期P3 周到成体期P8 周,脑重水平无显著变化。

图1 小鼠在出生后5 个时间点的脑重变化情况与P3d组相比,***P<0.001,n=4Fig.1 The changes of brain weight in mice at five different time points after birth***P<0.001,compared with the P3d group, n=4
2.2 小鼠在出生后5 个不同时间点的脑横径变化情况
当小鼠P3d、P6d、P9d、P3 周和P8 周时,在小鼠耳间冠状面前0.64 mm 处测量脑横径。结果显示:脑横径随着时间推移不断增加,出生后早期脑横径增速明显。P8 周与P3 周相比脑横径虽显著增加,但增加速率低于出生后早期3 个时间点(图2,表1)。

图2 小鼠在出生后5 个不同时间点的脑横径变化情况A:五个不同时间点的小鼠脑横径图片B:脑横径统计结果 与P3d组相比,**P<0.01,***P<0.001,n=4Fig.2 The changes of brain transverse diameter in mice at five different time points after birthA: The pictures of brain transverse diameter of mice at five different time points; B: Statistical results of brain diameter **P<0.01,***P<0.001,compared with the P3d group, n=4
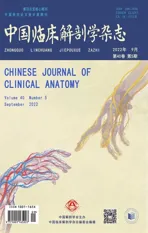
2.3 LATS1 和MST1 在小鼠出生后五个不同时间点皮质中的蛋白表达变化
LATS1 和MST1 是Hippo 信号通路上游的两个关键通道蛋白,其表达变化可以作为衡量Hippo 信号通路是否激活的指标之一。在对5 个时间点的小鼠皮质进行Western Blotting 检测后发现:与P3 d组相比,P9 d 之后LATS1 蛋白水平开始逐步显著性降低,P3周组和P8 周组蛋白水平降幅最大,LATS1 蛋白水平在P3 周与P8 周无组间差异(图3A 和B);与P3d组相比,MST1 在P6d、P9d、P3 周和P8 周蛋白水平显著降低,与P6 d 相比,MST1 在P9 d 无统计学意义、在P3周和P8 周时蛋白水平显著降低,与P3 周组相比,P8周组无统计学意义(图3A 和C)。
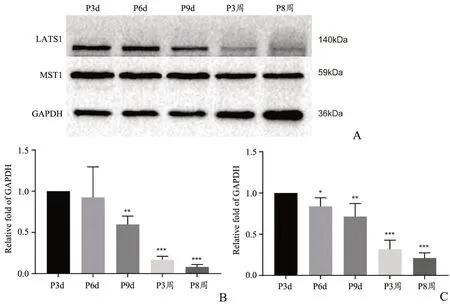
图3 A:LATS1 和MST1 的免疫印记图B:LATS1 蛋白相对定量统计图C:MST1 蛋白相对定量统计图 与P3d组相比,*P<0.05,**P<0.01,***P<0.001,n=4Fig.3 A: Immunoblot diagram of LATS1 and MST1; B: Relative quantitative statistical diagram of LATS1; C: Relative quantitative statistical diagram of MST1;*P<0.05,**P<0.01,***P<0.001,compared with the P3d group, n=4
2.4 小胶质细胞在小鼠出生后5 个不同时间点皮质中的计数及YAP 定位分析
Hippo 信号通路的核心是激酶级联反应,当Hippo 信号通路被激活后,上游的MST1/2 与SAV 结合形成复合体,激活并磷酸化LATS1/2,后者进而磷酸化YAP,磷酸化后的YAP 会出核滞留在胞浆中,反之,YAP 会停留在细胞核内参与形成转录复合体。因此,YAP 在细胞核内、核外的定位是判定Hippo 信号通路激活与否的关键。
出生后大脑神经细胞中数目发生改变的通常是神经胶质细胞,小胶质细胞就是其中一种。本实验使用IBA1 作为小胶质细胞标记物,利用IBA1 和YAP 对脑片进行免疫荧光共定位,计数小鼠出生后不同时间点皮质中小胶质细胞的数目并检测分析YAP 在小胶质细胞中的定位情况。计数结果显示,随小鼠鼠龄增长,皮质中小胶质细胞百分比逐渐上升,但从P3 周开始,小胶质细胞增速显著放缓(图4 和5A,表2)。伴随小胶质细胞数目增多的是YAP 在小胶质细胞中从核外转向核内聚集(图4 和5B,表2)。

图4 皮质中小胶质细胞及YAP 变化情况A:P3d组B:P6d组C:P9d组D:P3 周组E:P8 周组图中黄色为IBA1 所染的小胶质细胞,绿色为YAP 10X 图片标尺为100 μm,40X 图片标尺为20 μmFig.4 The changes of microglia and YAP in cortexA: P3d group; B: P6d group; C: P9d group; D:P3w group; E: P8w group;The microglia stained by IBA1 in yellow and YAP in green,the scale bar in the 10X picture was 100 μm,the scale bar in the 40X picture was 20 μm

表2 小胶质细胞在小鼠出生后5 个不同时间点皮质的变化情况以及YAP 在小胶质细胞中的表达情况(%)Tab.2 The changes of microglia in the cortex of mice at five different time points after birth and the expression of YAP in microglia(%)
3 讨论
Hippo 信号通路于1995年因果蝇Warts(Wts)基因缺失引起器官过度增长而被发现[2],Warts(Wts)在哺乳动物中的同源蛋白就是LATS1/2(Larger tumor suppressor 1/2),除LATS1/2 外,哺乳动物Hippo 信号通路的核心成分还有MST1/2(Mammalian Ste20-like kinases 1/2)、SAV1、MOB1(MOB kinase activator 1A/B)和YAP(Yes-associated protein)[3]。MST1/2 可通过磷酸化LATS1/2 的C 端疏水基序,促进LATS1/2 的自磷酸化而被激活[7],也可通过磷酸化MOB1,使LATS1/2 的活性抑制被解除而激活[8],但最终Hippo 信号通路发挥调控组织器官大小及细胞增殖、分化和凋亡的高度保守的[1]作用还是依靠YAP。LATS1/2 激活可以使YAP-Ser127 磷酸化,使得YAP 进入细胞质从而阻止其行使转录激活功能,反之,YAP 入核与多种转录因子结合调控靶基因表达[4]。
神经发育障碍是一组在发育阶段起病的疾病,孤独症(自闭症)谱系障碍(Autistic spectrum disorder,ASD)就是其中具有代表性的一种,社会交流缺陷、社交互动中使用非语言交流行为的缺陷以及重复刻板行为是ASD 的核心症状[9]并伴随患者终生。2020年1篇全国范围的ASD 统计调查显示我国患病率约为0.95%,但文中也指出由于对该病的公众意识不足、调查对象主要来源于城市人口,实际患病率会更高[10]。因为对ASD 病因及发病机制了解有限,尚无针对核心症状的治疗药物。作为广泛性发育障碍的代表性疾病,ASD 的大脑发育一直被关注,2017年就有研究指出ASD 患儿在出生后6-12月头围增大且皮质表面积的扩张速度远超正常人[11];国内相关研究也显示有90%的ASD 患儿在2~4 岁时全脑体积大于正常儿童,在顶叶、枕叶、额叶、颞叶和楔前叶等区域皮层厚度均高于正常儿童,而成年时则无显著差异[12]。类似的研究结果也出现在ASD 动物模型中,我国学者在丙戊酸钠(Valproic acid,VPA)孤独症大鼠中发现脑横径在出生后早期增大而后恢复正常[13],以上研究均表明,不管是ASD 患者还是动物模型,在出生后大脑早期发育时大都经历了体积先增大后恢复正常的过程。根据Hippo 信号通路的上述特点,我们推测ASD 患者或动物模型出生后早期头颅过大及脑容量增加可能与Hippo 信号通路异常有关。但当我们查找哺乳动物出生后早期Hippo 信号通路与神经发生相关的中文和英语文献时,查找到的多是胚胎发育期的研究[14],于是我们决定先对出生后早期Hippo 信号通路进行相关研究。
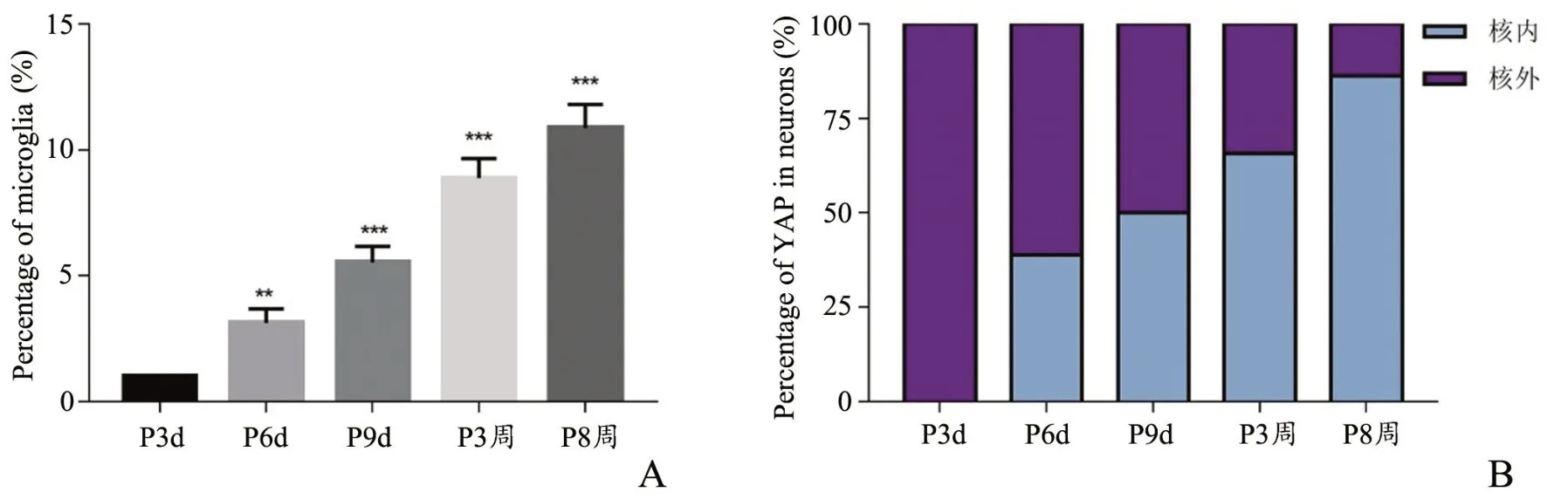
图5 小胶质细胞在小鼠出生后5 个不同时间点皮质的变化情况以及YAP 在小胶质细胞中的表达情况A:小胶质细胞百分比B:YAP 在小胶质细胞中的表达情况 与P3d组相比,**P<0.01,***P<0.001,n=3Fig.5 The changes of microglia in the cortex of mice at five different time points after birth and the expression of YAP in microgliaA: the percentage of microglia; B: the expression of YAP in microglia;**P<0.01,***P<0.001,compared with P3d group, n=3
根据Science 的文献我们将C57BL/6 小鼠P3、6、9 d 作为出生后早期,P8 周作为成体期[5],此外还增加了P3 周作为断乳期。实验结果显示,出生后早期小鼠脑重和脑横径快速增长,伴随快速增长的是Hippo 信号通路核心蛋白MST1、LATS1 和p-YAP-S127 显著升高。在对额叶中小胶质细胞进行检测后发现,IBA1阳性小胶质细胞数目在出生后早期增速明显,在与YAP 共定位后发现YAP 多分布在胞质中,以上结果证明Hippo信号通路在小鼠出生后早期皮质中被激活。
综上,Hippo 信号通路可能参与出生后早期皮质发育调控进而确保出生后大脑正常发育。理论上认为,体积的增大可能与细胞数目增多有关,这说明小鼠出生后早期应该存在神经新生,但Hippo信号通路如何在此过程中发挥作用,依旧需要进一步深入研究。