菌根真菌调控灌木铁线莲根际土壤生态化学计量特征对氮沉降的应激响应*
2022-10-16郝龙飞刘婷岩何永琴张盛晰
郝龙飞 刘婷岩 何永琴 张盛晰 赵 媛
(内蒙古农业大学林学院 呼和浩特 010019)
根际是受植物根系与土壤微生物相互作用的微域环境区(Kuzyakovetal., 2019),根际土壤中微生物活性、酶活性和养分含量等特征与非根际土壤存在显著差异(邵秋雨等, 2021; 刘婷岩等, 2021; Zhangetal., 2018)。根际微生态环境受氮沉降影响强烈,我国氮沉降呈由南向北扩展的趋势,过去30年干旱半干旱地区氮沉降量增幅超过全国氮沉降平均增幅水平,外源氮进入生态系统,影响土壤微生物群落结构,改变原有生态系统养分循环过程,存在激发效应(沈芳芳等, 2019)。研究发现,在氮富集和氮限制环境中氮输入对微生物活性和养分循环速率的影响存在显著差异(Treseder, 2008; Wangetal., 2018)。
丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是土壤微生物群落的重要组成部分,与植物形成共生关系后,其根外菌丝能形成菌丝网络,有助于植物吸收水分和营养物质,改良土壤结构,改善土壤微生物群落结构及酶活性,进而影响根际微生态环境(Rodríguez-Caballeroetal., 2017)。Xu等(2019)发现接种AMF后,玉米(Zeamays)根际土壤微生物数量增加,土壤酶活性提高,土壤质量得到改善。Choma等(2017)发现,土壤氮有效性变化显著影响氮敏感性真菌的群落结构。Han等(2020)研究表明,土壤氮含量增加降低AMF丰富度和菌根侵染率,氮添加可能影响菌根功能发挥。Sardans等(2012)发现,氮沉降增加会降低土壤碳氮比,提高氮磷比。但是随着氮输入持续增加,土壤有机质的化学特性会发生改变,影响胞外酶活性(陈倩妹等, 2019)。Burns等(2013)研究发现,土壤酶直接参与土壤生态系统的碳、氮和磷循环过程,能够指示土壤生境的细微变化。土壤酶化学计量可以评价微生物养分利用和养分需求,并在一定程度上指示土壤养分有效性。接种AMF和氮沉降处理通过影响土壤养分转化相关酶活性,导致土壤有效养分生态化学计量比发生改变(谷文超等, 2020; 勒佳佳等, 2020);然而,氮沉降和AMF交互作用调控根际土壤生态化学计量特征的研究相对缺乏。因此,在氮沉降背景下,研究我国脆弱生态系统中菌根真菌对根际微生态环境的调控影响,对分析生态系统稳定性具有重要意义。
内蒙古大青山是我国北方重要的生态过渡带,灌木铁线莲(Clematisfruticosa)是内蒙古生态脆弱和干旱的大青山的主要原生灌木,具有自然植被演替的潜力,分布于阳坡极端干旱且岩石裸露的环境中。以往研究发现,灌木铁线莲可与AMF之间形成良好的共生关系,这才使其能够适应极度干旱的阳坡环境(Liuetal., 2020)。本研究对比1年生灌木铁线莲菌根苗与非菌根苗根际土壤生态化学计量特征对氮沉降的响应规律,分析菌根生物技术对苗木根际土壤微生态环境的调控机制,以期为探究全球气候变化背景下生态系统稳定性提供理论参考。
1 材料与方法
1.1 试验材料 灌木铁线莲种子采集于内蒙古呼和浩特市新城区水磨村(111.84°E,40.96°N),将种子用2%KMnO4溶液消毒30 min,用去离子水冲洗3次以上,然后用于播种。
AMF选择前期研究中灌木铁线莲的优势共生菌根真菌——根内根孢囊霉(Rhizophagusintraradices)和摩西斗管囊霉(Funneliformismosseae)。2种AMF菌剂以紫花苜蓿(Medicagosativa)为宿主植物进行扩繁,扩繁基质为沙土(体积比为3∶1)混合物,最终的接种菌剂为扩繁基质、侵染根段、孢子和菌丝的混合物,施用的固体菌剂中孢子密度为每10 g土187个。
1.2 试验方法 1) 接菌处理 试验设置4种接菌处理,分别为单一接菌(根内根孢囊霉,简称+R; 摩西斗管囊霉,简称+F)、混合接菌(2种AMF 1∶1混合接菌,简称+RF)和未接菌(简称-M)。2019年10月,在育苗盆(直径15 cm,高度13 cm)放入经高温高压灭菌的基质(土与蛭石体积比为2∶1),基质体积占育苗盆体积的4/5,然后在灭菌基质上平铺等量均匀混合的菌剂30.0 g,消毒后的灌木铁线莲种子播入其中,其上再覆盖灭菌基质。浇透水后,置于内蒙古农业大学智能林木培养气候室(温度20~25 ℃,湿度40%~60%,最大光照强度10 000 lux)培养,每盆保留3株苗木。
2) 模拟氮沉降处理 2020年4月,测定接菌处理苗木菌根侵染率达到60 %以上(未接菌处理苗木菌根侵染率为0%),开始模拟氮沉降试验。参考国内外氮添加试验,并根据试验区氮沉降背景值(3.43 g·m-2a-1)(张菊等, 2013),设置4个氮沉降处理,分别为不施氮(0N,0 g·m-2a-1)、低氮(LN,3 g·m-2a-1)、中氮(MN,6 g·m-2a-1)和高氮(HN,9 g·m-2a-1)。以自来水溶解的KNO3和NH4Cl(NO3--N∶NH4+-N为1∶1)为氮源,施入量见表1,采用喷洒方式每隔14天向每盆施入氮溶液150 mL,共施氮10次(刘婷岩等, 2021)。氮沉降试验过程为模拟降雨过程,以湿沉降形式将氮带入生态系统,结合近10年生长季各月份降雨量权重计算施氮量。试验包括4种接菌处理和4个梯度氮添加处理,共16种处理组合,各处理培育15盆,每盆3株苗木,共计720株苗木。为保证根际土壤采样需求,每种处理组合培养45株苗木。

表1 模拟氮沉降每次每盆施氮量 Tab.1 The amount of simulated nitrogen deposition per pot each time mg
1.3 土壤样品采集及有效养分测定 2020年9月中旬,采用抖落法取植物根际土壤样品并分为2份:新鲜土壤和风干土样。新鲜土样过2 mm筛后,储存于4 ℃冰箱中,用于测定鲜土含水率、微生物生物量碳含量、微生物生物量氮含量、微生物生物量磷含量和溶解性有机碳含量; 另一份土样待自然风干后,过2 mm筛用于测定土壤有效养分。土壤样品用K2SO4溶液浸提(Bolan et al.,1996)后,利用TOC自动分析仪(luqui TOCII,Elementer,Germany)测定溶解性有机碳含量。采用碱解-扩散法测定碱解氮含量; 土壤样品经NaHCO3溶液浸提后,采用钼锑抗比色法测定有效磷含量(鲍士旦, 2000)。
1.4 土壤微生物生物量碳、氮、磷测定 采用氯仿熏蒸浸提法(Brookes et al.,1985; Joergensen et al.,1996),利用TOC自动分析仪测定土壤微生物生物量碳和微生物生物量氮含量; 采用熏蒸-无机磷测定法测定土壤微生物生物量磷含量(Brookes et al.,1982)。
1.5 根际土壤酶活性测定 土壤酶活性测定对象包括土壤碳循环相关酶(β-1, 4 葡萄糖苷酶,简称BG)、土壤氮循环相关酶(亮氨酸氨基肽酶,简称LAP; β-1, 4-N-乙酰-氨基葡糖苷酶,简称NAG)和土壤磷相关酶(碱性磷酸酶,简称ALP),各种酶活性的测定方法参考文献(Sinsabaugh et al.,1999),以对硝基苯酚的浓度表征土壤酶活性(刘婷岩等, 2021)。
酶化学计量特征计算公式:
C∶NEEA=lnBG/ln(LAP+NAG);
(1)
C∶PEEA=lnBG/lnALP;
(2)
N∶PEEA=ln(LAP+NAG)/lnALP;
(3)
Vector L=SQRT{[lnBG/ln(LAP+NAG)]2+
(lnBG/lnALP)2};
(4)
Vector A=DEGREES{ATAN2
[lnBG/lnALP, lnBG/ln(LAP+NAG)]}。
(5)
式中: C∶NEEA、C∶PEEA、N∶PEEA分别为与碳、氮和磷相关的土壤酶活性自然对数(ln)转化后的比值; Vector L为向量长度,相对较长的向量长度表示更大微生物相对碳限制; Vector L为向量角度,向量角度<45°表示微生物相对氮限制的程度,向量角度>45°表示微生物相对磷限制的程度(陈倩妹等, 2019); SQRT表示平方根计算; DEGREES表示弧度转换为角度的函数,ATAN2表示以坐标原点为起点,指向点(x,y)的射线在坐标平面上与x轴正方向之间夹角的角度。
1.6 数据处理 利用SPSS 23.0软件(SPSS for Windows)对接菌和氮沉降处理进行双因素交互作用分析,并用LSD多重比较法检验各处理苗木根际土壤生态化学计量特征的差异性。采用偏最小二乘路径模型(PLS-PM)确定根际土壤生态化学计量特征对微生物代谢限制影响的潜在途径,使用R语言(4.0.2)中的“plspm”包构建路径模型,并采用软件Sigmaplot10.0(Systat Software Inc)作图。
2 结果与分析
2.1 菌根真菌和氮沉降处理对有效养分计量特征的影响 接菌处理极显著(P<0.01)影响灌木铁线莲根际土壤溶解性有机碳∶碱解氮(DOC∶AN)、溶解性有机碳∶有效磷(DOC∶AP)和碱解氮∶有效磷(AN∶AP)化学计量比,氮沉降处理极显著(P<0.001)影响DOC∶AN和AN∶AP化学计量比,二者交互作用极显著(P<0.001)影响DOC∶AN、DOC∶AP和AN∶AP化学计量比。各接菌处理下,HN处理的DOC∶AN均最小。在-M和+R处理中0N处理的DOC∶AP最大,而在+F和+RF处理中,0N处理的DOC∶AP最小。+R、+F和+RF处理下,HN处理中AN∶AP最大,而-M处理下,在MN处理中AN∶AP最大,且均显著(P<0.05)高于LN处理。各氮沉降处理下,3种接菌处理中的DOC∶AN和DOC∶AP均高于未接菌处理。在0N、LN和MN处理下,+F处理的土壤AN∶AP均最小。HN处理下,-M和+R处理的土壤AN∶AP显著(P<0.05)低于+F和+RF处理(表2)。
2.2 菌根真菌和氮沉降处理对微生物生物量化学计量特征的影响 接菌处理、氮沉降处理以及二者交互作用均极显著(P<0.001)影响灌木铁线莲根际土壤微生物生物量化学计量比。-M处理下,LN、MN和HN处理的微生物生物量碳氮比(C∶NMic)、微生物生物量碳磷比(C∶PMic)均高于0N,而微生物生物量氮磷比(N∶PMic)均低于0N处理,且MN处理的C∶NMic和C∶PMic均最大,N∶PMic最小。在+R、+F和+RF处理中,随氮沉降量增加C∶NMic呈减小的趋势,而N∶PMic呈增加的趋势; +R和+F处理中的C∶PMic呈先增加后减小的趋势,而+RF处理中C∶PMic呈增加的趋势。0N处理下,+F和+R处理的C∶NMic较-M处理分别显著(P<0.05)增加2 194.3%和558.9%。LN处理下,+F处理的C∶NMic较-M、+R和+RF处理分别显著(P<0.05)增加208.5%、109.2%和209.4%。各氮沉降处理下,-M处理的C∶PMic均显著(P<0.05)低于+R和+RF处理,而与+F处理无显著差异。0N处理下,-M处理的N∶PMic显著(P<0.05)高于+R、+F和+RF处理; 而MN和HN处理下,-M处理的N∶PMic显著(P<0.05)低于+R、+F和+RF处理(表3)。

表2 接种菌根真菌和氮沉降对灌木铁线莲根际土壤有效养分化学计量特征的影响①Tab.2 Available nutrients stoichiometry characteristics in rhizosphere soil of C. fruticosa seedlings under inoculation of mycorrhizal fungi and nitrogen deposition treatments

表3 接种菌根真菌和氮沉降对灌木铁线莲苗木根际微生物生物量化学计量特征的影响①Tab.3 Microbial biomass stoichiometric characteristics in rhizosphere soil of C. fruticosa seedlings under inoculation of mycorrhizal fungi and nitrogen deposition treatments
2.3 菌根真菌和氮沉降处理对土壤酶化学计量特征的影响 表4表明,接菌处理极显著(P<0.001)影响灌木铁线莲根际土壤中与碳、氮和磷相关的土壤酶活性自然对数(ln)转化后的比值(C∶NEEA、C∶PEEA、N∶PEEA)、向量长度(Vector L)和向量角(Vector A),氮沉降处理极显著(P<0.001)影响N∶PEEA和Vector A,二者交互作用显著影响土壤酶C∶NEEA(P<0.01)、C∶PEEA(P<0.01)、N∶PEEA(P<0.001)、Vector L(P<0.05)和Vector A(P<0.001)。-M处理下,随氮沉降量增加C∶NEEA、C∶PEEA、Vector L和Vector A 呈增加的趋势,而N∶PEEA呈下降的趋势。+R、+F和+RF处理下,氮沉降处理对C∶PEEA和Vector L无显著影响。+R处理中,随氮沉降量增加,N∶PEEA呈先上升后下降的趋势,+F处理中LN、MN和HN处理的N∶PEEA显著高于0N处理,+RF处理中MN和HN处理的N∶PEEA显著高于0N和LN处理;而+R、+F和+RF处理中Vector A的变化规律与N∶PEEA相反。+R和+F处理下,LN处理的N∶PEEA均最大,分别较0N处理增加8.3%(P<0.05)和30.2%(P<0.05),LN处理的Vector A均最小,分别较0N处理降低了4.9%(P<0.05)和10.6%(P<0.05)。0N处理下,+R、+F和+RF处理的C∶NEEA、C∶PEEA、Vector A和Vector L均显著(P<0.05)高于-M处理,而N∶PEEA则相反。HN处理下,-M、+R和+F处理间Vector L无显著差异,而+R、+F和+RF处理的Vector A较-M处理显著(P<0.05)增加26.3%、13.9%和17.5%(表4)。
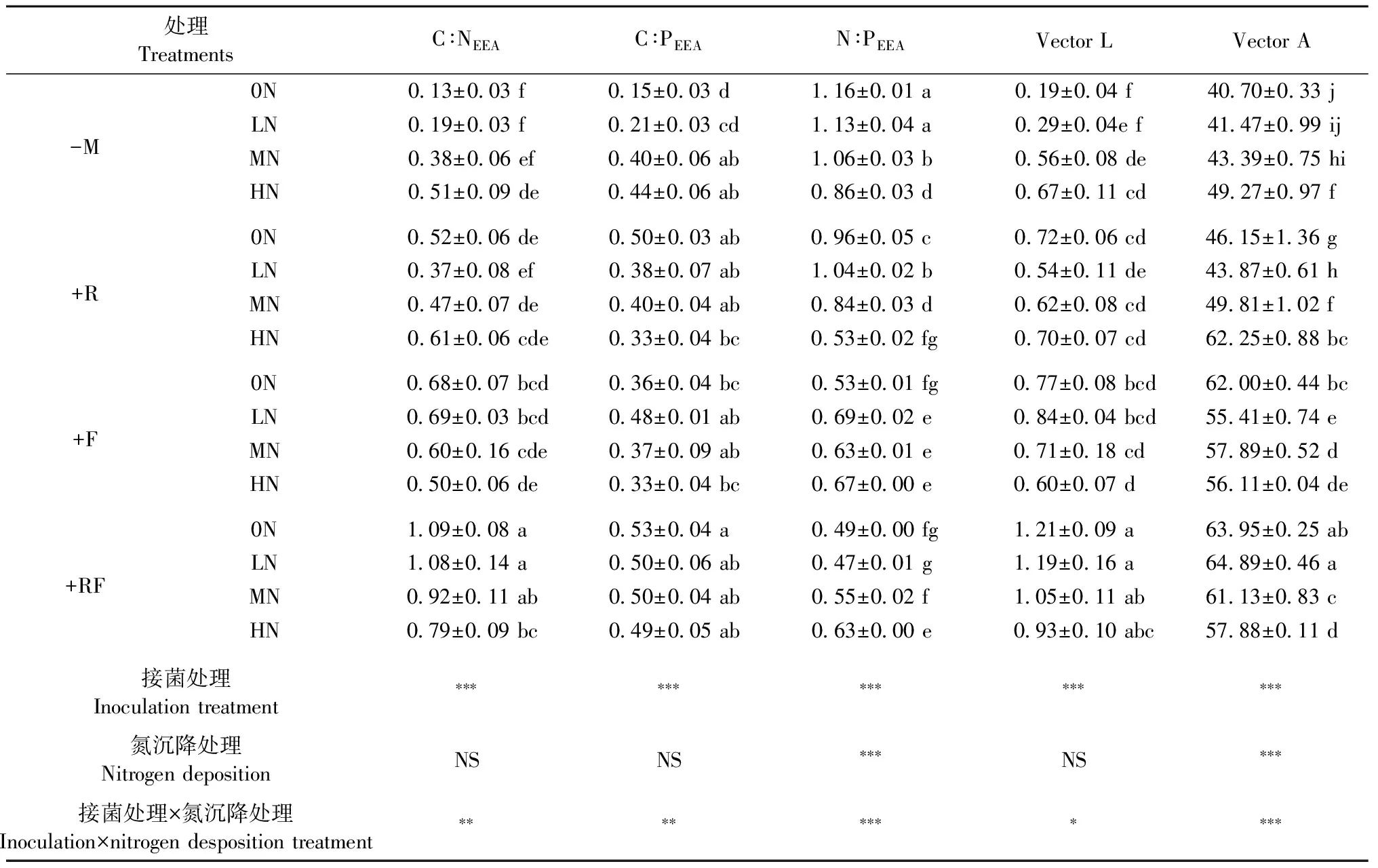
表4 接种菌根真菌和氮沉降对灌木铁线莲根际土壤酶化学计量特征的影响①Tab.4 Ecoenzymatic stoichiometry characteristics in rhizosphere soil of C. fruticosa seedlings under inoculation of mycorrhizal fungi and nitrogen deposition treatments
2.4 微生物养分限制与生态化学计量特征的关系 利用PLS-PM路径模型分析氮沉降处理、接菌处理、有效养分化学计量比、微生物生物量化学计量比和酶化学计量比对微生物碳限制及微生物磷限制的影响,路径模型的拟合度分别为0.66和0.65(图1、2)。氮沉降处理和接菌处理对微生物碳限制的直接影响均为负效应(路径系数分别为-0.16和-0.24)。氮沉降处理通过影响有效养分化学计量比和微生物生物量化学计量比,进而正效应作用于微生物碳限制; 接菌处理通过影响有效养分化学计量比、微生物生物量化学计量比和酶化学计量比进而影响微生物碳限制,其中接菌处理极显著(路径系数为0.83)影响酶化学计量比,进而最大限度地调节酶化学计量比(路径系数为1.11)对微生物碳限制的影响(图1)。氮沉降处理和接菌处理对微生物磷限制直接影响均为正效应(路径系数分别为0.17和0.40)。氮沉降和接菌处理并未通过有效养分化学计量比、微生物生物量化学计量比来调节微生物磷限制。接菌处理(路径系数为0.85)极显著影响酶化学计量比,进而最大限度的调节酶化学计量比(路径系数为0.68)对微生物磷限制的影响(图2)。影响微生物碳限制和微生物磷限制各因子的总效应分析发现,接菌处理的总效应均大于氮沉降处理,土壤酶化学计量比是接菌处理调控微生养分限制的重要路径(图3)。
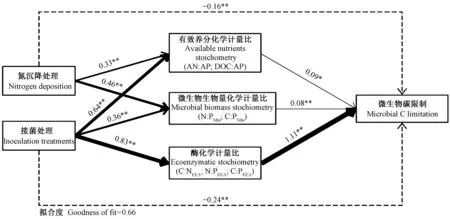
图1 基于偏最小二乘路径模型(PLS-PM)的根际土生态化学计量特征对微生物碳限制影响的路径Fig. 1 Partial least squares path modeling (PLS-PM) indicating the major pathways of rhizosphere soil stoichiometry characteristics on microbial C limitations实线和虚线箭头分别表示正向和负向效应关系。箭头上的数字表示路径系数(*: P< 0.05; **: P< 0.01 )。下同。Solid and dotted arrows indicated positive and negative effects, respectively. The significance of the standardized path coefficients was indicated by the numbers on the arrow (*: P< 0.05; ** : P< 0.01). The same below.

图2 基于偏最小二乘路径模型(PLS-PM)的根际土生态化学计量特征对微生物磷限制影响的路径Fig. 2 Partial least squares path modeling (PLS-PM) indicating the major pathways of rhizosphere soil stoichiometry characteristics on microbial P limitations*** : P< 0.001; NS: 不显著No-significant.
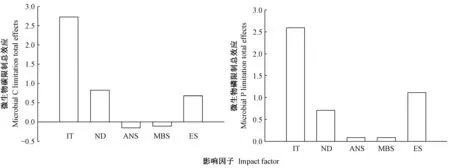
图3 基于偏最小二乘路径模型(PLS-PM)的接菌处理、氮沉降处理、有效养分计量比、微生物生物量化学计量比和酶化学计量比对微生物碳和磷限制的总效应Fig. 3 Total standardized effects of inoculation treatment, nitrogen deposition treatment, available nutrients stoichiometry, microbial biomass stoichiometry, ecoenzymatic stoichiometry on microbial C and P limitations based on partial least squares path modeling (PLS-PM)IT、ND、ANS、MBS和ES分别表示接菌处理、氮沉降处理、有效养分化学计量比、微生物生物量化学计量比和酶化学计量比。IT, ND, ANS, MBS and ES indicated inoculation treatments, nitrogen deposition, available nutrient stoichiometry, microbial biomass stoichiometry and enzyme stoichiometry, respectively.
3 讨论
3.1 菌根真菌和氮沉降处理对灌木铁线莲根际土生态化学计量特征的影响 生态化学计量比是研究土壤化学元素质量平衡和生态交互作用的一种有效手段(曾德慧等, 2005)。以往研究发现,氮沉降对土壤微生物存在一定调节作用,同时影响土壤胞外酶和有效养分间的平衡(许淼平等, 2018)。本研究发现,各氮沉降处理中的接菌处理较未接菌处理提高了土壤DOC∶AN和DOC∶AP(表2),其原因可能是接菌处理增强了植物对氮输入的适应性,提高了植物净光合能力(邹慧等, 2018),进而增加了土壤中的碳输入。高氮沉降导致根际土壤中DOC∶AN降低,表明高氮输入破坏了原有的生态平衡(Liu et al., 2017),且HN处理下,-M和+R处理的土壤AN∶AP显著低于+F和+RF处理,表明不同接菌处理对氮输入的调控能力不同,其主要原因为不同菌根真菌的耐氮性存在差异(Han et al., 2020)。微生物生物量化学计量特征可反映养分的供应能力。-M处理中,随氮沉降量增加,C∶NMic升高,而N∶PMic降低(表3),原因为一定范围的氮沉降提高了碳的输入,满足了微生物对碳的需求,增加了土壤磷的消耗(Li et al., 2016)。3种接菌处理中,随氮沉降量增加,C∶NMic降低,而N∶PMic升高(表3),表明接菌处理可更好地调控土壤微生物活性,促进养分循环,增强根际微生物对氮沉降的适应能力。-M处理中,随氮沉降量增加,C∶NEEA呈增加的趋势,而N∶PEEA呈下降趋势,其变化规律与C∶NMic和N∶PMic一致,可能是微生物对无机盐的吸收需要通过胞外酶来完成。然而,在+R和+F处理中,各氮沉降处理间的C∶NEEA无显著差异,而MN处理中的N∶PEEA均最大,表明接菌处理改变了土壤酶化学计量比对氮沉降的响应规律,原因为接菌处理增加了土壤微生物中真菌数量,提高了根际微生态环境的稳定性(喻岚晖等, 2020)。与高氮沉降处理相比,低氮沉降中的菌根真菌可以更有效地调控根际微生态环境生态化学计量比,主要原因可能是氮富集降低土壤pH,且限制木质素降解速率,进而抑制真菌活性(Crowther et al., 2015)。
3.2 菌根真菌和氮沉降处理对灌木铁线莲根际土养分限制的影响 基于生态化学计量学可有效进行生态系统元素限制分析(Cui et al., 2018)。本研究发现,-M处理中,随氮沉降量增加灌木铁线莲根际土微生物碳限制增加,同时微生物从氮限制转化为磷限制(表4)。其原因可能是,随着氮元素的大量输入,缓解了植物的氮限制,增加了植物对其他营养元素的吸收和利用,导致根际土壤中微生物碳和磷的竞争(Li et al., 2016; Buchkowski et al., 2016)。+R、+F和+RF处理中,氮沉降处理对Vector L无显著影响(表4),表明接菌处理缓解了随氮沉降增加导致的微生物碳限制,原因可能是接菌处理扩展了营养元素的吸收范围(邹慧等, 2018),导致根际周围微生物碳竞争减弱。高氮沉降量处理下,+R处理的Vector A增加,而+F和+RF处理的Vector A降低,可能是不同菌根真菌对氮的耐受性存在差异(Choma et al., 2017),且摩西斗管囊霉较根内根孢囊霉更能适应高氮环境,也说明耐氮性强的菌根真菌可以更好地调节根际微生态环境,缓解根际微生物磷限制。通过PLS-PM路径模型分析发现,微生物碳限制和磷限制的影响因素中,接菌处理的总效应均大于氮沉降处理(图3),表明接菌有助于增强根际微生态环境对氮沉降的适应性。通过路径分析发现,接菌处理主要通过影响土壤酶化学计量比作用于微生物碳限制和磷限制(图1、2),原因可能是有效养分的化学计量关系控制微生物资源获取,进而影响养分循环相关酶计量来间接作用于微生物磷限制(Colin et al., 2014)。在0N处理中,接种菌根真菌较未接菌处理显著增加了微生态碳限制和磷限制,而HN处理中,接菌处理的微生物磷限制均高于未接菌处理,主要原因为接菌处理和氮沉降处理显著促进了灌木铁线莲生长,增加了植物和微生物对根际磷的竞争。以往研究发现,土壤微生物磷限制在一定程度上控制着微生物碳代谢(王强等, 2020),本研究中氮输入超过一定范围时,菌根真菌对微生物代谢限制的促进作用受到影响; 且HN处理下,接菌处理间微生态碳限制无显著差异,表明菌根真菌对氮沉降调控作用存在阈值。
4 结论
1) 菌根真菌可调控根际土壤生态化学计量比,增强根际微生态环境对氮沉降的适应能力,且低氮沉降中菌根真菌对根际微生态环境生态化学计量比的调控优于高氮沉降。
2) 接菌处理对根际土壤微生物碳限制和磷限制的影响高于氮沉降处理; 氮沉降量低于6 g·m-2a-1时,接菌处理可缓解由于氮沉降增加而导致的微生物碳限制和磷限制。
