南昌市鸡蛔虫形态学与分子特征分析
2022-10-15洪照微韩如意杜子成陈小庆
洪照微,韩如意,王 沛,杜子成,陈小庆
南昌市鸡蛔虫形态学与分子特征分析
洪照微,韩如意,王 沛,杜子成,陈小庆*
(江西农业大学 动物科学技术学院,江西 南昌 330045)
【目的】旨在通过分析鸡蛔虫的形态学和分子生物学特征,以了解南昌市鸡蛔虫与其他蛔虫的系统发育关系。【方法】观察并记录分离自南昌市鸡蛔虫的形态学特征,随后提取每个样本总DNA,PCR扩增基因并测序,序列经NCBI比对后,对蛔虫样本ITS基因进行同源性分析和系统发育分析。【结果】所有蛔虫样本虫体呈淡黄色,头部可见唇瓣3片,近头端可见神经环。雄虫尾部向腹部弯曲而雌虫尾部尖直。蛔虫样本基因大小均为1 000 bp左右,与安徽、湖南、波兰鸡蛔虫分离株(登录号分别为:MN158368、OM876368、KY789470)以及与鸽蛔虫(登录号:JQ995321)高度同源,与鹅蛔虫(登录号:KC905082)同源性相对较高。实验分离的鸡蛔虫样本序列与其他国家或地区的鸡蛔虫序列及鸽蛔虫序列聚为一簇,与其他国家或地区的鸡蛔虫亲缘关系最近,与鸽蛔虫亲缘关系也很近;鹅蛔虫与其互为姊妹群,有独立的进化分支,亲缘关系相对较近。【结论】分离自南昌的鸡蛔虫与安徽、湖南、波兰鸡蛔虫分离株高度同源,亲缘关系很近,初步判定它们具有相同的起源,同时也表明南昌地区鸡蛔虫可能由安徽、湖南等地区流入;而与鹅蛔虫同源性相对较高,但具有一定差异性,说明种间ITS基因存在一定变异,是分析蛔虫种间发育关系的良好标记基因。鸡蛔虫的形态学和分子特征分析可为鸡蛔虫的鉴定以及鸡蛔虫病的防控奠定理论基础。
鸡蛔虫;形态特征;基因;系统发育分析;南昌市
【研究意义】随着生活水平的提高,人们对畜禽类产品要求也逐渐提高,愈发追求绿色、安全、健康的畜禽产品,散养家禽模式也越来越受欢迎。散养鸡因其陆地啄食的生活习性,易吞食被感染性虫卵污染的饲料、饮水或啄食携带有感染性虫卵的转续宿主而感染鸡蛔虫病。因此,通过形态学和分子生物学对南昌地区鸡蛔虫进行鉴定分析,了解该地区鸡蛔虫系统发育关系,对于当地鸡蛔虫的防治及后续研究具有一定意义。【前人研究进展】鸡蛔虫()隶属于蛔目(Ascaridida)禽蛔科(Ascarididae)禽蛔属()[1],常寄生于鸡小肠,也可寄生于胃和食道等其他消化器官。鸡蛔虫病多发于春、夏、秋季[2],以三月龄以下的散养的雏鸡最为易感。鸡感染后常出现精神沉郁、食欲不良、腹泻、体重减轻、产蛋率下降等病症[3-5],当病鸡体内定殖的蛔虫达到一定数量时,影响宿主正常的生长发育,从而造成养殖成本上升,影响养殖户的经济效益[6-9]。
随着分子生物学技术的发展,近年国内外已有众多关于寄生虫种类鉴定、分子分类和遗传学研究的报道。基因位于18S rDNA和28S rDNA之间的内转录间隔区,由ITS-1、5.8S rDNA和ITS-2组成。因其不参与成熟核糖体,故变异较快,具有种内变异小而种间变异大的特点,常作为一种分子标记用于寄生虫的种类鉴定,同时也是种内遗传变异研究的常用基因之一[10]。【本研究切入点】仅基于形态学特征和流行学特点对鸡蛔虫进行分类显然达不到精准分类的目标[12],故对其进行准确的分类鉴定、了解遗传发育关系对鸡蛔虫防治有重要意义。研究拟通过结合形态学鉴定技术和分子生物学技术,以为标记基因,探究南昌市鸡蛔虫的形态学和分子生物学特征。【拟解决的关键问题】分析南昌市鸡蛔虫与其他蛔虫的系统发育关系,为鸡蛔虫的分子生物学分析和种群遗传研究提供数据支持。
1 材料与方法
1.1 样品采集
对购自南昌市某农贸市场的5只散养鸡采用动物蠕虫学剖检技术进行解剖,在其体内分离得到24条蛔虫,编号为H1-H24,所有样品用生理盐水洗净后进行形态学鉴定,最后置于无菌生理盐水中,4 ℃保存。
1.2 主要试剂
TAKARA(Ex Taq DNA聚合酶,Mg2+plus,dNTP mixture,pMD18-T载体,Solution I,DNA DL 2 000 Marker DL 2 000,6×loading buffer),天根TIANamp Genomic DNA Kit,Genstar StarPrep Gel Extraction Kit,全式金DH5α感受态细胞,其余试剂全部为国产分析纯。
1.3 形态学观察
将所有蛔虫样本用生理盐水洗净后逐个置于载玻片上,滴加适量生理盐水后盖上盖玻片,光学显微镜观察样本形态学特征,拍照并记录。
1.4 提取蛔虫总DNA、PCR扩增
无菌剪刀剪碎样本后严格按照组织DNA提取试剂盒说明书提取所有蛔虫样本总DNA,提取的DNA保存于-20 ℃备用。参照文献[13]合成蛔虫基因引物(上游引物:5′-TTAGTTTCTTTTCCTCCGCT-3′;下游引物:5′-GTAGGTGAACCTGCGGAAGGATCATT-3′),引物由上海生工生物工程技术服务有限公司合成。蛔虫基因PCR扩增体系(25 μL)如下:17 μL ddH20,2.5 μL 10×PCR Buffer(Mg2+plus),2 μL dNTP,上下游引物各0.5 μL,2 μL模板DNA,0.5 μL Ex Taq DNA聚合酶。PCR扩增条件:94 ℃预变性 5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃末期延伸5 min,PCR产物于4 ℃保存。每个反应都包含一个以蒸馏水为模板的阴性对照。每个样均取5 μL PCR产物与1 μL 6×Loading Buffer混合后加入上样孔,10 g/L琼脂糖凝胶120 V电泳30 min,用EB(溴化乙锭)对DNA染色,凝胶成像仪成像并拍照记录PCR扩增结果。
1.5 克隆与序列测定
DNA经胶回收纯化后与pMD-18T载体连接,连接体系为:3 μL ddH2O,3 μL Solution Ⅰ溶液,3 μL胶回收DNA,1 μL pMD18-T载体。4 ℃过夜连接。将5 μL连接产物转入50 μL DH5α感受态细胞中,摇床200 r/min培养2 h,整个转化过程严格按照说明书进行。取200 μL菌液均匀涂布于含有氨苄(氨苄浓度为0.1 g/mL)的固体LB培养基,随后37 ℃培养过夜。枪头挑选单个白色菌落于含有氨苄(氨苄浓度为0.1 g/mL)的1 mL液体LB培养基中,摇床200 r/min培养6 h。菌液PCR(条件和体系同1.4)后,挑选电泳结果条带清晰明亮的菌液200 μL送往擎科生物科技有限公司测序。
1.6 序列对比与系统发育分析
用Chromas校准测序所得序列后将序列拼接,去除载体序列后在NCBI GenBank数据库中进行Blast比对。在GenBank数据库中检索并下载已收录的代表性线虫的基因序列,用Megalign和MEGA 7.0.26分别进行同源性分析和系统发育树(基于线虫基因,以邻交法和Komura 2模式,自举值设置1 000)的构建。
2 结 果
2.1 形态学鉴定
研究共分离得到24个鸡蛔虫样本,所有样本虫体均呈淡黄色,线状,体表覆角质层,横纹清晰可见。雌雄异体,雌虫较雄虫大且长。显微镜下隐约可见唇瓣3片,近头端至食管可见神经干及神经环。雄虫尾部向腹部弯曲,尾端有一小尖刺,近尾端可见泄殖腔,延伸出一对几乎等长的交合刺。雌虫尾部尖且直,近尾端可看见肛门(图1)。
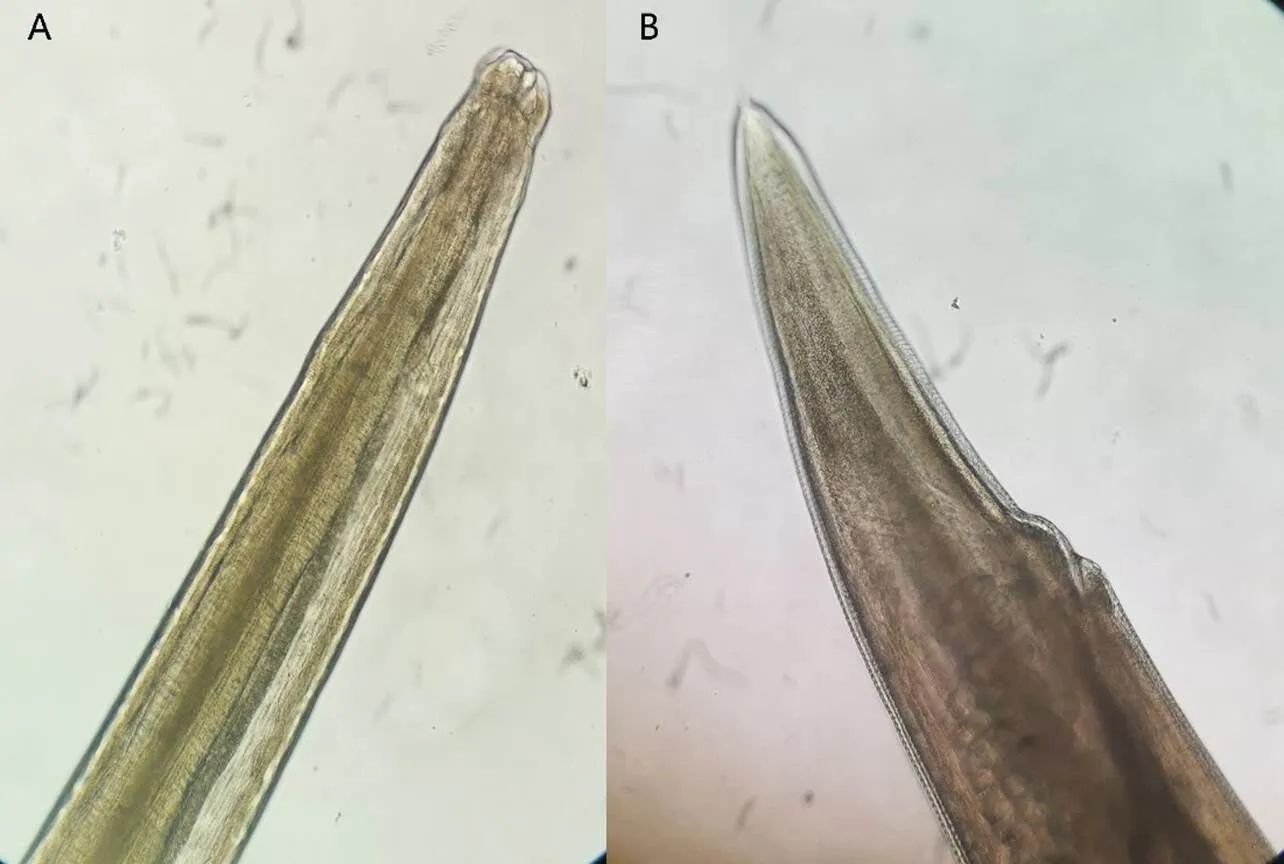
A:鸡蛔虫头部;B:雌虫尾部
2.2 虫体ITS基因PCR扩增结果
使用保守引物NC2/NC5扩增所有蛔虫样本基因。结果显示基因大小约为1 000 bp,与预期条带大小一致,无非特异性条带产生,阴性对照均无条带(图2)。
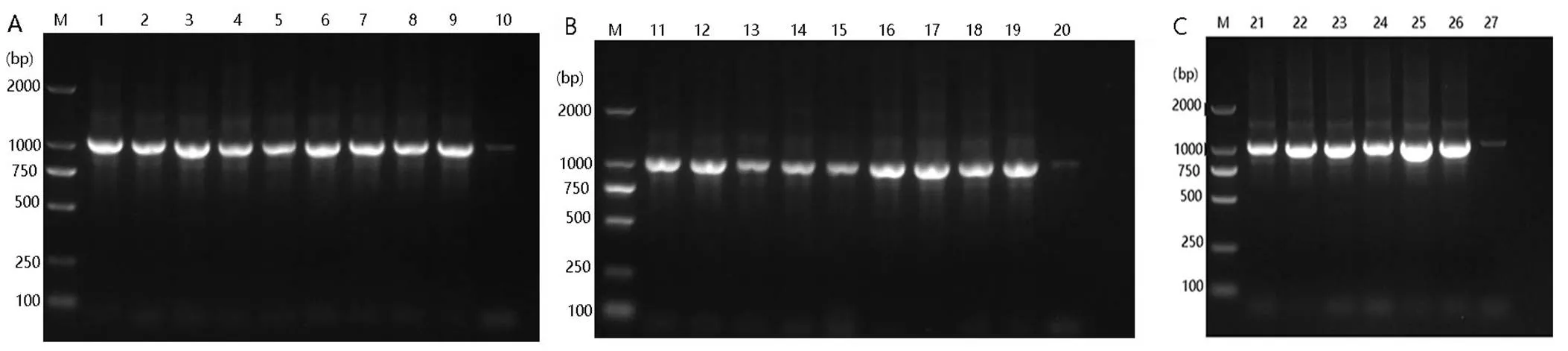
10、20、27为阴性对照
2.3 DNA序列比对分析
测序结果显示所有蛔虫样本基因(登录号分别为MW136454、MW218962-MW218982、MW343494-MW343494)大小为1 000 bp,A+T含量为63.15%,G+C含量为36.85%。样本序列间高度同源,同源性为99.4%~100.0%。基于部分基因序列进行同源性分析的结果表明,样本序列与安徽鸡蛔虫(MN158368)、湖南鸡蛔虫(OM876368)、波兰鸡蛔虫(KY789470)和美国鸽蛔虫(JQ995321)序列之间同样高度同源,同源性在99.1%~100.0%;与鹅蛔虫(KC905082)同源性相对较高,同源性在94.0%~94.6%;与鸡异刺线虫(MF066726)同源性仅在69.8%~70.3%;与犬弓首蛔虫(JF837170)、猫弓首蛔虫(AB571303)、牛弓蛔虫(KT737382)、狮弓蛔虫(JF837176)、猪蛔虫(AB571302)、人蛔虫(AB571301)、毛圆线虫(LN999857)和野猪后圆线虫(KP890023)同源性均低于60.0%(图3)。
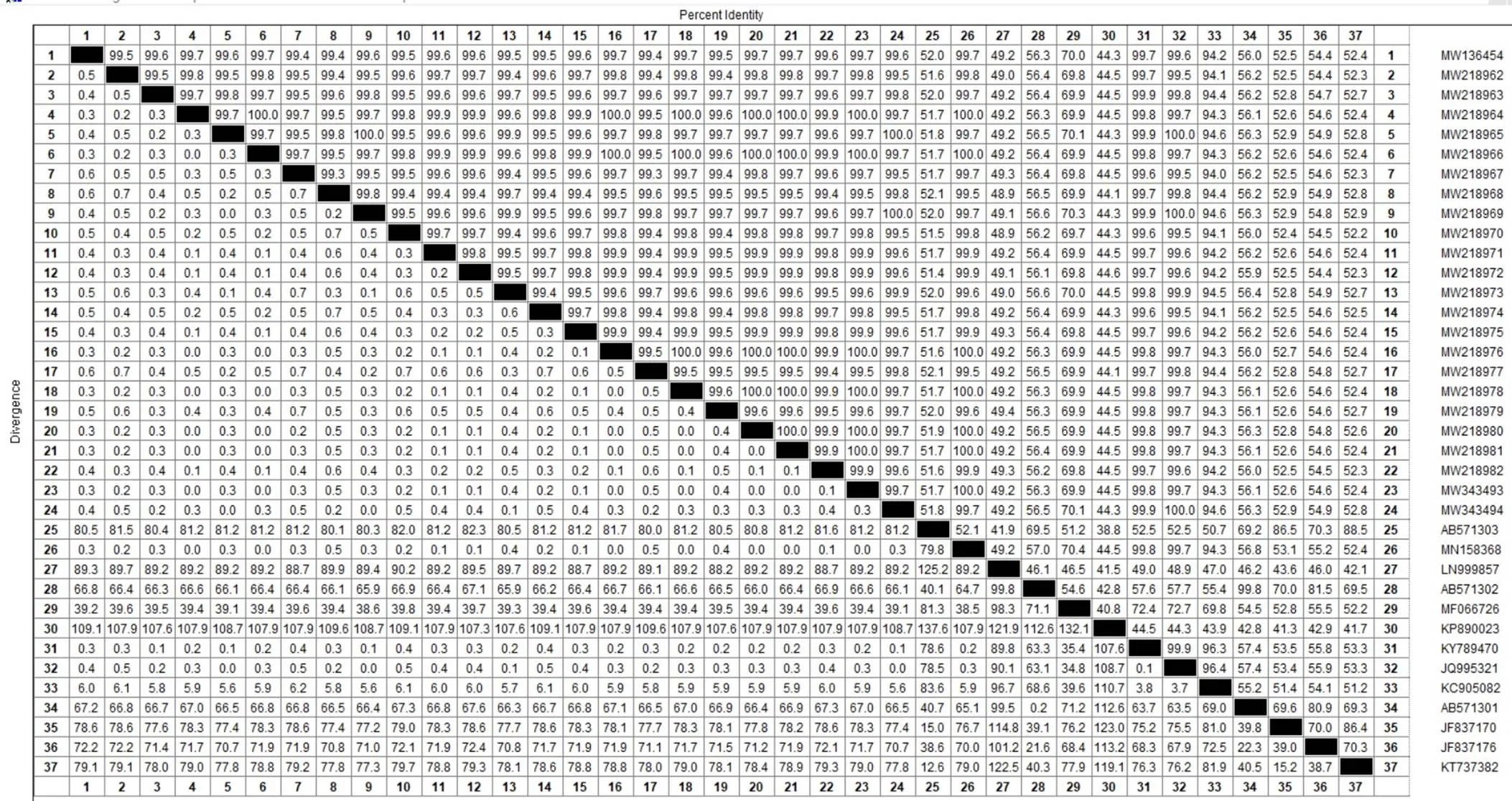
图3 基于ITS基因同源性分析
2.4 ITS基因序列发育分析
基于基因构建的系统发育树显示(图4),实验得到的鸡蛔虫序列与参考鸡蛔虫(MN158368、OM876368、KY789470)序列聚为一簇,与美国鸽蛔虫(JQ995321)序列、中国鹅蛔虫(KC905082)和鸡异刺线虫(MF066726)聚为一大支。在所有蛔目蛔虫所属支系中,鸡蛔虫(包括样品序列)与鸽蛔虫亲缘性最近,与鹅蛔虫(KC905082)亲缘关系较近;在蛔目其他属线虫中,与鸡异刺线虫(MF066726)亲缘性较近,而与毛圆线虫(LN999857)和野猪后圆线虫(KP890023)等亲缘关系较远。

带有黑色三角形的为本实验分离得到序列,三角形右侧为分离序列的GenBank登录号
3 讨 论
鸡蛔虫是鸡最常见的寄生虫之一,主要寄生于小肠,是小肠内最大的线虫[14]。鸡蛔虫虫体呈黄白色,线状,两侧对称,雌雄异体,通常雌虫较雄虫大[15-16]。寄生虫的形态学和流行病学研究为线虫分类提供了基础,但由于同源特征、化石记录等的缺失[17],以及通过形态学分析难以区分某些寄生虫形态及卵的结构特征[18-20],导致从形态学和流行病学特征中获得一致的线虫门系统发育和分类框架非常困难,故针对线虫很难进行特异性诊断[21]。
分子生物学技术是寄生虫鉴定及其基因发育分析的常用手段,与传统的诊断方法相比,具有更高的敏感性和特异性[18]。部分线粒体(基因等)和核糖体基因(基因等)是寄生虫鉴定及分类的重要标记基因[22-23]。序列属于高度重复序列,通过不等交换和基因转换可以在位点间或位点内发生同步转换。同时,由于序列相对保守,有利于引物的设计,这为利用PCR方法进行测序奠定了基础[11]。林瑞庆等[24]通过对鸡蛔虫序列的测序比较,结果表明中国广州的两个鸡蛔虫样品间没有差异,与澳大利亚分离株同源性为99.7%,证明鸡蛔虫序列种内高度保守,而鸡蛔虫在序列存在的微小差异可能是地理差异,这是国内首次使用PCR扩增鸡蛔虫序列并进行序列分析。郝桂英等[25]对中国凉山地区鸡蛔虫分离株基因序列进行PCR扩增,7个测序序列的同源性为98.9%~100.0%,与其他蛔虫同源性均<94.0%;刘明洋[26]对扩增了5个鸡蛔虫湖南分离株,其序列间相似性均在98%以上,与其他蛔虫同源性较低。这些研究进一步表明鸡蛔虫序列具有种内变异较小、种间差异较明显的特征,可作为分子遗传标记用于鸡蛔虫的鉴定。实验以为标记基因,分析南昌市鸡蛔虫的系统发育特征,与世界上目前所发现的其他鸡蛔虫序列进行比较,分析本次收集的鸡蛔虫发育进程。
实验分离得到的24个鸡蛔虫样本种间高度同源,同源性为99.4%~100.0%,且与其他国家、地区鸡蛔虫同样高度同源,这表明此次分离所得鸡蛔虫样本与参考序列在发育进程中为同一种系,同时也表明南昌地区鸡蛔虫可能由湖南、安徽等地流入。此外,样本序列与鸽蛔虫同样高度同源,而与鹅蛔虫的同源性相对较高,而与鸡异刺线虫等其他线虫同源性很低,这表明鸡蛔虫与鸽蛔虫、鹅蛔虫在发育进程中可能为同一种系,但存在一定变异。同时这再次验证了基因种内高度保守,种间差异明显的特点,也说明基因是鸡蛔虫分类鉴定的良好标记基因。所有鸡蛔虫样本序列与参考的鸡蛔虫序列聚为一簇,并与鸽蛔虫、鹅蛔虫和鸡异刺线虫聚为一大支,与鸽蛔虫亲缘关系很近,与鹅蛔虫亲缘关系相对较近,与同源性分析结果一致。鸡蛔虫、鸽蛔虫、鹅蛔虫以及鸡异刺线虫等都有独立进化分支,进化距离相对较远,不同蛔虫间可以显著区分开来,同样说明基因是鸡蛔虫分类、鉴定的良好标记基因,同时也是鸡蛔虫遗传发育研究良好靶标基因。
目前,左旋咪唑、甲苯咪唑、阿苯达唑、哌嗪等仍是中国和许多其他国家治疗蛔虫病最常使用的药物,且单独口服给药比饮用水给药疗效更显著[27],但重复或者过度使用这些药物容易产生耐药性[28]。靶向治疗是防治线虫的一种方法,指在粪便中发现虫卵便立即使用药物进行治疗,并对粪便进行处理以减少寄生虫虫卵对环境的污染,同时应用靶向治疗可增加饲料转化率,提高蛋品质等[29]。使用疫苗也可以大大降低许多疾病的发病率和死亡率。铅亚单位疫苗的靶向目标是利用寄生虫的蛋白组分的经典生化技术(S. mansoni 28 kda谷胱甘肽s转移酶和14 kda脂肪酸结合蛋白抗原)确定的[30-31],通过这些靶标影响寄生虫入侵及生长与繁殖[32],从而达到防控与治疗的目的。
实验通过观察南昌市鸡蛔虫的形态学特征,再结合分子生物学手段和系统发育树分析,对其进行分类、鉴定,以探究南昌市鸡蛔虫的系统发育关系。鸡蛔虫南昌分离株与不同国家/地区鸡蛔虫分离株高度同源,可能通过种鸡引进等方式由安徽、湖南等地区流入;与鸽蛔虫亲缘关系最近,说明它们可能有相同的起源,在种系发育进程中具有一定的一致性;同时,与鹅蛔虫亲缘关系相对较近且具有一定的差异性,表明其在种内发育过程中产生一定的变异;与其他种类蛔虫及线虫同源性很低,进一步说明其种间差异明显。基因不仅是鸡蛔虫种间鉴定的理想标记基因,同时也是研究鸡蛔虫进化发育关系的理想标记基因。研究结果为鸡蛔虫的分类、鉴定,分子遗传学研究以及防控奠定了理论基础。
[1] 李淼, 侯强红, 蔡丝丝, 等. 鸡蛔虫COX2和NAD4rDNA的序列测定及分析[J]. 中国兽医杂志, 2013, 49(1): 19-21.
[2] BETHONICO T M T, PACHECO W J, HARRISON M, et al. A survey of coccidia and nematodes in pastured poultry in the state of Georgia[J]. Avian dis, 2021;65(2): 250-256.
[3] TARBIAT B, JANSSON D S, WALL H, et al. Effect of a targeted treatment strategy againston egg production, egg quality and bird health in a laying hen farm[J]. Vet parasitol, 2020, 286: 109238.
[4] FEYERA T, SHIFAW A Y, RUHNKE I, et al.challenge model for worm propagation in young chickens with or without immunosuppression[J]. Vet parasitol, 2022, 301: 109624.
[5] SHARMA N, HUNT P W, HINE B C, et al. Effect of an artificialinfection on egg production, immune response, and liver lipid reserve of free-range laying hens[J]. Poult sci, 2018, 97(2): 494-502.
[6] 李中波, 蒋林波, 尧国民, 等. 一例鸡蛔虫病的诊断与防治[J]. 湖北畜牧兽医, 2020, 41(3): 18-19.
[7] SHARMA N, HUNT P W, HINE B C, et al. The impacts ofon performance, health, and immune responses of laying hens: new insights into an old problem[J]. Poult sci, 2019, 98(12): 6517-6526.
[8] URBANOWICZ J, GAWEŁ A, BOBREK K.isolates with ITS1-5. 8rRNA-ITS2 fragment homologous to Ascaridia columbae[J]. Acta parasitol, 2018, 63(3): 640-644.
[9] COLLINS J B, JORDAN B, VIDYASHANKAR A N, et al. Impact of fenbendazole resistance inon the economics of production in turkeys[J]. Poult sci, 2021, 100(11): 101435.
[10] 唐敏. 上海部分野生鸟类寄生绦虫与线虫的虫种鉴定[D]. 上海: 上海师范大学, 2017.
[11] 刘延滨, 姬兰柱. 核rDNA-ITS序列在昆虫学研究上的应用[J]. 应用生态学报, 2007, 18(5): 1139-1144.
[12] 牛庆丽, 罗建勋, 殷宏. 转录间隔区(ITS)在寄生虫分子生物学分类中的应用及其进展[J]. 中国兽医寄生虫病, 2008, 16(4): 41-47.
[13] LI M W, LIN R Q, CHEN H H, et al. PCR tools for the verification of the specific identity of ascaridoid nematodes from dogs and cats[J]. Mol cell probes, 2007, 21(5-6): 349-54.
[14] BAZH E K. Molecular characterization ofinfecting native chickens in Egypt[J]. Parasitol res, 2013, 112(9): 3223-3227.
[15] 饶天宇, 申夕, 朱志伟, 等. 鸡蛔虫黄山市分离株的形态学和分子特征分析[J]. 热带病与寄生虫学, 2020, 18(2): 87-92.
[16] 闫丽梅. 鸡蛔虫病的流行病学、临床表现、诊断及防治措施[J]. 现代畜牧科技, 2020(7): 84-85.
[17] URBANOWICZ J, GAWEŁ A, BOBREK K.isolates with ITS1-5. 8rRNA-ITS2 fragment homologous to Ascaridia columbae[J]. Acta parasitol, 2018, 63(3): 640-644.
[18] TARBIAT B, ENWEJI N, BALTRUSIS P, et al. A novel duplex ddPCR assay for detection and differential diagnosis ofandeggs from chickens feces[J]. Vet parasitol, 2021, 296: 109499.
[19] CUPO K L, BECKSTEAD R B., the cecal nematode of Gallinaceous birds: A critical review[J]. Avian dis, 2019, 63(3): 381-388.
[20] CARRISOSA M, JIN S, MCCREA B A, et al. Prevalence of Select Intestinal Parasites in Alabama backyard poultry flocks[J]. Animals(Basel), 2021, 11(4): 939.
[21] BISWAS P G, OHARI Y, MOHANTA U K, et al. Molecular characterization offrom Bangladesh and development of a PCR method for distinguishingfromspp[J]. J Vet Med Sci, 2021, 83(4): 666-670.
[22] JIA W Z, YAN H B, GUO A J, et al. Complete mitochondrial genomes of,.and.: additional molecular markers for a tapeworm genus of human and animal health significance[J]. BMC genomics, 2010, 11: 447.
[23] VANDERGAST A G, RODERICK G K. Mermithid parasitism of Hawaiian Tetragnatha spiders in a fragmented landscape[J]. J invertebr pathol, 2003, 84(2): 128-136.
[24] 林瑞庆, 蔡天城, 吴桂英, 等. 鸡蛔虫ITS rDNA的PCR扩增克隆及序列分析[J]. 中国兽医杂志, 2008, 44(3): 24-25.
[25] 郝桂英, 何学谦. 鸡蛔虫凉山州分离株ITS和5. 8S rDNA序列测定及种系发育分析[J]. 中国畜牧兽医, 2015, 42(12): 3167-3172.
[26] 刘明洋. 湖南省部分地区鸡蛔虫感染情况调查及rDNA ITS序列分析研究[D]. 长沙: 湖南农业大学, 2011.
[27] FEYERA T, RUHNKE I, SHARPE B, et al. Comparative therapeutic efficacies of oral and in-water administered levamisole, piperazine and fenbendazole against experimentalinfection in chickens[J]. Vet parasitol, 2021, 298: 109514.
[28] KEISER J, UTZINGER J. The drugs we have and the drugs we need against major helminth infections[J]. Adv parasitol, 2010, 73: 197-230.
[29] TARBIAT B, JANSSON D S, WALL H, et al. Effect of a targeted treatment strategy againston egg production, egg quality and bird health in a laying hen farm[J]. Vet parasitol, 2020, 286: 109238.
[30] DUNNE D W, HAGAN P, ABATH F G. Prospects for immunological control of schistosomiasis[J]. Lancet, 1995, 345(8963): 1488-1491.
[31] STUTZER C, RICHARDS S A, FERREIRA M, et al. Metazoan parasite vaccines: present status and future prospects[J]. Front cell infect microbiol, 2018, 8: 67.
[32] HAGAN T, NAKAYA H I, SUBRAMANIAM S, et al. Systems vaccinology: Enabling rational vaccine design with systems biological approaches[J]. Vaccine, 2015, 33(40): 5294-5301.
Morphological and Molecular Characteristics ofin Nanchang City
HONG Zhaowei, HAN Ruyi, WANG Pei, Du Zicheng, CHEN Xiaoqing*
(School of Animal Science and Technology, Jiangxi Agricultural University, Nanchang 330045, China)
The study aimed to reveal the phylogenetic relationship betweenisolated from Nanchang City and otherby analyzing their morphological and molecular biological characteristics.Themorphological characteristics ofwere observed and recorded, and then DNA of each sample was extracted, through PCR,gene was amplified and sequenced so as to obtain the sequences. All sequences were blasted in GenBank, and then homology and phylogenetic analysis ofgene were performed for all samples.A. gallis were pale yellow with three lips on the head and a nerve ring near the head. The male tail curved towards the abdomen, while the female tail pointed straight.gene sequences ofwere almost 1 000 bp, which was highly homologous toisolated from Anhui Province (MN158368), Hunan Province (OM876368), and Polish (KY789470). Also, it is highly homologous with(JQ995321), and relatively highly homologous with(KC905082). All the sequences ofin this study were clustered with the sequences ofandfrom other countries or regions. They were most closely related to thefrom other countries or regions and were relatively close with the. The large branches formed by, andwere sister groups to each other, with independent evolutionary branches and relatively close affinities.The sequences ofisolated from Nanchang City were highly homologous and closely related to other sequences ofisolated from Poland and Anhui /Hunan Provinces, indicating that they may have the same origin, and also showing thatisolated from Nanchang was probably imported from Anhui and Hunan Provinces. Also, the homology with thewas relatively high. Still, there was some difference, which indicated that some variations in the interspecificgene, which is a good marker gene to analyze the interspecific developmental relationship in Ascaris species. The analysis of morphological and molecular characteristics ofcould lay a theoretical foundation for the identification and prevention and control of.
; morphological characteristics;gene; phylogenetic analysis; Nanchang City
S855.9
A
2095-3704(2022)02-247-07
洪照微, 韩如意, 王沛, 等. 南昌市鸡蛔虫形态学与分子特征分析[J]. 生物灾害科学, 2022, 45(2): 247-253.
10.3969/j.issn.2095-3704.2022.02.43
2022-05-18
2020-06-10
江西省自然科学基金管理科学类项目:科技特派员“千百万”帮扶行动体制机制研究(20212BAA10005)和江西省教育厅科技创新项目(GJJ180185)
洪照微(2001—),女,本科生,主要从事动物医学研究,h554526@163.com;*通信作者,陈小庆,讲师,博士,chenxiaoqing2013jl@163.com。
