猪瘟脾淋苗免疫仔猪9 d外周血细胞转录谱分析
2022-10-14包松英兆丰华生物科技福州有限公司福州350014
包松英 兆丰华生物科技(福州)有限公司 福州 350014
猪瘟(Classical swine fever,CSF),原名猪霍乱,是由猪瘟病毒(Classical swine fever virus,CSFV)感染引起的严重危害养猪业发展的动物疫病[1]。我国通过十年的猪瘟疫苗强制免疫与重点监测,已在很大程度上控制了CSF的流行[2]。猪瘟脾淋苗具有免疫原性好、免疫效果确切的优点,是养殖户预防控制猪瘟的首选产品之一,其制作工艺为猪瘟兔化弱毒株接种健康家兔,产生定型热后收获病毒含量高的脾脏和淋巴结,研磨制备而成[3]。脾淋苗中脾淋组织液具有免疫增强作用,可以提高疫苗的免疫效果[4-5]。刘新平等[6]在PRRSV与CSFV共感染的猪场免疫猪瘟脾淋苗,发现其阻断带毒母猪将CSFV垂直传播给仔猪的效果十分显著。
RNA-seq技术随着生物信息学工具以及新一代测序技术的进步而不断发展,已经广泛应用于分子生物学研究,其主要测序对象为非编码小RNA、信使RNA和长链非编码RNA等。RNA-Seq可以检测生物样本几乎所有转录本的序列与表达信息,研究生命体某个过程的作用机理,重要基因的表达模式与调控机制,揭示信号网络的改变,并可能识别新的重要基因[2,7]。目前,研究人员已采用RNA-seq技术针对CSFV感染猪或兔体后的作用机制开展了相关研究[8-9]。
笔者及合作团队于2020年开展了猪瘟脾淋苗、脾淋组织免疫小猪3 d的外周血转录组测序分析,发现无论是含毒的脾淋苗还是不含毒的脾淋组织,均可对小猪免疫功能起到调节作用。为了获得脾淋苗免疫后不同时间点的转录谱[10-11],本文进一步开展9 d的外周血转录谱分析,旨在为猪瘟脾淋苗免疫机理研究提供数据参考。
1 材料与方法
1.1 试验动物与分组30~32日龄健康小猪10头,购自福州市永泰县某猪场,经筛查试验猪满足未免疫猪瘟疫苗且特定病原阴性以及猪瘟抗体阴性的要求。特定病原指:非洲猪瘟病毒、口蹄疫病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、伪狂犬病病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪圆环病毒2型。
随机将10头小猪分为A、B两组,每组5头,其中A组免疫猪瘟脾淋苗1头份/头,B组免疫等量不含猪瘟病毒的大兔脾淋组织。猪瘟脾淋苗、不含猪瘟病毒的大兔脾淋组织由兆丰华生物科技(福州)有限公司制备。
1.2 试剂 总RNA提取试剂盒与实时荧光定量PCR试剂盒购自兰博利德试剂有限公司,反转录试剂盒购自厦门泰京生物技术有限公司。
1.3 样品采集 采集免疫后9 d的猪前腔静脉血抗凝样本,送至北京诺禾致源科技股份有限公司进行转录组测序。
1.4 转录组测序与分析 提取全血样品的总RNA,检测完整性和总量后,构建合格文库,以Illumina HiSeqTM2500测序。原始测序数据通过过滤、错误率与GC含量检查后,获得clean data。使用HISAT2 v2.0.5将数据与猪参考基因组进行比对,采用featureCounts进行基因表达水平定量,使用DESeq2软件进行差异表达分析,其中P值<0.05、|log2Fold-Change|≥0的基因为差异表达基因。以clusterProfiler软件实现差异表达基因的GO富集分析与KEGG通路中差异表达基因的统计富集,使用GSEA分析工具对样品功能注释与富集分析。
1.5 RT-qPCR验证 选择3个基因,按照逆转录试剂盒说明书进行cDNA逆转录,逆转录体系为:25 mM MgCl22 μL,GoScriptTMReverse Transcriptase 1 μL,GoScriptTM5×Reaction Buffer 4 μL,Recombinant RNasin○RRibonuclease Inhibitor 0.5 μL,Oligo(dT)15 Primer 1 μL,Random Primers 1 μL,PCR Nucleotide Mix 10 mM 1 μL,Nuclease-Free Water补足至20 μL。反应条件为:42℃反应15 min,72℃反应15 min获得cDNA,进行RT-qPCR检测,引物见表1。

表1 引物序列
RT-qPCR反应体系为:模板1.0 μL,正向引物、反向引物各0.4 μL,QPCR Mix 10 μL,ddH2O补足至20 μL。循环条件为:95℃预变性30 s,95℃变性5 s,60℃退火30 s,72℃延伸15 s,共45个循环。以2^ΔΔCT法计算差异表达水平,重复3次。
2 结果与分析
2.1 测序数据质量评估 通过转录组测序获得猪瘟脾淋苗组(A组)与脾淋组织对照组(B组)的原始数据,从表2可知,各样本净碱基数均超过6 GB,净读数的Q20百分比>98%、Q30百分比>95%,GC比例>50%。将处理的数据比对至猪类参考基因组,总比对率>96%,测序质量较好,可以用于后续分析。

表2 测序数据质量指标评估结果
2.2 差异表达基因筛选结果 免疫后9 d,猪瘟脾淋苗组(A组)与脾淋组织对照组(B组)相比,DEGs有17 382个,其中差异显著的DEGs有605个,分别是294个上调表达基因,311个下调表达基因(P<0.05)。前15个上调基因和下调基因柱状图见图1。
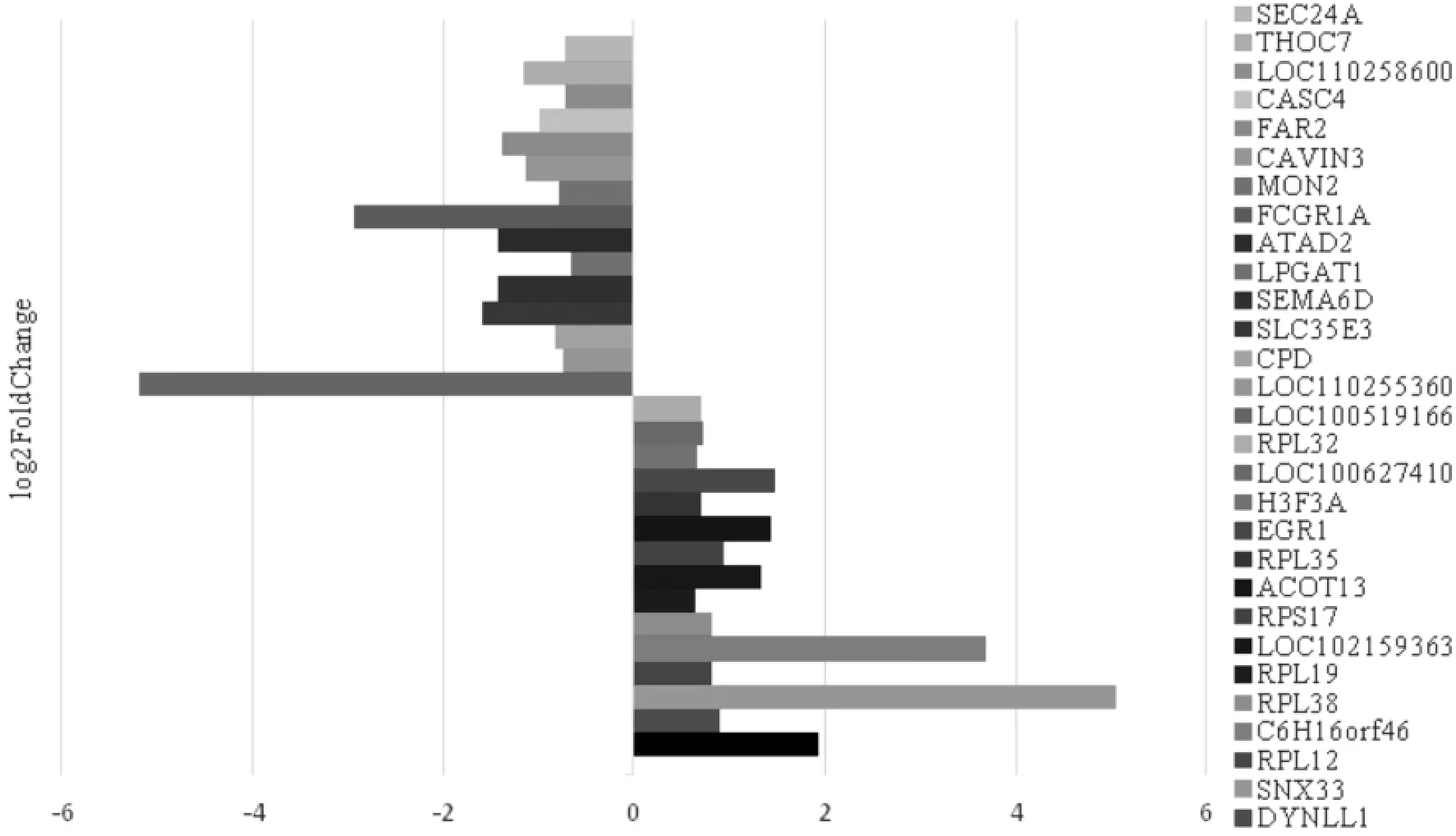
图1 免疫后9 d DEGs柱状图
2.3 GO功能富集分析 将DEGs进行GO功能富集分析发现(见图2):免疫后9 d,猪瘟脾淋苗组(A组)与脾淋组织对照组(B组)相比,富集的条目有1 044个,其中与生物过程(Biological process,BP)相关的有749个,酰胺生物合成过程(Amide biosynthetic process)、细胞酰胺代谢过程(Cellular amide metabolic process)、翻译(Translation)等23个过程显著富集(Q<0.05)。与细胞组分(Cellular component,CC)相关的有145个,胞质核糖体(Cytosolic ribosome)、核糖体亚基(Ribosomal subunit)、核糖体(Ribosome)等15个组分显著富集(Q<0.05)。与分子功能(Molecular function,MF)相关的有150个,核糖体结构成分(Structural constituent of ribosome)、结构分子 活 性 (Structural molecule activity)、RNA结 合(RNA binding)3个功能显著富集(Q<0.05)。

图2 免疫后9 d GO富集结果
2.4 KEGG通路分析 分析DEGs在KEGG通路中的富集结果可知(见表3),免疫后9 d,富集的信号通路数量有263个,差异显著的通路有10个(P<0.05),包含核糖体(Ribosome)、生热作用(Thermogenesis)、一磷酸腺苷活化蛋白激酶信号通路(AMPK signaling pathway)等。

表3 9 d KEGG通路分析结果
从图3可见,核糖体信号通路极显著富集,该通路涉及的31个DEGs均为上调表达,其中组成大亚基的20个核糖体蛋白L基因 (ribosomal protein l genes,rpl)上调表达,分别是:rpl12、rpl38、rpl19、r pl35、rpl32、rpl10a、rpl31、rpl30、rpl14、rpl6、rpl11、rpl34、rpl35a、rpl24、rpl23a、rpl21、uba52、mrpl34、rpl3、rpl36a;组成小亚基的11个核糖体蛋白基因(ribosomal proteins genes,rps)上调表达,分别是:r ps17、rps18、rps8、rps7、rps13、rps19、rps4x、rps15a、rpsa、rps12、rps6。
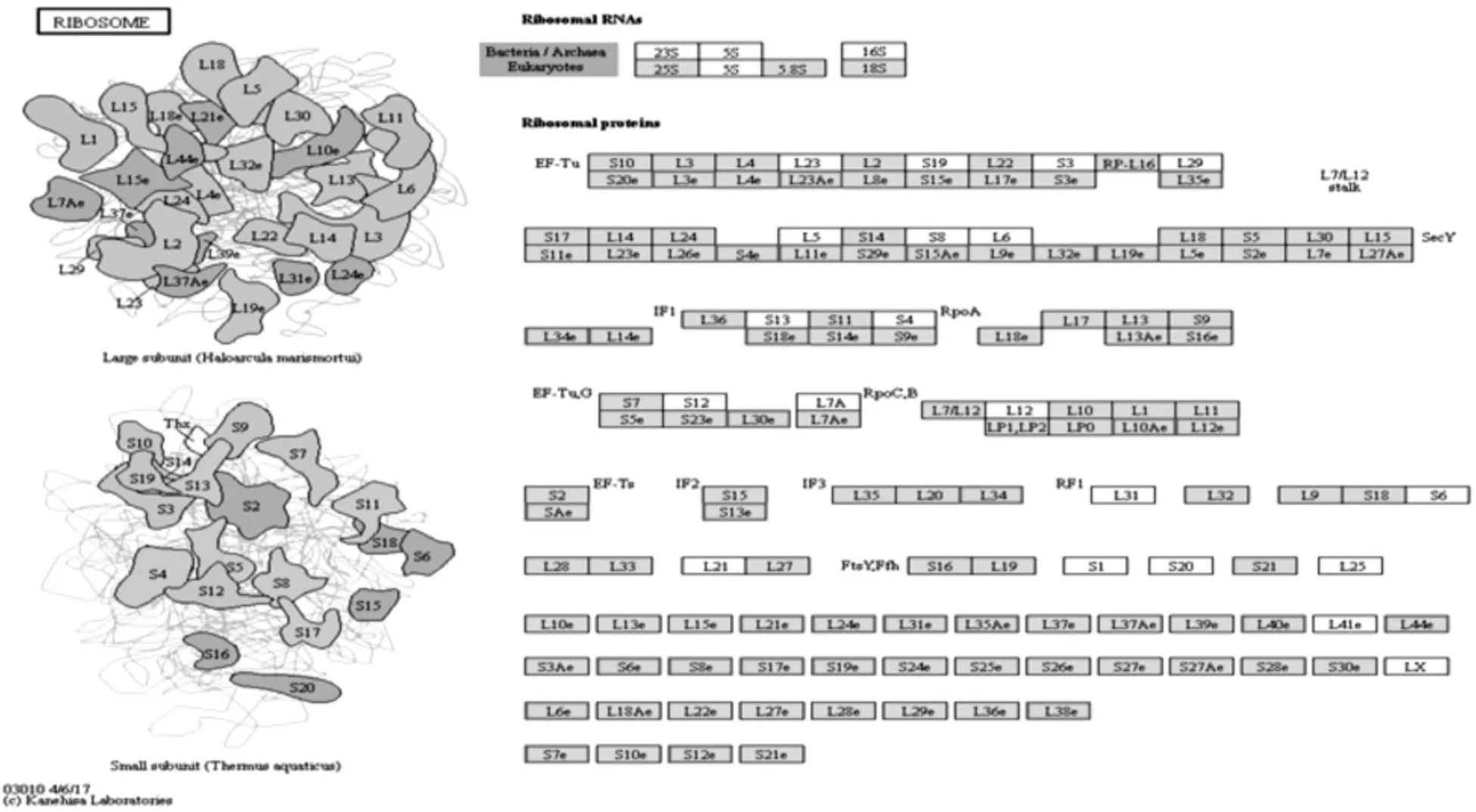
图3 免疫后9d核糖体信号通路DEGs富集结果
2.5 RT-qPCR验证 本文随机选择STAT1、RNF125、MAP3K7 3个差异表达基因进行RT-qPCR验证,结果见图4。RT-qPCR与RNA-seq测序数据一致,本次转录组测序数据可靠。

图4 3个基因RT-qPCR验证结果
3 讨 论
传统的猪瘟脾淋苗安全、免疫效果好,具有刺激猪体产生非特异性免疫增强的作用,是被广大养殖户认可的优质疫苗。为了完善猪瘟脾淋苗免疫机制研究,笔者于2020年开展了猪瘟脾淋苗免疫小猪3 d的外周血转录组测序分析,发现脾淋苗免疫组相 对 于 脾 淋 组 织 对 照 组,CXCL10、RSAD2、OAS1、OAS2、MX1、ISG15等基因显著上调表达,提示脾淋苗可能在免疫早期刺激宿主先天性免疫反应[10]。本研究进一步开展猪瘟脾淋苗免疫小猪9 d的外周血转录组分析,与免疫后3 d相比,脾淋苗相对于脾淋组织,免疫后9 d的DEGs明显增多,由3 d的317个上升到605个;免疫后9 d富集的GO功能也大幅度增加,由3 d的668个上升到1 044个,3 d的GO功能条目主要集中在与细胞对病毒的防御等互作方面,而9 d富集的GO条目主要是酰胺代谢、翻译、核糖体等;免疫后9 d,富集的KEGG信号通路数量有263个,相较于3 d的215个,也有所提升,3 d的DEGs富集的信号通路主要与免疫和抗炎相关,9 d的则主要富集在核糖体信号通路等。
核糖体由蛋白质和RNA构成,是机体蛋白质生物合成的主要场所。核糖体蛋白(Ribosomal proteins)是核糖体的主要成分,在核糖体组装和蛋白质翻译中发挥重要作用。近年来,研究人员还发现核糖体蛋白在肿瘤发生、免疫信号传导和发育等方面的功能[12],如Provost等[13-14]证实rpl3、rpl6、rpl23a三种核糖体蛋白影响斑马鱼胰腺发育。本研究表明,免疫后9 d,猪瘟脾淋苗组(A组)与脾淋组织对照组(B组)相比,DEGs主要为rpl基因和rps基因,在GO功能中极显著富集于翻译过程,核糖体、核糖体亚基组分,在KEGG数据库富集于核糖体信号通路,预示着在免疫后9 d,脾淋苗可激活外周血细胞核糖体等信号通路,促进蛋白质生物合成。
