艾灸干预腹泻型肠易激综合征大鼠miR-24/SERT/5-HT通路改善内脏高敏感状态实验观察
2022-10-14廖路敏王娇娇储浩然李奎武阮静茹祝姗姗陈进雨丁义侠王婧吉何雨霞
廖路敏,王娇娇,储浩然,李奎武, 邹 玲,阮静茹,祝姗姗,陈进雨,丁义侠,王婧吉,何雨霞
(1.安徽中医药大学,安徽 合肥 230012;2.安徽中医药大学第二附属医院,安徽 合肥 230061)
腹泻型肠易激综合征(diarrhea predominant irritable bowel syndrome,IBS-D)是一种常见的功能性肠病,30%~50%的功能性胃肠病患者存在内脏敏感性增高,主要表现为腹痛或腹部不适,且伴有稀便、水样便或排便次数增多等症状。西医治疗多采用肠蠕动抑制剂、微生物调节剂等药物对症处理,虽可缓解患者临床症状,但长期使用会产生便秘、头痛、恶心等不良反应[1]。
艾灸疗法可以改善IBS-D患者的内脏高敏感状态,缓解患者腹泻、腹痛等症状,临床疗效良好[2-4],具有临床操作简单、不良反应少等优势,但其作用机制尚未明确。众所周知,5-羟色胺(5-hydroxytryptamine,5-HT)信号传递系统与肠道感觉密切相关,虽有研究[5]报道了艾灸治疗IBS的作用机制与调节5-HT有关,但对影响5-HT合成、释放的上游调节物质,以及对内脏高敏感状态导致腹泻、腹痛症状的相关性,尚缺乏相关研究。
近年来有研究[6-7]报道,微小RNA(micro RNAs,miRNAs)参与IBS内脏高敏感状态的形成,miRNAs的调控在IBS内脏高敏感状态的发病机制中发挥着重要作用。还有多个研究[9]表明,miRNAs对5-HT信号系统具有调节作用,其中5-HT转运体(serotonin transporter,SERT)是微小RNA-24(micro RNA-24,miR-24)的潜在靶基因[9-10]。另有研究[11]表明,miR-24等参与了对5-HT的调节。艾灸治疗IBS-D的作用机制是否与调节miR-24表达,影响SERT对5-HT的调节,进而抑制内脏高敏感,改善腹泻、腹痛症状有关,目前尚未见有关研究报道。因此,艾灸疗法缓解内脏高敏感状态的作用机制,有待进一步探究。
本研究采用母子分离+醋酸刺激+慢性束缚的方法建立IBS-D大鼠模型,运用病理及分子生物学等方法,观察艾灸对miR-24/SERT/5-HT通路的影响,并对IBS-D大鼠稀便率及引起疼痛有关的物质进行相关性分析,旨在为艾灸改善IBS-D内脏高敏感状态的作用机制提供实验依据。
1 材料
1.1 动物 4只清洁级SD孕鼠(购自安徽医科大学实验动物中心),体质量为(350±20)g,生产许可证号:SCXK(皖)2017-001。实验期间动物饲养于安徽中医药大学实验动物中心清洁级动物房,室温基本恒定在(22±2)℃,普通饲料饲养,产下幼鼠39只。实验过程中对动物的处置符合国家科技部2006年颁布的《关于善待实验动物的指导性意见》的规定,实验已获得安徽中医药大学动物伦理委员会批准(编号:AHUCM-rats-2020011)。
1.2 主要试剂 5-HT、SERT、5-羟色胺受体4(serotonin receptor 4,5-HT4R)、降钙素基因相关肽(calcitonin gene related peptide,CGRP)、P物质(substance P,SP)酶联免疫吸附试剂盒:武汉基因美生物科技有限公司;SERT、5-HT4R的PCR引物(批号 20200522):上海生工生物工程股份有限公司;兔抗SERT、5-HT4抗体:北京博奥森生物技术有限公司;七氟烷(批号 65190506):鲁南贝特制药有限公司;细艾条(规格 0.7 cm×12 cm):岳阳市艾建堂生物科技有限公司。
1.3 主要仪器 酶标仪(RT-6000):雷杜生命科学股份有限公司;荧光显微镜(BX51):日本Olympus公司;荧光定量PCR仪(PIKOREAL 96):美国Thermo scientific;图像分析软件Image J:美国National Institute of Health;超微量分光光度计(OD1000+):南京五义科技有限公司;全自动数字切片扫描系统(Pannoramic MIDI):匈牙利3DHISTECH公司。
2 方法
2.1 IBS-D大鼠模型的制备和分组 随机选择12只幼年大鼠作为正常组,其余幼年大鼠参考有关报道,采用母子分离+醋酸刺激+慢性束缚法制作IBS-D大鼠模型[12]。母子分离[13]:幼年大鼠自出生第2天起,每日上午9时取出,与母鼠分开饲养3 h,随后放回,连续14 d。出生第15天不再进行母子分离,所有幼年大鼠全部正常饲养至第24天,对其进行断奶,取出母鼠。第30天将全部幼年大鼠雌雄分笼饲养。醋酸直肠刺激[14]:在幼鼠35 d龄予结直肠内醋酸灌肠刺激。幼年大鼠禁食不禁水12 h后,将石蜡油润滑的直径1 mm单腔中心静脉导管经肛门插入结直肠内4 cm,缓慢注入1 mL 4%醋酸溶液,随后将尾部抬高60 s,然后注入1 mL的PBS缓冲液冲洗结肠。慢性束缚法[15]:醋酸刺激后第3天用纸胶带束缚幼年大鼠前肢及上半身(包括前肩、前上肢、胸部),限制幼年大鼠前上肢抓挠头面部,但不限制其活动,每天2 h,连续束缚7 d。正常组不作任何处理。模型复制成功标准:大鼠稀便率达到60%,腹部回撤反射(abdominal withdrawal reflex,AWR)的最小容量阈值降低至少0.20 mL。模型复制过程中死亡3只大鼠,将模型复制成功的大鼠随机分为模型组、艾灸组,每组12只。
2.2 干预措施 正常组大鼠常规喂养,不予其他干预;模型组大鼠常规喂养,不予其他干预;艾灸组大鼠常规喂养,予以艾灸干预。将大鼠俯卧于特制大鼠艾灸架上,在平静状态下将直径0.7 cm×12 cm细艾条固定于艾灸支架下。参照《实验针灸学》[16]大鼠标准穴位图谱定位。“天枢”(ST 25)位于平脐水平线,前正中线旁开5 mm。“上巨虚”(ST 37)位于下肢外侧,腓骨小头下10 mm。距穴位约2 cm处,每日1次,每穴每次灸15 min,连续7 d。
2.3 观察指标及方法
2.3.1 稀便率 将各组大鼠分别放进不同铁笼,笼底为稀疏的网格,铁笼下方放置托盘并放置一张与托盘同样大小的普通定性滤纸。6 h后,将所有大鼠放回饲养笼中。记录大鼠粪便总粒数、稀便粒数,以滤纸上有无污迹为判断稀便的标准,共观察 6 h。稀便率=稀便数/总排便粒数×100%。
2.3.2 内脏敏感性评估 采用结肠扩张法对大鼠进行AWR评分,以评估大鼠内脏敏感性。固定由两名不知晓分组情况的成员负责操作,测定前12 h大鼠禁食不禁水。大鼠吸入七氟烷轻度麻醉后,将甘油润滑的6F导尿管缓慢插入肛门7 cm后用胶带将导尿管固定于大鼠尾根部,置大鼠于透明玻璃盒中,待大鼠苏醒且状态稳定时经球囊注入(27±1)℃的生理盐水,记录引起大鼠AWR达3分时的注水量,重复检测3次,取3次注水量的均值作为该大鼠AWR的最小容量阈值[17-18]。AWR评分标准:0分,大鼠无行为反应;1分,轻微头部运动,无身体运动;2分,腹肌收缩,但腹部不离平台表面;3分,腹肌收缩,腹部离开平台表面;4分,身体拱起,骨盆抬起,会阴抬离平台表面[19]。
2.3.3 结肠病理学观察 取甲醛固定的结肠组织,PBS溶液冲洗,乙醇梯度脱水,二甲苯透明,石蜡包埋,连续切片,厚度5 μm;采用苏木精-伊红染色,梯度乙醇(100%→95%→80%)脱蜡,流水冲洗,以苏木素染色,1%盐酸乙醇分化,流水冲洗,中性树胶封片,光学显微镜下放大400倍观察每张切片的结肠组织形态,拍照并保存图像。
2.3.4 ELISA法检测血清、中脑和结肠组织中5-HT、SERT、5-HT4R、CGRP、SP的水平 取血清标本、冻存中脑组织和冻存结肠组织,实验步骤按照试剂盒说明书进行操作。以空白孔调零,用酶标仪依序测定450 nm波长处各孔的吸光度值,并计算相应浓度。
2.3.5 RT-PCR 检测中脑和结肠组织中miR-24、SERT、5-HT4R、CGRP、SP mRNA表达水平 根据试剂盒说明书,用Trizol试剂提取中脑及结肠组织总RNA,在EP管中进行RT反应,逆转录为cDNA,取出cDNA作为荧光定量的模板,完成荧光定量PCR反应。反应结束后得到CT值,根据2-ΔΔCT计算样本mRNA表达量。引物序列见表1。

表1 引物序列
2.3.6 蛋白免疫印迹法检测中脑及结肠组织中SERT、5-HT4R、CGRP、SP蛋白表达水平 提取中脑及结肠组织蛋白,用BCA法测定蛋白含量,具体步骤根据BCA试剂盒的说明书进行,后进行蛋白变性,电泳,转膜,封闭,滴加一抗(SERT抗体、5-HT4R抗体、SP抗体均按1∶1 000稀释,CGRP抗体按1∶5 000稀释),再滴加二抗(1∶20 000稀释)。用ECL试剂中增强液与稳定的过氧化物酶溶液按1∶1比例混匀,滴在PVDF膜上,最后用化学发光法发光,用自动曝光机曝光显影,用Image J软件进行胶片条带的分析,以β-actin为内参蛋白,以目的蛋白与β-actin吸光度的比值为目的蛋白的相对表达水平。

3 结果
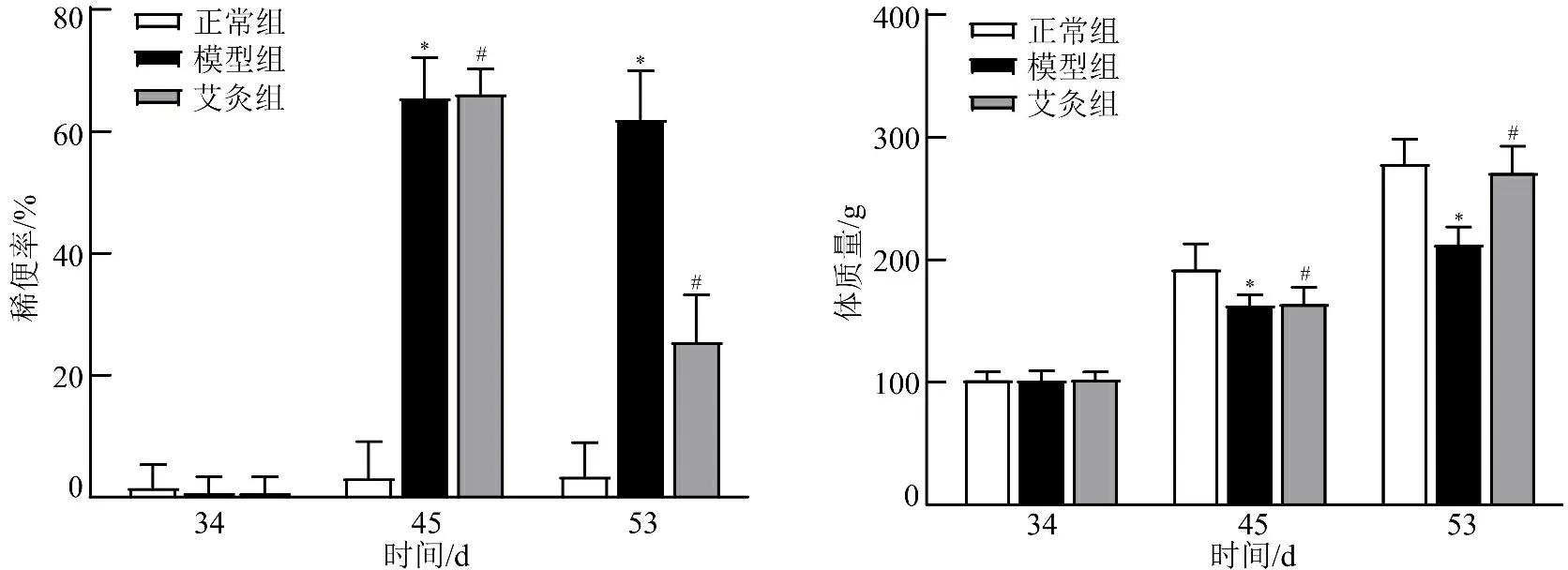
3.1 一般情况 正常组大鼠毛发有光泽,饮食正常,活动如常,反应灵敏;模型组大鼠精神较萎靡,毛发无光泽,饮食减少,活动量减弱,大便不成形,有不同程度的腹泻。模型复制前(34 d),各组大鼠体质量比较,差异无统计学意义(P>0.05);模型复制后(45 d),与正常组比较,模型组、艾灸组大鼠体质量均明显减少(P<0.05);干预后(53 d),与模型组比较,艾灸组大鼠体质量明显增加(P<0.05)。见图1。

注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.2 各组大鼠稀便率和AWR最小容量阈值比较 模型复制后(45 d),与正常组比较,模型组、艾灸组大鼠稀便率明显升高(P<0.05),AWR最小容量阈值明显下降(P<0.05);干预后(53 d),与模型组比较,艾灸组大鼠稀便率明显下降(P<0.05),AWR最小容量阈值明显升高(P<0.05)。见图2。
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.3 各组大鼠结肠组织病理学变化 正常组大鼠结肠组织结构正常,结肠黏膜上皮呈单层柱状,黏膜上皮完整,无炎症细胞浸润等病理组织学改变,未见糜烂、水肿。模型组大鼠结肠组织偶见上皮细胞排列不整齐,局部少量炎症细胞浸润,可见黏膜下轻度糜烂、水肿。艾灸组大鼠结肠组织黏膜下炎症细胞减少,未见糜烂、水肿。见图3。
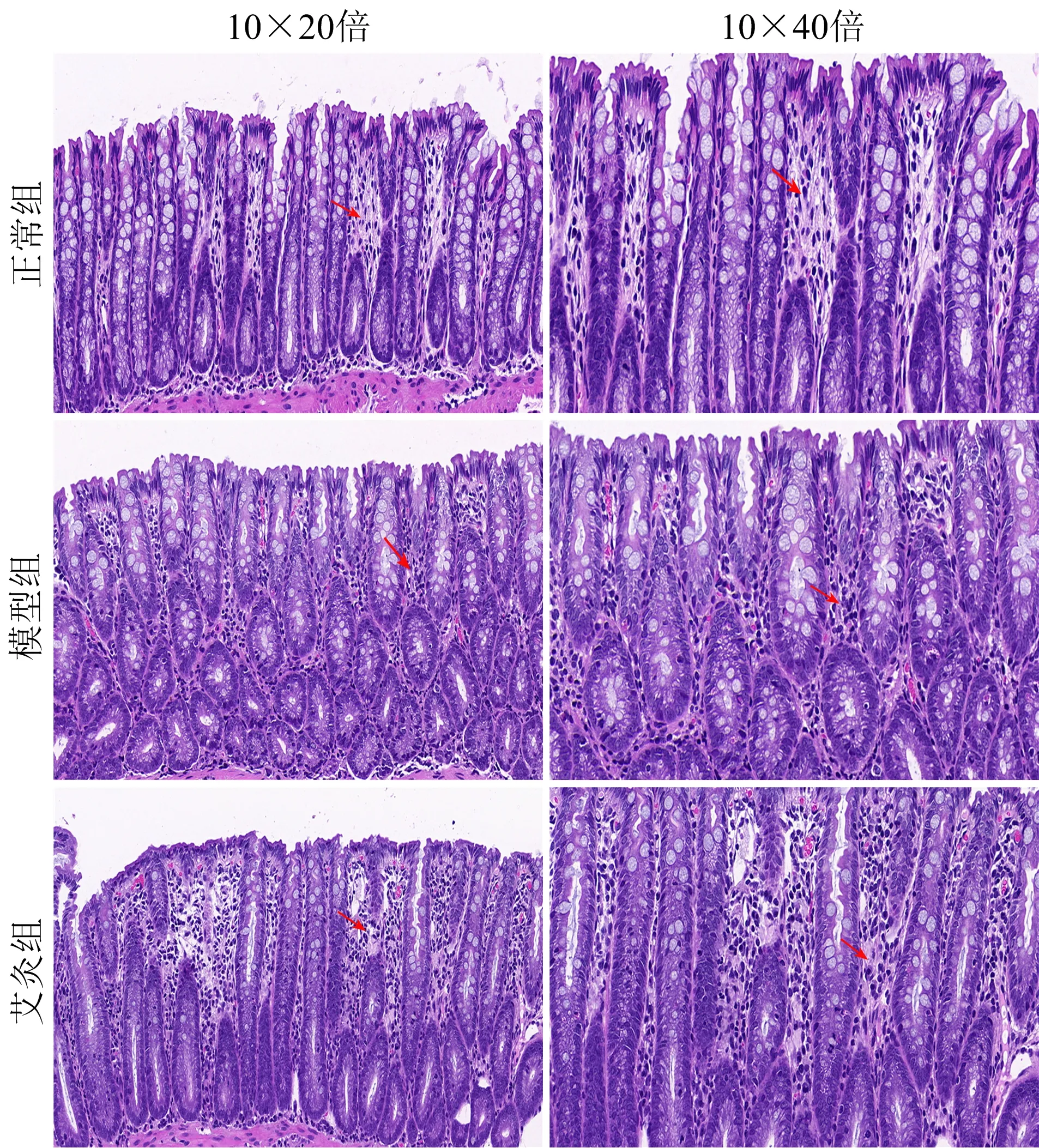
注:箭头所示为炎症细胞浸润
3.4 各组大鼠血清、中脑、结肠组织中SERT、5-HT、5-HT4R、CGRP、SP水平比较 与正常组比较,模型组大鼠血清、中脑和结肠组织中5-HT、5-HT4R、CGRP、SP水平均显著升高(P<0.05),SERT水平均显著降低(P<0.05)。与模型组比较,艾灸组大鼠血清、中脑和结肠组织中5-HT、5-HT4R、CGRP、SP水平均显著降低(P<0.05),SERT水平显著升高(P<0.05)。见图4。
3.5 各组大鼠中脑、结肠组织中miR-24、SERT、5-HT4R、CGRP、SP mRNA表达水平比较 与正常组比较,模型组大鼠中脑、结肠组织中miR-24、5-HT4R、CGRP、SP mRNA表达水平均显著升高(P<0.05),SERT mRNA表达水平均显著降低(P<0.05)。与模型组比较,艾灸组大鼠中脑、结肠组织中miR-24、5-HT4R、CGRP、SP mRNA表达水平均显著降低(P<0.05),SERT mRNA表达水平均显著升高(P<0.05)。见图5。
3.6 各组大鼠中脑、结肠组织中SERT、5-HT4R、CGRP、SP蛋白表达水平比较 与正常组比较,模型组大鼠中脑、结肠组织中SERT蛋白表达水平显著降低(P<0.05),5-HT4R、CGRP、SP蛋白表达水平显著升高(P<0.05)。与模型组比较,艾灸组大鼠中脑、结肠组织中SERT蛋白表达水平显著升高(P<0.05),5-HT4R、CGRP、SP蛋白表达水平显著降低(P<0.05)。见图6。
4 讨论
中医典籍中并无IBS-D的病名,根据其临床表现常可归属为“腹痛”“泄泻”和“郁证”等病证范畴。《景岳全书》云:“泄泻之本,无不由脾胃。”依据“中焦如衡,非平不安”的中医理论思想,临床多采用“调和脾胃”之法来权衡枢纽[20-21],穴位选取天枢和上巨虚。天枢穴为手阳明大肠经募穴,可调理中焦、调畅气机。上巨虚为大肠经下合穴,《灵枢·邪气脏腑病形》记载:“合治内腑”,故本穴尤善调肠和胃。合募配穴治疗腑病,意在升清降浊、补中益气、止泻止痛。本研究发现,IBS-D大鼠稀便率升高,AWR最小容量阈值下降,内脏敏感性增强。艾灸天枢、上巨虚干预后,IBS-D大鼠稀便率降低,AWR最小容量阈值上升,内脏敏感性减弱。结果提示艾灸可以有效改善IBS-D大鼠稀便率,缓解腹泻等内脏高敏感状态。
5-HT是脑-肠互动中具有外周致痛作用的重要单胺类神经递质[22],当中枢系统及胃肠道5-HT水平异常升高,堆积后可触发兴奋性毒性,使迷走神经调控功能受损,出现内脏高敏感状态[23-24]。SERT是5-HT失活的重要的转运体,因而SERT的表达活性可能通过影响5-HT系统的活性而影响内脏高敏感状态的产生[25]。本研究结果表明,IBS-D大鼠脑、肠、血清中5-HT水平均显著上升,SERT水平下降,SERT蛋白及基因表达水平降低,内脏敏感性升高。艾灸后,5-HT水平均显著下降,SERT水平上升,SERT蛋白及基因表达水平升高,内脏敏感性降低。这提示艾灸干预可提高SERT蛋白及基因表达水平,抑制5-HT活性,进而降低IBS-D大鼠内脏敏感性。
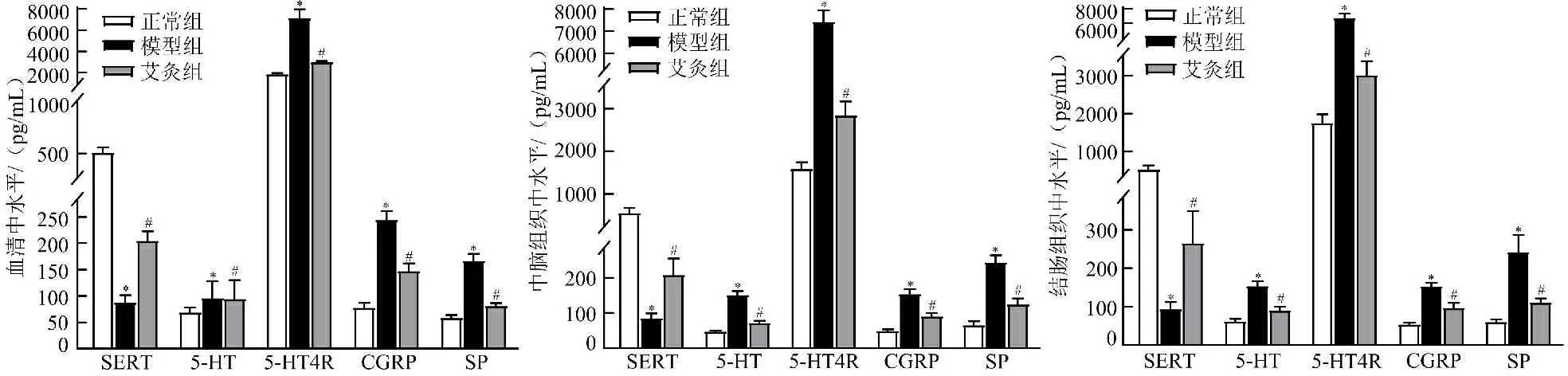

注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
在5-HT众多受体中,5-HT4R与IBS的内脏高敏感状态较为密切,5-HT与5-HT4R结合后,开放电压敏感性钙通道,促使CCRP、SP等伤害性神经递质的释放增加,影响胃肠道的运动与分泌,调节蠕动反射及内脏感觉[26]。此外,肠道中5-HT4R也可直接参与内脏感觉信息的传递[27]。有报道证实,5-HT4R激动剂可减少正常大鼠对直结肠机械刺激的内脏运动反应,使5-HT4R激动剂预处理后的内脏高敏感模型大鼠的肠道神经痛觉敏感性减弱或正常化[28]。本研究发现,IBS-D大鼠脑、肠、血清中5-HT4R水平上升,5-HT4R蛋白及基因表达水平升高,可引起IBS-D大鼠肠道运动反应增强。艾灸后,5-HT4R水平、蛋白及基因表达水平均降低。结果提示艾灸可能通过下调5-HT4R表达水平,使IBS-D大鼠肠道运动反应减弱,从而降低内脏敏感性。
SP在痛觉传递中的镇痛作用是通过促进脑啡肽的释放实现的[29]。CGRP是在外周感觉传入神经中与SP共存的一种神经肽,除了可以直接产生伤害性作用外,还可以通过促进SP释放、抑制SP分解、延长SP作用时间等机制参与内脏伤害性信息的传入,导致内脏敏感性增高[30-31]。本研究结果显示,IBS-D大鼠脑、肠、血清中CGRP、SP蛋白及基因表达水平均明显升高,表明IBS-D大鼠引发致痛物质增加。艾灸干预后,脑、肠、血清中CGRP、SP水平、蛋白及基因表达水平均明显降低。这提示艾灸可能通过抑制CGRP、SP疼痛物质对胃肠道的伤害性刺激,抑制疼痛信号传递,缓解内脏敏化状态。
有研究[9,32]表明,SERT mRNA是miR-24的靶基因,且miR-24与SERT的表达呈显著负相关,miR-24抑制剂可以增加IBS小鼠近端结肠的疼痛阈值和伤害性阈值水平,降低过氧化物酶活性,并上调肠黏膜上皮细胞SERT的mRNA和蛋白表达水平。本研究结果与上述文献报道一致。IBS-D大鼠miR-24表达水平升高,SERT mRNA和蛋白表达水平降低。艾灸干预后,miR-24表达水平降低,SERT mRNA和蛋白表达水平升高,表明艾灸通过调节miR-24表达水平,从而提高SERT mRNA和蛋白表达水平,进而减低5-HT对肠道的影响,改善内脏高敏感状态。
综上,艾灸天枢、上巨虚穴可调控IBS-D大鼠miR-24/SERT/5-HT通路,缓解腹痛、腹泻等不适症状,其机制可能是通过下调miR-24表达水平,增强SERT的表达,减少异常升高的5-HT与5-HT4R结合,抑制CGRP、SP的产生,降低肠道痛觉传入神经的兴奋性,进而缓解内脏高敏感状态。本研究对促进艾灸疗法治疗IBS-D的临床应用提供了新的科学依据。然而,艾灸治疗IBS-D的作用机制复杂,产生改善内脏高敏感状态的因素较多,本研究仅仅围绕miR-24/SERT/5-HT通路进行了初步探讨分析,而要阐明艾灸治疗IBS-D的作用机制,仍有待于今后继续深入观察研究。
