咪喹莫特诱导的银屑病小鼠皮损中VEGFR-1与VEGFR-2 的表达研究
2022-10-14吴蕙慧罗泽宇庄涵喻刘隽华罗迪青赵玉昆
吴蕙慧 罗泽宇 庄涵喻 刘隽华 罗迪青 赵玉昆#
银屑病是一种常见并易复发的慢性皮肤病,患病率约2%-3%,以青壮年为多。银屑病病因至今未明,普遍认为它是遗传与环境等多种因素相互作用的多基因遗传病,通过免疫反应介导人体免疫系统、神经系统、炎症介质等方面的失衡,与炎症性关节炎,心脑血管疾病,心理疾病等存在关联。迄今为止,并无令人满意的治疗策略。近年来研究发现促血管生成因子水平的升高与血管生成异常与银屑病发病密切相关[1]。我们研究已经发现咪喹莫特诱导的银屑病小鼠模型皮损中血管密度增加[2]以及VEGF 水平升高[3],本研究将继续以咪喹莫特诱导的银屑病小鼠模型为实验对象,评估其皮损中VEGFR-1 与VEGFR-2 的表达水平,为银屑病血管机制的研究以及抗血管治疗提供实验基础。
1 材料与方法
1.1 材料8-11 周龄Balb/c 雌性小鼠12 只,SPF级,体重在18-22 g 之间,购于中山大学实验动物中心,许可证号:SYXK(粤)2010-0108,饲养于无特定病原条件下,随时供给水和食物。所有动物实验均通过中山大学附属第一医院动物伦理委员会批准(编号:2012353)。5%咪喹莫特乳膏,商品名:艾达乐,3M 公司生产。兔抗鼠VEGFR1 抗体、VEGFR2 抗体,购自BIOSS 北京博奥森公司。
1.2 方法(1)采用咪喹莫特乳膏诱导法建模。购入的Balb/c 小鼠用剃毛器在每只小鼠背部剃去约2 cm×3 cm 区域的毛发,区域中剩余毛发用脱毛剂(薇婷,法国Reckitt Benckiser 公司)完全去除。分为正常对照组、实验组,正常对照组5 只,实验组7 只。实验组按照文献方法[4]建模。正常对照以白凡士林80 mg 处理6 天。造模第7 天,将12 只Balb/c 小鼠以颈椎脱臼法处死后剪取小鼠背部皮损石蜡包埋、组织切片行以下实验:(2)HE 染色(3)VEGFR-1、VEGFR-2 免疫组化染色(SP 法),并应用Image-ProPlus6.0 软件分析得出该片免疫组化染色阳性的累积光密度值(IOD)。(4)每张切片均随机选取5 个不同视野(200 倍),计算该视野的微血管数、毛囊数、表皮厚度以及阳性染色的血管数和毛囊数。
1.3 统计学分析SPSS13.0 软件进行数据分析。计量单位使用(x±s)表示,符合正态分布图使用t检验,不符合则使用秩和检验。P<0.05 表示差异具有统计学意义。
2 结 果
2.1 成功建模使用咪喹莫特诱导的银屑病小鼠模型第7 天,局部皮肤出现边界清楚、大小形状不等的红色斑块,表面覆有白色鳞屑;正常对照组皮肤未见明显异常,见图1。HE 染色显示实验组小鼠表皮角化过度、角化不全,伴有munro 或Kogoj微脓肿,棘层增厚,颗粒层缺失,角质形成细胞约8-10 层,表皮增生呈杵状,真皮乳头上延,真皮浅层及乳头可见炎性细胞浸润,以及较多新生毛细血管,见图2,与人类银屑病高度相似。

图1 (a)正常组和(b)实验组皮肤大体表现
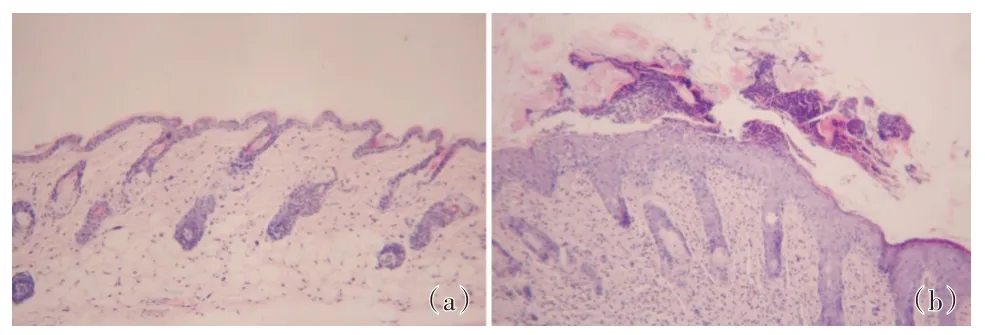
图2 (a)正常组和(b)实验组小鼠皮损组织病理(HE 染色,×200)
2.2 VEGFR-1、VEGFR-2 免疫组化染色及IOD值比较见表1。实验组表皮全层、真皮浅层微血管以及毛囊可见散在的棕黄色染色的阳性细胞,见图3。

图3 (a)实验组VEGFR-1 免疫组化染色;(b)正常组VEGFR-1 免疫组化染色;(c)实验组VEGFR-2 免疫组化染色;(d)正常组VEGFR-2 免疫组化染色,SP 染色,×200)。

表1 两组VEGFR-1、VEGFR-2 免疫组化染色IOD 值比较(x±s)
2.3 真皮血管VEGFR 染色阳性率比较见表2。

表2 两组真皮血管VEGFR 染色阳性率比较(x±s)
2.4 两组间毛囊VEGFR 染色阳性率比较见表3。

表3 两组毛囊VEGFR 染色阳性率比较(x±s)
2.5 VEGFRs 免疫组化染色IOD 值与微血管数量相关性比较实验组VEGFR-1 血管免疫组化染色IOD 值(Pearson 积矩相关系数,r=0.931,P<0.05);与实验组VEGFR-2 血管免疫组化染色IOD值(Spearman 等级相关系,r=0.751,P<0.05)与微血管计数存在正相关关系。
2.6 VEGFRs 免疫组化染色IOD 值与表皮厚度相关性比较VEGFR-1 免疫组化IOD 值与表皮厚度(57.84±35.55)μm 存在正相关(Pearson 积矩相关系数,r=0.871,P<0.05);VEGFR-2 免疫组化IOD 值与表皮厚度存在正相关(Spearman 等级相关系数,r=0.785,P<0.05)。
3 讨 论
银屑病是一种常见的,慢性炎症性,多系统疾病,其发病机制复杂,血管生成与微血管异常是银屑病发病机制中的重要环节,微循环的改变是银屑病的重要组织病理改变[5],表现为真皮乳头层血管增多,迂曲扩张,而且血管变化先于银屑病的表皮增生,银屑病的改善通常伴随着血管结构的正常化,而血管生成与VEGF 密切相关[6]。VEGFR-1 和VEGFR-2 是传导VEGF 信号的主要酪氨酸激酶受体,目前研究认为VEGFR-1 可间接或直接调节VEGFR-2 信号,VEGFR-1 是在胚胎形成期正常血管发育所必须的,VEGFR-2 则主要介导VEGF 的促血管生成与增生[7]。目前已有研究证实在银屑病中,血管内皮细胞的VEGF/VEGFR 信号能增强血管通透性,促进炎症反应,同时能诱导血管内皮细胞细胞的生长。角质形成细胞的VEGF/VEGFR 信号能通过自分泌方式加强角质形成细胞增殖和表皮屏障稳态,这可能是银屑病表皮变化及Koebner 现象的机制之一。此外,VEGF 能增强VEGFR 的表达,进一步扩大银屑病病理生理变化[7]。
我们的研究发现,实验组皮损出现VEGFR-1、VEGFR-2 蛋白的过度表达并分布在表皮角质形成细胞以及血管内皮细胞,VEGFR-1 与VEGFR-2 免疫组化染色的光密度值与血管数量、表皮厚度呈正相关关系,提示VEGFR-1 与VEGFR-2 的表达强度与小鼠银屑病模型的严重程度相关,与人类银屑病表达模式一致,提示咪喹莫特银屑病小鼠模型在VEGF/VEGFR 信号机制上的研究价值。
正常组血管内皮细胞表面VEGFR-1 和VEGFR-2 表达密度无明显差异,而实验组血管内皮细胞表面VEGFR-1 的表达密度高于VEGFR-2,目前尚无关于人类银屑病皮损中VEGFR-1 和VEGFR-2 比例变化的研究,尚需进一步探究。实验组皮损中VEGFR-1 与VEGFR-2 在毛囊的表达较正常组高,提示VEGFR-1 与VEGFR-2 可能通过调控毛囊参与到银屑病角质形成细胞增殖与血管增生[8]。
咪喹莫特诱导的银屑病小鼠模型的皮损临床表现与病理特征与人类银屑病类似,尤其是存在与人类银屑病相似的血管增生相关因子(VEGFA)及其受体(VEGFR-1、VEGFR-2)的异常表达和分布,为咪喹莫特诱导的银屑病小鼠模型用于银屑病血管生成方面的机制研究及抗血管治疗的研究提供实验基础。
