盐酸阿芬太尼注射液在全身麻醉中有效性和安全性研究:一项多中心、双盲、对照研究
2022-10-14陈明华薛富善罗爱林郭曲练王亚平艾登斌刘功俭段开明欧阳文汪赛赢
陈明华,薛富善,冯 艺,罗爱林,郭曲练,王亚平,艾登斌,刘功俭,段开明,欧阳文,汪赛赢
(1.中南大学湘雅三医院麻醉科,湖南 长沙 410013;2.首都医科大学北京友谊医院麻醉科,北京 100050;3.北京大学人民医院麻醉科,北京 100044;4.华中科技大学同济医学院附属同济医院麻醉科,湖北 武汉 430030;5.中南大学湘雅医院麻醉科,湖南 长沙 410008;6.中南大学湘雅二医院麻醉科,湖南 长沙 410011;7.青岛市市立医院麻醉科,山东 青岛 266011;8.徐州医科大学附属医院麻醉科,江苏 徐州 266011)
阿片类药物是抑制手术引起的伤害性应激反应不可或缺的麻醉药物。而随着外科手术向着微创、快速康复的方向飞速发展,对麻醉的安全性、有效性和快速苏醒提出了更高的要求。阿芬太尼通过激动μ阿片受体而产生镇痛作用,是所有阿片类药物中起效最快,消除半衰期最短的强效阿片类药物,非常符合现代外科发展的需要,因此,许多门诊手术及无痛诊疗技术使用阿芬太尼进行镇痛。有研究表明,阿芬太尼在全身麻醉中可控性好,能强效抑制创伤应激效应[1];但是大多数麻醉医生对阿芬太尼在全身麻醉中使用的临床经验有限,且目前没有很好的前瞻性对照研究对其安全性和有效性进行系统评价,而芬太尼和阿芬太尼作用机制相同,同为作用于μ阿片受体强效镇痛药,也是目前临床上使用最广泛的阿片类药物之一,其安全性和有效性得到临床医生一致认可,有研究显示阿芬太尼和芬太尼都能很好的抑制全身麻醉中气管插管的应激反应[2]。而阿芬太尼相对芬太尼,起效快(1~2 min),作用时间更短(约为芬太尼的1/3),镇痛效价更强(约为芬太尼的3~10倍),更适用于现代外科发展的需要。因此,本研究以芬太尼为对照,全面观察阿芬太尼应用于全身麻醉时的药效学特征和临床安全性,为阿芬太尼应用于全身麻醉的有效性和安全性提供更多的参考,从而进一步提高外科手术围术期康复的速度和质量。
1 材料与方法
1.1 研究设计本研究获得中南大学湘雅三医院医学伦理委员会的批准(批准号:2016L04838/2016L04837),采用随机、双盲、对照、多中心设计。
1.2 研究对象本研究共筛选受试者352名,由与本实验无关的工作人员使用SAS9.4版统计软件包产生的随机数字进行随机分配至芬太尼组(A组,n=176)和阿芬太尼组(B组,n=176)。考虑到临床上腹腔镜和开腹手术各占一定比例,所以为了更好地验证阿芬太尼应用于此两类手术的有效性和安全性,我们在病例选择时,对行腹腔镜手术和非腹腔镜手术按照3 ∶8的比例进行纳入(各中心均按此比例进行病例收集),由于有分层因素,故药物编号为腹腔组Q001-Q096,非腹腔组为K001-K256。本研究共纳入8个研究中心,各个研究中心所分配的受试者药物编号是随机的,研究者采用研究中心分层的区组随机方法,并按照入选病例的手术类型进行分层,根据受试者的随机数字编号进行区组分层法选取相对应的研究药物,全身麻醉实施的研究者和配药者互为双盲。
受试者入选标准:年龄18~65岁,性别不限,BMI 18~30 kg/m2;ASA Ⅰ~Ⅱ级;预计麻醉时长 1~4 h非心脏、非开颅、非开胸、非肝胆肾脏择期手术;全身麻醉气管内插管的手术病人,自愿参加并签署了知情同意书。受试者排除标准:ASA 分级Ⅲ级及以上者;孕妇、产妇、哺乳期妇女;三个月内参加过其他药物试验;患有控制不佳的高血压;对阿片类药物及其他麻醉药物过敏者;筛选前1年内有酗酒史或药物滥用史;3个月内长期规律使用镇痛药、精神系统药物(包括阿片,镇静药,抗抑郁药,抗癫痫药物)、α2-肾上腺素受体激动剂;术前肝肾功能异常;研究者认为有任何原因不能入选者。
1.3 试验的实施
1.3.1麻醉诱导与维持 所有受试者不用术前药,入手术室后监测心率、血压、指脉搏血氧饱和度,开放上肢静脉,经静脉输注晶体液5~10 mL·kg-1,静脉给予咪达唑仑(江苏恩华)0.03 mg·kg-1。面罩吸氧,缓慢静脉注射芬太尼(宜昌人福)4 μg·kg-1(A组)或阿芬太尼(江苏恩华)25 μg·kg-1(B组),然后静脉注射丙泊酚(北京费森尤斯)2 mg·kg-1,待受试者意识消失后,快速静注罗库溴铵(浙江仙据)0.8 mg·kg-1,2min完成气管内插管。气管导管连接麻醉机,行机械通气,调节潮气量和呼吸频率,使PEtCO2维持于35~45 mmHg。在麻醉诱导及气管内插管期间,如心率≥100次/min,持续1 min以上,静脉注射艾司洛尔30 mg控制心率,必要时重复使用;心率慢于50次/min,静注阿托品0.3 mg,必要时重复使用。SBP≥180 mmHg,静脉注射尼卡地平0.3 mg,必要时重复使用;SBP≤80 mmHg,静脉注射去氧肾上腺素40 μg,必要时重复使用。
气管内插管后10 min开启注射泵,A组患者输注芬太尼0.02~0.12 μg·kg-1·min-1,B组患者输注阿芬太尼0.5~3.0 μg·kg-1·min-1,术中麻醉维持以七氟烷(江苏恒瑞)+芬太尼(A组)或阿芬太尼(B组)+间断注射罗库溴铵(10~20 mg/次)。麻醉维持期血压的维持目标在平静基础值(诱导前基线值)的±30%范围、目标心率在50~99 bpm。当受试者发生高血压(SBP大于诱导前基线值的30%或≥180 mmHg),同时伴有心动过速(HR≥100 bpm)时,A组单次静脉注射芬太尼1.2 μg·kg-1,B组单次静脉注射阿芬太尼30 μg加深麻醉,必要时可重复3次,如仍然无效时,静脉注射尼卡地平0.3 mg控制高血压,静注艾司洛尔30 mg控制心率,必要时重复使用。当发生高血压但心率在50~99 bpm时,注射研究药物和尼卡地平的方法同上,任意步骤成功控制血压后,观察药物静脉输注速度至少提升1档(相当于对A组患者接受芬太尼0.02 μg·kg-1·min-1的输注增加量,B组患者阿芬太尼0.5 μg·kg-1·min-1的输注增加量)。当高血压伴有慢心率(<50次/min)时,注射研究药物和尼卡地平的方法同上,静脉注射阿托品0.3 mg提升心率,必要时重复使用。任意步骤成功控制血压后,观察药物静脉输注速度至少提升1档(相当于对A组患者接受芬太尼0.02 μg·kg-1·min-1的输注增加量,B组患者阿芬太尼0.5 μg·kg-1·min-1的输注增加量)。当血压在目标值、心率慢于50次/min,可静注阿托品0.3 mg,必要时重复使用。当SBP低于平静基础值(诱导前基线值)的30%或≤80 mmHg,研究药物的泵注速度立即减至5 mL/h(相当于对A组患者芬太尼0.02 μg·kg-1/min的输注速率,B组患者阿芬太尼0.5 μg·kg-1/min的输注速率),静注去氧肾上腺素40 μg,必要时重复使用。手术结束前30分钟左右停止使用罗库溴铵,手术结束前20分钟左右停止观察药物输注(芬太尼或阿芬太尼),手术结束前10 min左右停止吸入七氟烷,从停止输注药物(芬太尼或阿芬太尼)至停止吸入七氟烷期间,若发生高血压,则静脉注射尼卡地平0.3 mg控制,必要时重复使用。手术结束后静注阿托品1~2 mg和新斯的明2~4 mg,拮抗肌松药物残留肌松作用,等待呼吸恢复、气道保护反射恢复满意时拔除气管内导管。
1.3.2疗效观察
1.3.2.1在麻醉诱导插管期,记录静脉注射观察药物(芬太尼或阿芬太尼)前、气管内插管前、插管完成后0、1、2、3、5、7、10 min的SBP、DBP、HR、SpO2和RPP(RPP是心率与收缩压的乘积,即SBP×HR);记录气管内插管完成后3 min 内的SBP最大变化率,其定义和计算公式如下:(插管完成后3 min内SBP最大测量值-插管前基线值)/(插管前基线值)×100%。计算麻醉诱导插管期间的血压、心率、RPP的稳定性,以变异系数(lariable coefficient,CV)衡量,CV=SD/mean×100%。
1.3.2.2麻醉维持期间,记录手术切皮前和切皮完成后0、1、2、3、4、5、7、10 min及其后每10min的SBP、DBP、HR、SpO2和RPP直至停止吸入七氟烷;记录手术切皮完成后5 min内的SBP最大变化率,其定义和计算公式如下:(切皮完成后5 min内SBP最大测量值-切皮前基线值)/(切皮前基线值)×100%。计算麻醉维持期间的血压、心率、RPP的稳定性,稳定性以变异系数(CV)衡量,CV=SD/mean×100%。
1.3.2.3麻醉苏醒期间,记录两组患者麻醉结束后阿片类药物拮抗剂使用、肌松拮抗剂使用、患者苏醒后撤除气管内导管时间。
1.3.3安全性评价
1.3.3.1记录患者麻醉诱导与维持期低血压发生情况(定义标准:超过基线值的负30%且收缩压低于80 mmHg)。
1.3.3.2记录严重高血压和严重低血压、心动过速和心动过缓的发生频率(以研究者观察到的需要处理的为准)。定义:当观察期间的SBP≥180 mmHg或≤80 mmHg,定义发生了一次严重高血压或严重低血压;当心率≥100 bpm或<50 bpm时,定义为发生了一次心动过速或心动过缓。
1.3.3.3记录两组患者不良事件。
1.3.3.4记录麻醉诱导与维持期间血管活性药物尼卡地平、去氧肾上腺素、阿托品、艾司洛尔的使用情况。

2 结果
本次临床研究入组352例受试者,均完成了临床观察。
2.1 人口学资料结果显示两组受试者在平均年龄、身高、体重、BMI、性别构成比、民族、ASA分级、麻醉时长、手术时长、手术中失血量,术中肌松剂使用量两组比较差异均无统计学意义。
2.2 疗效评价
2.2.1诱导前基线 两组受试者诱导前基线值SBP、DBP、MAP、HR、RPP的比较差异均无统计学意义(P>0.05)(Fig 1~3),吸空气情况下SpO2均高于95%。
2.2.2麻醉诱导期 两组患者麻醉诱导后气管内插管期比较,阿芬太尼组患者在气管内插管后0min、气管内插管后1min时SBP、DBP、MAP和RPP均低于芬太尼组(P<0.05)。但是两组比较,在心率、SpO2无统计学意义(P>0.05),并且两组患者SpO2全程维持98%以上。但是两组患者在气管内插管完成后3 min内SBP最大变化率比较差异无统计学意义(P>0.05)(Fig 1~3)。
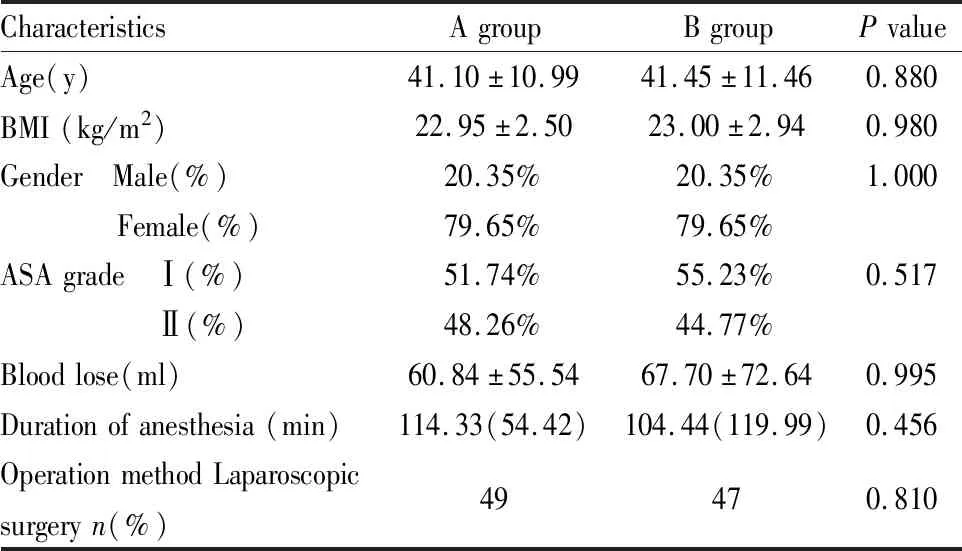
Tab 1 Baseline characteristics of two group

Tab 2 Comparison of stability of vital signs between two groups during anesthesia induction
2.2.3麻醉维持期 两组受试者手术开始切皮前SBP、DBP、MAP、HR、RPP比较差异无统计学意义(P>0.05)。手术开始后7、10、20、30、40、50、60、70、80、90、110、120、130、140、150、160、170 min阿芬太尼组患者SBP低于芬太尼组(P<0.05)。手术开始后20、30、40、50、60、70、120、130、140、150、160、170min阿芬太尼组患者DBP低于芬太尼组(P<0.05)。手术开始后10、20、30、40、50、60、70、80 min阿芬太尼组患者MBP低于芬太尼组(P<0.05)。手术开始后3、40、50、60、70、80、90、120、130 min阿芬太尼组患者HR低于芬太尼组(P<0.05)。手术开始后20、30、40、50、60、70、80、90、120、130、140、150 min阿芬太尼组患者RPP也低于芬太尼组(P<0.05) (Fig 1~3) 。两组患者在SpO2比较无显著性(P>0.05),并且两组患者SpO2全程维持98%以上。在手术切皮开始后5min内SBP最大变化率A组为(34.27±24.68)%,B组为(32.53±23.81)%,两组比较差异无显著性(P>0.05)。
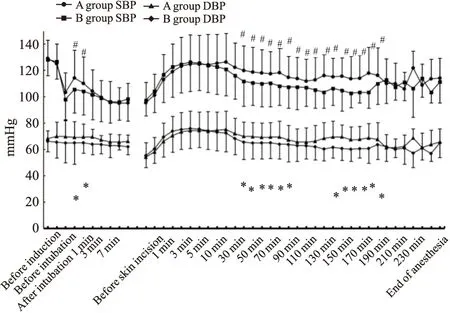
Fig 1 Comparison of blood pressure between the two groups#P<0.05(SBP),*P<0.05(DBP)
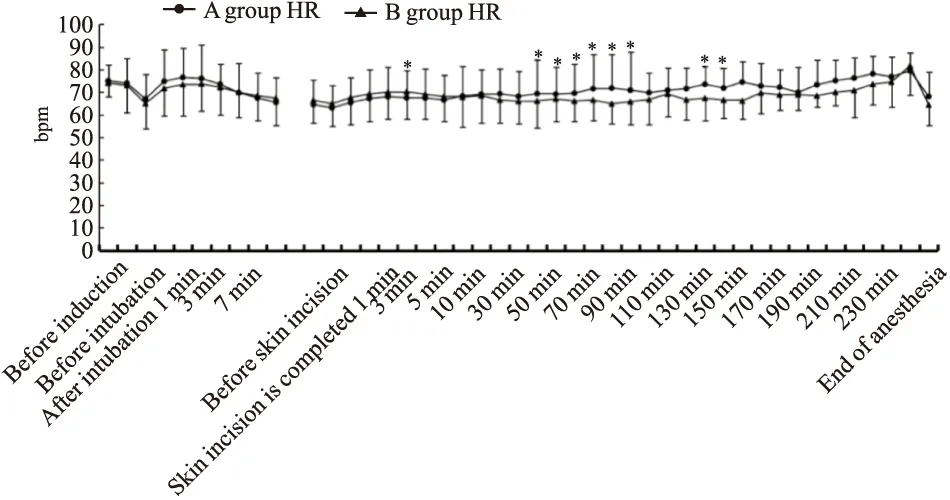
Fig 2 Comparison of heart rate between the two groups*P<0.05

Fig 3 Comparison of the product of heart rate and systolic blood pressure(RPP) between two grpus*P<0.05

Tab3 Comparison of stability of vital signs between two groups in anesthesia maintenance
2.2.4麻醉苏醒期 两组患者麻醉结束后阿片类药物拮抗剂纳洛酮使用(A组1例、B组2例),肌松拮抗剂新斯的明+阿托品差异无显著性(P>0.05);患者从停止使用试验药物到苏醒的时间A组为(35.55±18.23) min、B组为(32.75±14.62) min,两组比较差异无显著性(P>0.05)。患者从停止使用试验药物到撤除气管内导管的时间A组为(39.61±17.20) min、B组为(38.58±16.51) min,两组比较差异无显著性(P>0.05)。
2.3 安全性评价
2.3.1血压下降比较 (超过基线值的负30%且>80 mmHg),麻醉诱导期A组血压下降的发生率为30.81%、B组为38.37%,组间差异没有统计学意义(P=0.174)。麻醉维持期A组血压下降的发生率为38.81%、B组为38.37%,组间差异没有统计学意义(P=0.765)。两组麻醉恢复观察期均未有受试者发生血压下降。
2.3.2严重血压、心率异常 麻醉诱导期对安全性指标的观察结果,包括高血压(收缩压>180 mmHg)A组发生率1.16%、B组1.16%,低血压(收缩压<80 mmHg)发生率A组26.16%、B组30.23%,心动过速(>100 bpm)发生率A组4.65%、B组6.40%,心动过缓(心率<50 bpm)发生率A组4.65%、B组6.40%,两组比较均没有差异性(P>0.05)。麻醉维持期对安全性指标的观察结果,包括高血压(收缩压>180 mmHg)A组发生率9.30%、B组5.26%,低血压(收缩压<80 mmHg)发生率A组19.19%、B组19.88%,心动过速(>100 bpm)发生率A组4.65%、B组2.34%,心动过缓(心率<50 bpm)发生率A组4.65%、B组3.50%,两组比较均没有差异性(P>0.05)。
2.3.3不良事件(具体) 严重不良事件发生率,A组是0.58%,B组是1.16%,组间差异无统计学意义(P=1.000)。与研究药物相关的严重不良事件发生率,A组是0,B组是1例,组间差异无统计学意义(P=1.000)。
2.3.4补救用药 麻醉诱导期尼卡地平应用率为A组1.16%、B组0.58%,用量A组0.30±0.01 mg、B组(0.60±0.17) mg;去氧肾上腺素应用率为A组26.16%、B组30.23%,用量A组(58.89±27.62) μg、B组(66.15±36.20) μg;阿托品应用率为A组6.40%、B组6.40%,用量A组(0.30±0.01) mg、B组(0.33±0.09) mg;艾司洛尔应用率为A组4.65%、B组5.81%,用量A组(33.75±10.61) mg、B组(33.00±9.49) mg,两组用药比例和总量比较没有差异性(P>0.05)。
麻醉维持期尼卡地平应用率为A组2.33%、B组1.17%,用量A组(0.45±0.17) mg、B组(0.45±0.21) mg;去氧肾上腺素应用率为A组44.77%、B组51.46%,用量A组(144.42±161.07) μg、B组(160.45±166.59) μg;阿托品应用率为A组19.77%、B组21.64%,用量A组(0.33±0.09) mg、B组(0.34±0.14) mg;艾司洛尔应用率为A组4.65%、B组2.34%,用量A组(48.75±42.24) mg、B组(45.00±30.00) mg,两组用药比例和总量比较没有差异性(P>0.05)。
3 讨论
本研究结果显示,阿芬太尼和芬太尼都有良好的麻醉性镇痛作用,都能很好的满足临床麻醉的需求;结果显示,无论是在麻醉诱导气管内插管时还是麻醉维持期手术刺激期,阿芬太尼都表现出更强的麻醉效能,更能减少气管内插管和手术创伤引起的血压升高反应;但是两组患者在术后苏醒时间和撤除气管内导管时间没有明显差异性;两组患者在麻醉相关并发症也没有显著性差异。
手术创伤能激活患者的外周伤害性感受器,通过传递痛觉的感觉神经传入中枢;另外疾病和创伤诱发的炎症反应也能协同疼痛反应对机体产生伤害。阿片类药物在麻醉中的作用是镇痛和抗伤害性刺激,阿片药物能有效抑制伤害性刺激造成的应激反应[3]。本研究显示,阿芬太尼和芬太尼能有效抑制术中刺激引起的应激反应,所有患者均安全地接受了手术治疗。阿片受体广泛分布,在脑内、丘脑内侧、脑室及导水管周围灰质阿片受体密度高,这些结构与痛觉的整合及感受有关。在脊髓胶质区、三叉神经脊束尾端核的胶质区也有阿片受体分布,这些结构是痛觉冲动传入中枢的重要转换站,影响着痛觉冲动的传入[4]。阿片受体人体内至少存在8种亚型。在中枢神经系统内至少存在4种亚型,阿芬太尼和芬太尼高选择性作用于μ-阿片受体,通过一系列传导途径而引起膜电位超极化,使神经递质释放减少,从而阻断神经冲动的传递而产生镇痛等各种效应[5]。
在麻醉手术过程中,具有代表性的刺激主要表现为气管内插管、切皮刺激、手术探查刺激等,本研究中在这几个节点患者血压心率均有一定程度的升高,显示即使在麻醉状态下机体仍然能在一定程度上对伤害性刺激产生反应。但是这些反应都在正常范围内,没有产生严重的高血压和心动过速,这也再次支持麻醉手术过程中充分镇静镇痛的必要性,同时也证明本研究中两组患者的麻醉镇痛强度合适而有效。
阿芬太尼和芬太尼同属选择性μ-阿片受体激动剂,都属于强效的麻醉性镇痛药。有文献显示阿芬太尼应用于无痛结肠镜检查麻醉效果优越。还有研究显示,阿芬太尼能有效缓解心肌缺血诱发的疼痛且效果优于吗啡。一项研究[6]探索了阿芬太尼对气管内插管反应的抑制,结果显示在合并硫喷妥钠和罗库溴铵全身麻醉诱导中,需要达到40 μg·kg-1阿芬太尼才能达到有效抑制气管插管反应。本研究中在合并丙泊酚、咪达唑仑和罗库溴铵时,25 μg·kg-1阿芬太尼即可达到较满意的麻醉效能,这可能和研究人群、合并用药以及血压波动评判标准等的差异有关。
在本研究中阿芬太尼组患者气管内插管在气管内插管后0 min和1 min时血压低于芬太尼组,但是两组患者在气管内插管后3min血压最大变化率两组比较差异无统计学意义,心率的比较也没有明显差异。这一结果支持阿芬太尼更能有效抑制患者在全身麻醉诱导期期对气管内插管的应激反应。手术方式为腹腔镜的受试者阿芬太尼组(49例)和芬太尼组(47例),两组比较没有统计学差异。根据临床经验我们知道腹腔镜手术相对于非腹腔镜手术,手术创伤较小,阿片类药物使用相对较小,因考虑到两组的腔镜手术和非腔镜手术构成比相同,而阿片类药物术中维持会根据手术刺激、生命体征变化给予相应的调整,必要时加用血管活性药物,所以本研究并未对两组患者进行分层比较,但这也是本研究统计上相对不足之处。在手术开始后,虽然手术切皮后5 min时两组患者血压心率变化没有差异性,但是在术中多个时点的观察数据显示阿芬太尼组患者的血压和心率都明显低于芬太尼组,这再次支持阿芬太尼能更好的抑制术中创伤性应激反应。
有文献[7]显示,在冠状动脉搭桥手术中接受阿芬太尼和芬太尼的患者在苏醒时间无显著差异,但是在气管导管撤除时间芬太尼组比阿芬太尼组明显延长,药代动力学参数也显示t80(停药后血浆药物浓度降低80%时间) 芬太尼组比阿芬太尼组明显延长,但是T50(停药后血浆药物浓度降低50%时间)两组比较没有差异性。麻醉苏醒时间和拔出气管导管的时间是两个反映受试者自麻醉中恢复至清醒和自主生理功能速度的很好指标,这一指标能很好地反映阿片类药物应用于全身麻醉时的恢复速度,尤其是合并使用的其他药物更加短效(如丙泊酚、七氟烷等)时更显优势。本研究显示阿芬太尼组和芬太尼组患者在苏醒时间和气管导管撤除时间均没有统计学差异性。这说明阿芬太尼单次注射的半衰期虽然短于芬太尼,苏醒时间也明显短于芬太尼,但是在较长时间输注阿芬太尼维持麻醉时患者的苏醒时间并不比芬太尼缩短。其原因可能和阿芬太尼的代谢特征有关,有研究显示阿芬太尼长时间输注以后输注即时半衰期时间明显延长。因此,阿芬太尼连续输注的药物浓度调控应该得到更多的探索,以充分利用其短效可控的优势。
本研究的局限性在于未设计多剂量条件下芬太尼和舒芬太尼的麻醉效应,希望以后有研究能探索。
综以上,阿芬太尼与芬太尼都能提供完善的镇痛效应,均可以安全用于外科手术的全身麻醉。两者相比较,阿芬太尼对于气管内插管和手术创伤引起的应激反应具有更强抑制作用,但是麻醉复苏时间没有明显统计学差异。
