丹酚酸B、人参皂苷Rg1及三七皂苷R1对氧糖剥夺/复氧复糖损伤星形胶质细胞的保护作用
2022-10-14曹玉爽杜鑫苑郭莉琛柴丽娟胡利民
杨 娟,曹玉爽,徐 耀,杜鑫苑,张 彤,郭莉琛,袁 庆,柴丽娟,胡利民
(天津中医药大学中医药研究院、天津市中药药理学重点实验室、方剂学教育部重点实验室,天津 301600)
缺血性脑卒中损伤的生理病理过程复杂多样,主要涉及细胞凋亡、氧化应激、细胞内钙离子超载等,这些机制发生在不同时期,但又相互联系,最终引发缺血中心区域组织的不可逆损伤[1]。星形胶质细胞约占脑胶质细胞的一半,是胶质细胞中最丰富的亚型,对成人中枢神经系统的功能至关重要,执行多种功能,如维持正常的脑功能,形成血脑屏障,控制和支持神经元,循环神经递质,以及与其他细胞通信[2],因此研究星形胶质细胞具有重要的意义。
丹参三七是临床上常用的药对,目前在预防和治疗心脑血管疾病中使用较为频繁,Sal B是丹参水溶性酚酸类成分[3],研究表明其抗脑缺血/再灌注损伤作用机制主要为血流动力学的改善、氧化损伤减轻;改善能量代谢障碍、减轻脑部水肿;维持血脑屏障完整性等[4]。Rg1和R1均是三七总皂苷类成分,具有广泛的药理活性,可改善急性缺血性脑卒中后血脑屏障通透性,减少脑梗死体积和神经功能缺损等[5-6]。课题组前期研究结果显示,Sal B、Rg1、R1可透过血脑屏障且在脑脊液中含量较高,故在本研究中建立氧糖剥夺/复氧复糖(OGD/R)模型在体外模拟缺氧缺血损伤,探讨Sal B、Rg1、R1能否通过降低氧化应激反应和钙离子超载,发挥保护星形胶质细胞的作用,从而进一步提高星形胶质细胞神经营养因子的释放。
1 材料与方法
1.1 实验动物24 h内新生Wistar乳鼠,雌雄均可,购于北京维通利华实验动物技术有限公司,使用许可证号:SCXK(京)2016-0006。
1.2 药品与试剂丹酚酸B(salvianolic acid B,Sal B),生产批号:18062901;人参皂苷Rg1(ginsenoside,Rg1),生产批号:18071601;三七总皂苷R1(notoginsenoside,R1),生产批号:18020908;以上药物均由成都菲普德生物科技有限公司提供,产品纯度≥98%。L-谷氨酰胺、胎牛血清(美国Gibco公司)。BCA试剂盒(北京索莱宝科技有限公司)。Anti-GFAP(美国Abcam公司)、Anti-PI3K/p-PI3K、Anti-AKT/p-AKT、Anti-STAT3/p-STAT3(美国CST公司)。CCK-8试剂盒(日本同仁化学研究所)。Servicebio®RT First Strand cDNA Synthesis Kit(武汉赛维尔生物科技有限公司)。SYBR GREEN PCR master Mix(美国Applied Biosystem公司)。Tetramethylrhodamine(TMRM)、CM-H2DCFDA(美国Invitrogen公司)、Fluo-3,AM(凯基生物)。
1.3 仪器CO2恒温培养箱(美国Thermo公司);倒置相差显微镜(美国Zeiss公司);缺氧小室(加拿大STEMCELL Technologies);倒置荧光显微镜(美国BioTek公司);实时荧光定量PCR仪(美国BIO-RAD公司);流式细胞仪(美国,BD,FACS Calibur);Western blot凝胶成像系统(美国GE公司)。
1.4 方法
1.4.1星形胶质细胞分离、培养及鉴定 星形胶质细胞原代培养参考汤婷婷等[7]方法,取5只Wistar大鼠乳鼠,75%乙醇浸泡消毒处死,无菌条件下眼科剪打开颅骨取出全脑,置于预冷的D-Hanks中去除脑膜。而后用含5%青霉素-链霉素的D-Hanks)浸泡2次,2 min/次。眼科剪剪碎组织成1 mm3的乳糜状,加入浓度为0.25%的胰酶5 mL,37 ℃、90 r·min-1条件下恒温震荡消化10 min。加入5 mL培养基(15% FBS+1%青霉素-链霉素+1% L-谷氨酰胺+ 83% DMEM/F12)终止消化,混匀。1 000 r·min-1离心,10 min。加10 mL培养基重悬,过200目筛网。再次离心、重悬,接种细胞于75 cm2培养瓶,CO2培养箱5% CO2、37 ℃培养1 h后,将上层培养基转移至新的细胞培养瓶中,每3 d换液1次,待细胞融合后将细胞培养瓶放在摇床上260 r·min-1转速下震摇20 h,弃去原培养基,D-Hanks洗涤细胞两次,加入浓度为0.25%的胰酶消化,传代备用。在倒置相差显微镜下观察细胞形态并用免疫荧光鉴定法对其进行纯度鉴定(胶质纤维酸性蛋白,GFAP)。
1.4.2OGD/R模型的建立及分组 将细胞种于96孔板中,待细胞生长至融合时,根据魏爱宣等[8]的实验方法进行细胞OGD/R造模。
对照组(con)将原培养基置换为新配制的DMEM/F12培养基,放于CO2培养箱5% CO2、37 ℃培养,4 h后换为血清浓度减半的培养基培养24 h;模型组将原培养基置换为EBSS平衡盐溶液,置于缺氧小室中,通入95% N2、5% CO2气体,5 min后放恒温摇床(37 ℃)培养4 h,而后从缺氧小室中取出细胞,将EBSS平衡盐溶液置换为血清浓度减半的培养基,放在CO2恒温培养箱24 h;给药组在模型组的基础上,复氧时换为含有Sal B、Rg1或R1的血清浓度减半的培养基,根据课题组前期研究及北京中医药大学相关的研究[9],在此我们选择的给药浓度为10 μmol·L-1。
1.4.3CCK-8测定细胞活力 将星形胶质细胞按1×105个/ cm2密度接种于96孔板中,置于CO2培养箱培养,待细胞长至融合后,分别将原培养基置换为含有10 μmol·L-1Sal B、Rg1、R1的培养基继续培养,24 h后弃去细胞培养基,100 μL DMEM(含10% CCK-8)孵育30 min,酶标仪450 nm波长处检测吸光度。
Sal B、Rg1及R1对OGD/R星形胶质细胞活力的影响同前,按照“1.4.2”处理方法对细胞进行OGD,复氧时将细胞培养基置换为含有10 μmol·L-1Sal B、Rg1或R1的血清浓度减半的培养基。24 h后弃去原培养基,CCK-8检测细胞活力。
1.4.4流式细胞术检测星形胶质细胞ROS的释放量、线粒体膜电位和钙离子浓度 将星形胶质细胞按1×105个/cm2密度接种于6孔板中,按照“1.4.2”所述进行分组处理,PBS洗涤细胞,分别加入100 nmol·L-1TMRM工作液,5 μmol·L-1CM-H2DCFDA工作液和0.25 μmol·L-1Fluo-3,AM工作液37 ℃避光孵育30 min,胰酶消化,将细胞收集于离心管中,流式细胞仪测定细胞ROS的释放量,线粒体膜电位和钙离子浓度。
1.4.5RT-PCR法测定星形胶质细胞IGF1a、BDNF、NGF mRNA的表达 将星形胶质细胞按1×105个/cm2密度接种于6孔板中,按照“1.4.2”所述进行分组处理,用预冷的PBS洗涤细胞,TRIzol®reagent试剂盒提取总RNA,超微量核酸分析仪测定RNA样品浓度,采用Servicebio®RT First Strand cDNA Synthesis Kit试剂盒逆转录合成cDNA,按照SYBR GREEN PCR Master Mix试剂盒说明书步骤依次加入反应物,在Real Time PCR仪上检测各样本基因表达,将mRNA水平标准化为GAPDH水平,用2-△△Ct法计算相对表达水平。
1.4.6Western blot法测定星形胶质细胞p-PI3K、p-AKT、p-STAT3蛋白的表达 将星形胶质细胞按1×105个/cm2密度接种于6孔板中,按照“1.4.2”所述进行分组处理,弃去培养基,用PBS洗涤细胞,加入100 μL细胞裂解液(含1% PMSF)提取总蛋白并进行蛋白定量;将10 μg样品加到聚丙烯酰胺凝胶电泳上进行分离,采用湿转法将目的蛋白转至PVDF膜上,用脱脂奶粉5%封闭,分别加入p-STAT3(1 ∶1 000)、STAT3(1 ∶1 000)、p-PI3K(1 ∶1 000)、PI3K(1 ∶1 000)、p-AKT(1 ∶1 000)、AKT(1 ∶1 000)抗体,4 ℃孵育过夜;用TBST洗涤条带4次,5 min/次,而后加入二抗(1:10 000),室温摇床孵育1 h,洗涤后用ECL化学显色试剂在显影仪中曝光,通过ImageJ处理系统分析目的蛋白条带灰度值并计算相应蛋白表达量。
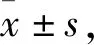
2 结果
2.1 星形胶质细胞形态学观察及鉴定如Fig 1,光镜下观察培养7 d的星型胶质细胞,形状主要为不规则多角形,可见粗短枝状胞突,胞体大而扁平,符合神经胶质细胞生长特性;胶质细胞特异性蛋白GFAP免疫荧光染色呈阳性,表明纯度较高的原代星形胶质细胞培养成功,可以用于后续实验。

Fig 1 Left:Astrocyte morphology under light microscope,bar=100 μm.Right:Immunofluorescence identification of astrocytes (GFAP),bar=200 μm
2.2 Sal B、Rg1、R1对星形胶质细胞活力的影响如Tab 1所示,与con组比较,Sal B、Rg1、R1(10 μmol·L-1)对正常星形胶质细胞活力差异均没有显著性(P>0.05),表明实验所选药物浓度对细胞没有毒性。OGD/R组星形胶质细胞活力与con组比较明显降低(P<0.05);与OGD/R组比较,Sal B、Rg1、R1(10 μmol·L-1)均能明显提高OGD/R受损胶质细胞的活力(P<0.05),表明选择的10 μmol·L-1可以用于后续实验。

Tab 1 Effects of Sal B,Rg1,R1 (10 μmol·L-1) on viability of
2.3 Sal B、Rg1、R1对OGD/R损伤星形胶质细胞ROS释放量的影响脑缺血发生后,损伤的星形胶质细胞释放大量ROS,H2O2是其主要成分,具有不带电荷、稳定以及可自由弥散等特点,可以任意穿过细胞膜,进一步导致损伤,本研究通过检测星形胶质细胞中ROS的产生来评估氧化损伤,如Fig 2所示,OGD/R组细胞ROS释放量较con组明显增加(P<0.05);与OGD/R组相比,Sal B、Rg1(10 μmol·L-1)均可明显降低OGD/R损星形胶质细胞ROS的释放量(P<0.05),表明Sal B、Rg1(10 μmol·L-1)可以减轻星形胶质细胞的氧化损伤。
Fig 2 Effects of Sal B,Rg1,R1 (10 μmol·L-1) on ROS of astrocytes injured by OGD/R detected *P<0.05 vs con;#P<0.05 vs OGD/R.
2.4 Sal B、Rg1、R1对OGD/R损伤星形胶质细胞线粒体膜电位的影响线粒体膜电位可以影响线粒体中钙离子的摄取,是细胞主要钙离子调节器,细胞内线粒体膜电位升高会导致钙离子浓度增加,钙超载线粒体和后续功能障碍诱导细胞死亡。本研究中用流式细胞术检测了细胞线粒体膜电位,结果如Fig 3所示,与con组相比,OGD/R组星形胶质细胞线粒体膜电位降低(P<0.05);与OGD/R组相比,Sal B、Rg1、R1(10 μmol·L-1)均可升高OGD/R损伤后星形胶质细胞的线粒体膜电位(P<0.05),表明Sal B、Rg1、R1(10 μmol·L-1)可以抑制损伤星形胶质细胞线粒体膜电位的降低,对细胞发挥保护作用。

Fig 3 Effects of Sal B,Rg1 and R1 (10 μmol·L-1) on mitochondrial membrane potential of OGD/R injured astrocytes detected by flow cytometry *P<0.05 vs con;#P<0.05 vs OGD/R.
2.5 Sal B、Rg1、R1对OGD/R损伤星形胶质细胞钙离子浓度的影响研究进一步对细胞内钙离子浓度进行了检测,如Fig 4,发现与con组相比,OGD/R组星形胶质细胞钙离子浓度明显升高(P<0.05);与OGD/R组相比,Sal B(10 μmol·L-1)可明显降低OGD/R损伤星形胶质细胞钙离子浓度(P<0.05),抑制钙离子超载。
2.6 Sal B、Rg1、R1对OGD/R损伤星形胶质细胞神经生长因子分泌的影响星形胶质细胞分泌的BDNF、NGF、IGF1α对于成年大脑中特定神经元群体的存活,维持和再生很重要,本研究采用RT-PCR方法检测Sal B、Rg1、R1(10 μmol·L-1)对损伤星形胶质细胞神经营养因子BDNF、NGF、IGF1α分泌的影响(Fig 5),与con组相比,OGD/R组细胞BDNF、NGF mRNA表达明显降低(P<0.05),对IGF1α mRNA无明显降低(P>0.05);与OGD/R组相比,Sal B、Rg1、R1(10 μmol·L-1)均可明显升高OGD/R损伤星形胶质细胞BDNF mRNA的表达(P<0.05);Rg1可提高NGF mRNA表达(P<0.05);Sal B可明显升高OGD/R损伤星形胶质细胞IGF1α mRNA表达(P<0.05),发现不同的活性成分对BDNF、NGF、IGF1α mRNA有不同程度的调节作用。

Fig 4 Effects of Sal B,Rg1 and R1 (10 μmol·L-1) on calcium concentration of OGD/R injured astrocytes detected by flow cytometry *P<0.05 vs con;#P<0.05 vs OGD/R.
2.7 Sal B、Rg1、R1对OGD/R损伤星形胶质细胞PI3K、AKT、STAT3蛋白磷酸化的影响现已有研究表明,抑制PI3K/Akt信号通路的激活能增加大鼠的超氧化物歧化酶活性,降低丙二醛水平,降低氧化应激损伤。STAT3缺失的星形胶质细胞产生高水平的ROS,导致细胞死亡增加。本研究探讨了Sal B、Rg1、R1对受损星形胶质细胞PI3K/AKT、STAT3机制的调节。如Fig 6A-B所示,与con组比较,OGD/R组胶质细胞PI3K、AKT蛋白磷酸化水平低(P<0.05),与OGD/R组相比Sal B、Rg1、R1可明显升高p-AKT蛋白的表达(P<0.05)。如Fig 6C所示,与con组相比,OGD/R组STAT3蛋白磷酸化水平降低(P<0.05);与OGD/R组相比,Sal B、Rg1(10 μmol·L-1)能升高OGD/R损伤后STAT3蛋白磷酸化水(P<0.05)。
3 讨论
脑卒中是全球第二大死亡原因,是一种有极高致残率和致死率的脑血管疾病,缺血性脑卒中占比85%[10]。星形胶质细胞数量庞大,约占脑细胞的一半,是胶质细胞中最丰富的亚型[11]。目前,关于星形胶质细胞在脑卒中中的研究越来越多,有望成为治疗脑卒中的重要靶点。

Fig 5 Effects of Sal B,Rg1 and R1 (10 μmol·L-1) on mRNA expression of BDNF,NGF and IGF1α in astrocytes injured by OGD/R )**P<0.01 vs con;#P<0.05,##P<0.01 vs OGD/R.
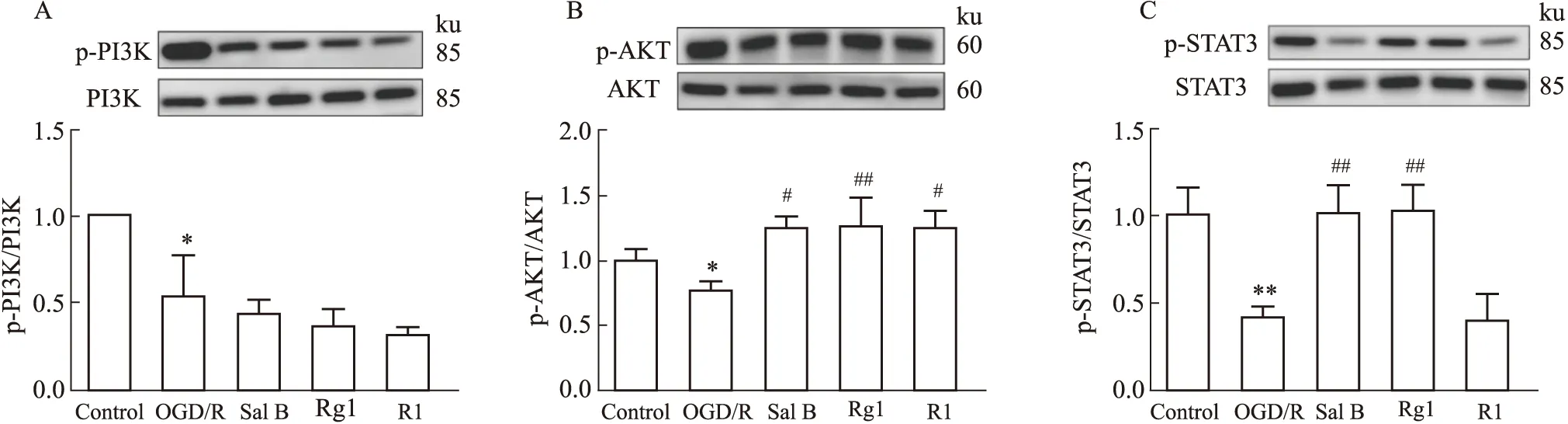
Fig 6 Effects of Sal B,Rg1 and R1 (10 μmol·L-1) on phosphorylation of STAT3,PI3K,AKT protein in astrocytes injured by *P<0.05,**P<0.01 vs con;#P<0.05,##P<0.01 vs OGD /R.
现已有大量关于丹参及三七的研究报道,部分研究关于其活性成分Sal B、Rg1、R1,王国军等[12]研究表明,Sal B可通过减轻缺血/再灌注模型大鼠的神经功能缺损症状,使大鼠脑组织梗死体积减小,提高大鼠脑组织中SOD、CAT、GSH-Px等的活力而起到脑保护作用;林超等[13]通过体外实验证明,Sal B对氧自由基有清除作用,从而发挥抗氧化作用;有研究发现Rg1也可通过提高细胞内抗氧化酶的表达来增强抗氧化能力进而降低ROS的产生和线粒体膜去极化[14];Meng等[15]研究发现,R1可通过抗细胞凋亡和氧化减小脑梗死面积,发挥脑保护作用。以前期研究为基础,我们进一步探讨Sal B、Rg1、R1在受损星形胶质细胞保护方面是否也发挥作用。
STAT3作为ROS重要的调控因子,我们对其进行了研究,发现Sal B、Rg1、R1可以通过STAT3信号通路调控细胞内ROS水平,降低氧化损伤。研究表明,PI3K/AKT信号通路通过磷酸化激活下游相关生存蛋白在神经保护中起着重要作用[16],我们关于Sal B、Rg1、R1对受损星形胶质细胞的保护作用机制也进行了探讨,发现OGD/R可使细胞PI3K、AKT蛋白磷酸化水平降低,Sal B、Rg1、R1可显著提高AKT蛋白磷酸化水平,由于信号通路是一个级联放大的过程,我们推测Sal B、Rg1、R1通过PI3K/AKT信号通路发挥保护星形胶质细胞的作用。本研究发现,Sal B、Rg1、R1通过调节PI3K/AKT、STAT3信号通路降低OGD/R损伤后星形胶质细胞ROS的释放量,降低由ROS升高引起的钙超载及线粒体功能障碍,发挥星形胶质细胞保护作用,增加受损星形胶质细胞神经营养因子的释放,可能进一步对神经发挥保护作用。但是结果显示Sal B和Rg1、R1的作用具有差异性,提示我们不同活性成分可能通过同一或不同的作用途径发挥疗效。
