制药废水活性污泥中高效异养硝化-好氧反硝化菌分离及特性研究
2022-10-14朱研研王耀耀任风芝马岩乔玲张雪霞张鹏王勇军张利利
朱研研 王耀耀 任风芝 马岩 乔玲 张雪霞 张鹏 王勇军 张利利
(华北制药集团新药研究开发有限责任公司 微生物药物国家工程研究中心 河北省工业微生物代谢工程技术研究中心,石家庄 052165)
随着医药工业迅猛的发展,制药废水已成为严重的污染源之一。利用单一的处理技术进行制药废水的处理有一定的局限性,近年来,国内学者将研究重点放在多种技术的优化组合,核心处理以生物方法为主。而生物法中传统的厌氧氨氧化工艺菌倍增时间较长,工艺启动时间长,并且废水中通常不含亚硝酸盐,需与短程硝化工艺相结合。而且厌氧氨氧化过程对废水中的COD比较敏感,COD的存在会滋生大量的异样菌,与厌氧氨氧化菌竞争。所以仅通过厌氧氨氧化无法同时去除废水中的氨氮和COD[1]。
近年来,陆续有同时具有异养硝化好氧反硝化作用的微生物被报道。人们最早从脱硫脱氮污水处理系统中发现具有此特殊性能的菌株Thiosphaera pantotropha[2]。异养硝化好氧反硝化与其他生物脱氮法相比具有很大优势:①可同时去除COD和氨氮,同时在同一个反应器中进行硝化反硝化过程极大节省了占地面积和运行成本[3-4];②菌体生长速率快,易于在系统中留存;③菌株代谢基质和产物的多样性,利于与其他菌株共存,应用范围较广[5];④耐有机负荷,耐溶解氧,脱氮效率高[6]。本文从制药废水活性污泥中,通过富集筛选出具有高效脱氮能力的异养硝化好氧反硝化优势菌株,对纯化株进行分类鉴定确定归属。并根据纯化株生理生化特性,培养特征以及制药废水的特点,对其进行脱氮性能研究,获取了最佳菌剂的脱氮条件。
1 材料与方法
1.1 菌株来源
本实验所获菌株来自于河北石家庄市华北制药集团环保处理活性污泥。
1.2 培养基及试剂
1.2.1 培养基
富集培养基:(NH4)2SO40.5 g/L,琥珀酸钠2.17 g/L,维氏盐溶液50 mL/L。维氏盐溶液:K2HPO46.50 g/L,MgSO4·7H2O 2.50 g/L,NaCl 2.50 g/L,FeSO4·7H2O 0.05 g/L,MnSO4·H2O 0.04 g/L[7]。
异养硝化培养基:(NH4)2SO40.24 g/L,其他成分与含量同富集培养基[7]。
BTB培养基:(NH4)2SO40.27 g/L,L-天冬酰胺1.00 g/L,0.1%溴百里酚蓝酒精溶液5 mL/L,柠檬酸钠8.50 g/L,KH2PO41.00 g/L,MgSO4·7H2O 1.00 g/L,CaCl20.20 g/L,FeCl3·6H2O 0.05 g/L,pH7.0~7.3[8]。
牛肉膏蛋白胨培养基:牛肉膏3.00 g/L,蛋白胨10.00 g/L,NaC1 5.00 g/L,pH7.0~7.2[8]。
1.2.2 主要试剂及仪器
主要试剂及仪器见表1。

表1 主要试剂及仪器Tab.1 Major reagents and instruments
1.3 方法
1.3.1 菌株分离
250 mL三角瓶中装入40 mL富集培养基,121℃灭菌20 min。取4 mL带活性污泥的制药废水转接入富集培养基中,30℃,220 r/min培养48 h后,从中取4 mL培养液继续转接新的灭过菌富集培养基中,30℃,220 r/min继续培养48 h,期间取样显微观察菌株的生长情况。再从中取4 mL富集培养液转接新的灭过菌的培养基中,30℃,220 r/min培养24 h。将培养液逐级稀释,10-4至10-10的稀释度各取0.1 mL涂布于BTB快速筛选平板上,30℃培养。观察菌落生长情况,从中挑选不同形态且菌落周围有蓝色晕圈的菌落接种于牛肉膏蛋白胨固体培养基,30℃培养成熟后甘油保存于-80℃超低温冰箱中。
1.3.2 菌株分类鉴定
(1)菌株形态及生理生化鉴定 将分离得到的纯化株制成菌悬液稀释后涂布于牛肉膏蛋白胨培养基上,30℃培养24 h,观察菌落形态特征和显微特征。采用细菌鉴定方法[9]进行革兰染色、糖醇发酵、酶反应等试验。
(2)16 SrRNA 测序及系统发育分析 采用通用基因组提取试剂盒(Solarbio)提取纯化株基因组DNA。以通用引物27F(A:5’-AGAGTTTGATCCTGGCTCAG-3’);1492R(B:5’-AAGGAGGTGATCCAGCCGCA-3’)进行16S rRNA扩增。PCR扩增条件:95℃ 5 min,1个循环,95℃1 min,55℃退火1 min,72℃延伸3 min,共30个循环,在72℃后延伸7 min。PCR产物采用DNA回收试剂盒(TaKaRa)回收,与PGEM-T载体连接转入大肠埃希菌感受态细胞,挑选克隆提质粒,采用EcoRI(TaKaRa)酶切鉴定,阳性克隆送金唯智生物科技有限公司测序。测序结果经过BLAST进行相似性比对,用ClustalX[9]进行同源性分析,MEGA6.0[10]中的neighbor-joining法构建系统发育树。
1.3.3 菌株脱氮性能研究及脱氮条件优化
(1)菌株异样硝化好氧反硝化特性研究 将富集分离获得的菌株接入牛肉膏蛋白胨培养基中,30℃,220 r/min培养24 h进行活化。以5%接种量,将上述活化菌液转接入异养硝化培养基中,每250 mL三角瓶装100 mL培养基,30℃,220 r/min培养,于36 h取样检测残余的氨氮以及NO-3-N和NO-2-N的值。(2)菌株异养硝化好氧反硝化脱氮条件优化 以异样硝化培养基为基础,分别考察不同的pH、碳源种类及其含量以及基础氨氮值等因素对氨氮去除的影响。将富集分离获得的菌株接入牛肉膏蛋白胨培养基中,30℃,220 r/min培养24 h进行活化。以5%接种量,将上述活化菌液转接入不同考察因素的培养基中,每250 mL三角瓶装100 mL培养基,30℃,220 r/min培养,于36 h取样检测残余的氨氮,硝酸盐和亚硝酸盐的值。
1.3.4 检测方法
检测方法见表2。

表2 指标检测方法Tab.2 Detection method
2 结果与讨论
2.1 异养硝化好氧反硝化菌富集筛选结果
制药废水活性污泥经过富集培养,BTB平板蓝斑快速筛选,获得相对蓝斑较大且明显的3株菌,分别命名为PWAS17,PWAS21和PWAS34。
2.2 菌株形态特征及生理生化特征
2.2.1 菌株形态特征(图1)
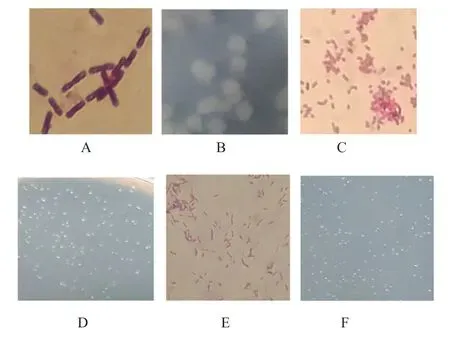
图1 PWAS17、PWAS21和PWAS34 30℃培养24 h显微形态及单菌落图片(油镜观察,10×100倍)Fig.1 Micrographia and colony picture of PWAS17,PWAS21 and PWAS34 at 30℃ culturing 24 h(oil mirror observation,10×100times)
3株纯化菌株在牛肉膏蛋白胨培养基上30℃培养24 h特征为,PWAS17菌落大小约1 mm,圆形隆起,边缘整齐,表面光滑透亮。显微形态短杆,似球状,不产芽胞。革兰染色红色,呈阴性;PWAS21菌落大小为6~7 mm,扁平,表面粗糙,边缘不规则,灰白色。显微形态粗杆,单生或链状生。产芽胞,椭圆或柱形,中生或近中生,不膨大。革兰染色紫色,呈阳性;PWAS34菌落大小约1 mm,圆形隆起,边缘整齐,表面光滑透亮,显微形态细长杆状,不产芽胞。革兰染色红色,呈阴性。
2.2.2 3株菌生理生化特性
3株菌生理生化特性见表3。
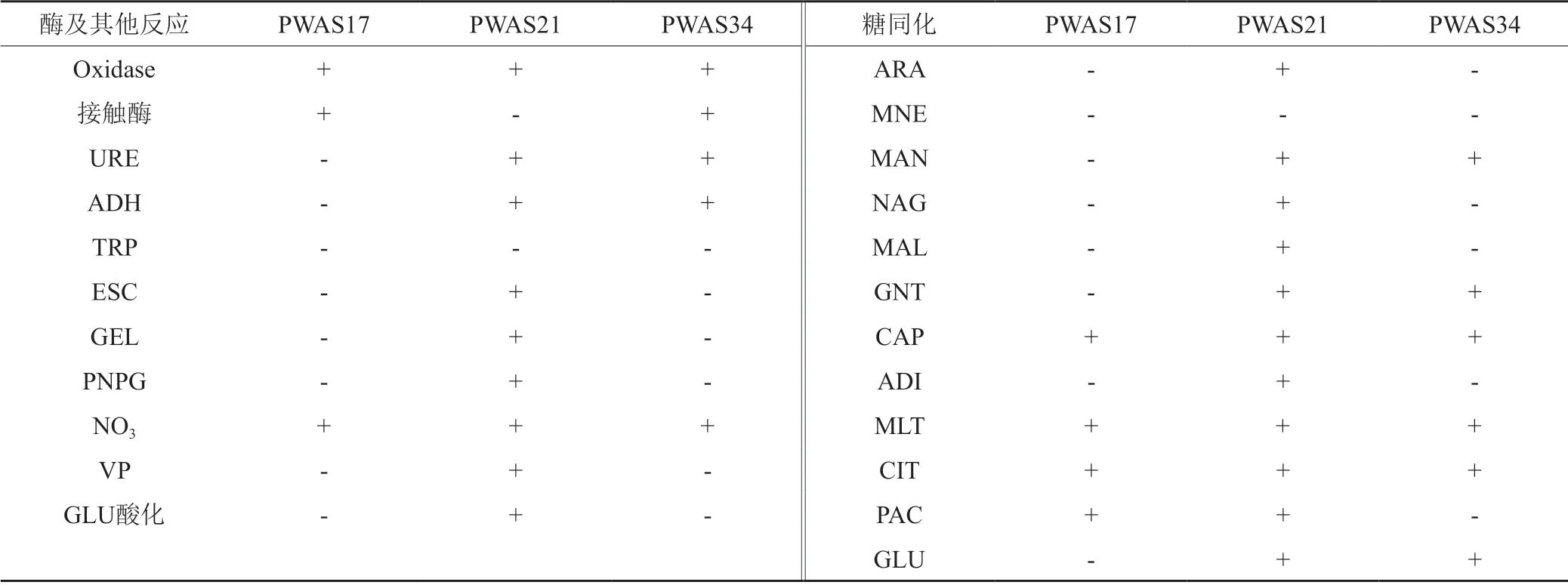
表3 PWAS17,PWAS21和PWAS34生理生化特性Tab.3 Physiological and biochemical characteristics of PWAS17,PWAS21,and PWAS34
2.3 16S rRNA基因序列及系统发育分析
对菌株PWAS17、PWAS21和PWAS34测序获得的部分16S rRNA序列经过BLAST进行相似性比对,用ClustalX[9]进行同源性分析,MEGA6.0[10]中的neighborjoining法构建系统发育树。如图2所示。菌株PWAS17与产碱杆菌属聚为一簇,与水生产碱杆菌Alcaligenes aquatilisLMG 22996同源性达99.58%。菌株PWAS21与Bacillus cereus聚为一簇,与ATCC14579同源性达99.93%。菌株PWAS34与假单胞菌聚为一簇,同斯惠假单胞菌Pseudomonas sihuiensisKCTC 32246同源性最高达99.93%。3株菌分别综合形态特征和生理生化特征,可确定为PWAS17为水生产碱杆菌(Alcaligenes aquatilis),PWAS21蜡状芽胞杆菌(Bacillus cereus),PWAS34为斯惠假单胞菌(Pseudomonas sihuiensis)。
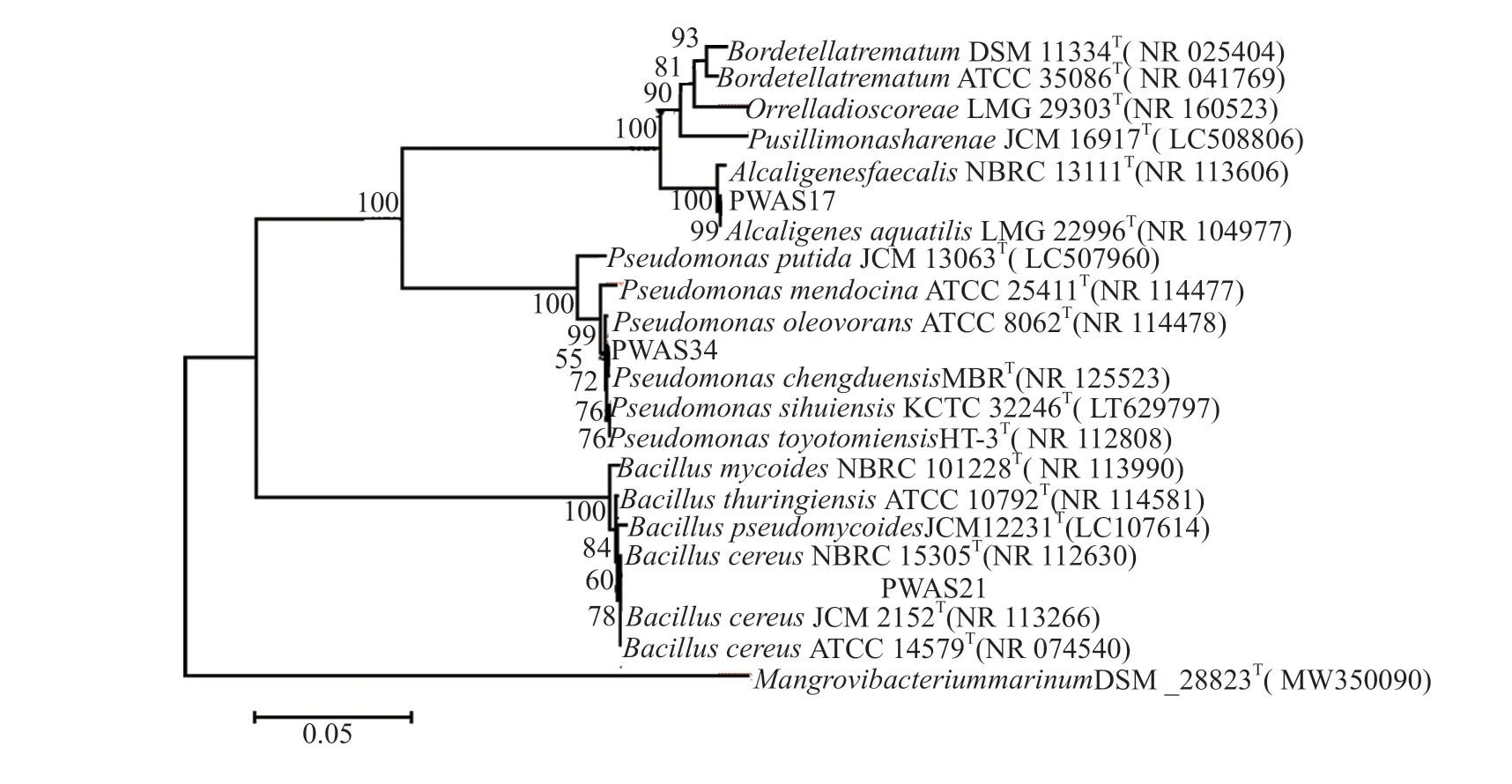
图2 基于16S rRNA基因序列同源性构建的菌株PWAS17,PWAS21和PWAS34系统发育树Fig.2 Phylogenetic tree of strain PWAS17,PWAS21 and PWAS34 based on the sequence homology of 16S rRNA gene
2.4 菌株脱氮性能研究及脱氮条件优化
2.4.1 菌株异养硝化好氧反硝化特性研究
本实验在异养硝化培养基基础上,控制基础NH4+-N值为50.9 mg/L,以葡萄糖控制基础COD为600 mg/L,考察接种量5%(活化菌液A=0.936),30℃,220 r/min培养36 h,3株菌去除NH4+-N和COD的能力以及NO-3-N和NO-2-N的积累情况。结果如表4所示。PWAS17,PWAS21和PWAS34的氨氮去除率分别为73.36%、70.90%和76.86%,COD去除率分别47.92%、87.50%和83.33%。NO-3-N含量分别为0.05 mg/L、0.10 mg/L和0.10 mg/L,NO-2-N含量均为0.01 mg/L。由此可知3株菌均具有去除NH4+-N的能力,同时降解COD,由此可知3株菌具有异养硝化好氧反硝化作用。去除NH4+-N的过程中,几乎无NO-3-N和NO-2-N的积累。
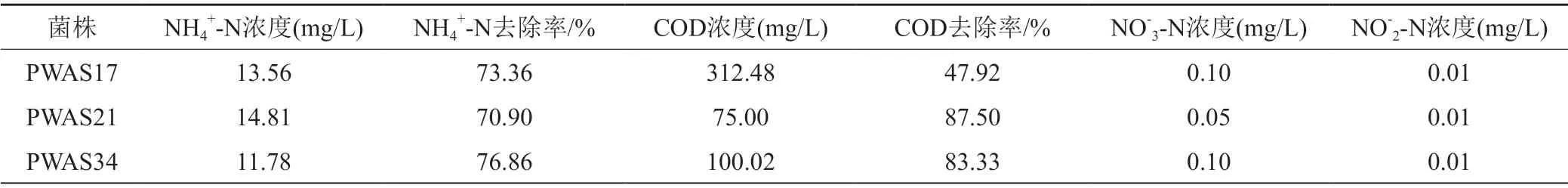
表4 PWAS17,PWAS21 和PWAS34异养硝化好氧反硝化特性Tab.4 Heterotrophic nitrification-aerobic denitrification characteristic of three strains
2.4.2 菌株异养硝化好氧反硝化脱氮条件优化
(1)不同pH对氨氮去除的影响 本实验在异养硝化培养基的基础上,接种量为5%(活化菌液A=0.936),考察pH为5、6、7、7.5、8、8.5、9.0、9.5和10.0时,30℃,220 r/min培养36 h后3株菌NH4+-N去除率的影响。由图3可知,3株菌随着pH的升高有助于NH4+-N的去除,当pH达到9.0时,NH4+-N去除率达到最高。PWAS17达82.36%,PWAS21达75.6%,PWAS34达86.12%。当pH升到9.5后略有往下走的趋势。综合分析,确定3株菌去除NH4+-N最优pH为9.0。
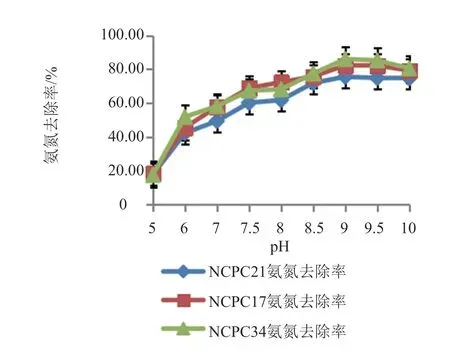
图3 不同pH对3株菌氨氮去除率的影响Fig.3 Effects of pH on the nitrogen removal rate of strain PWAS17、PWAS21 and PWAS34
(2)不同碳源对氨氮去除的影响 本实验在异养硝化培养基的基础上,调最优pH为9.0,接种量为5%(活化菌液A=0.936),30℃,220 r/min培养36 h后琥珀酸钠、乙酸钠、柠檬酸钠、葡萄糖和蔗糖5种不同碳源对3株菌NH4+-N去除率的影响。由图4可知,葡萄糖和蔗糖不利于3株菌的NH4+-N去除,乙酸钠对于PWAS17,PWAS21有促进作用,而对于PWAS34明显不利于NH4+-N的去除。琥珀酸钠和柠檬酸钠均有利于3株菌NH4+-N的去除,尤以柠檬酸钠最为明显,3株菌均达到85%以上,综合成本问题考虑,确定柠檬酸钠为最优碳源。
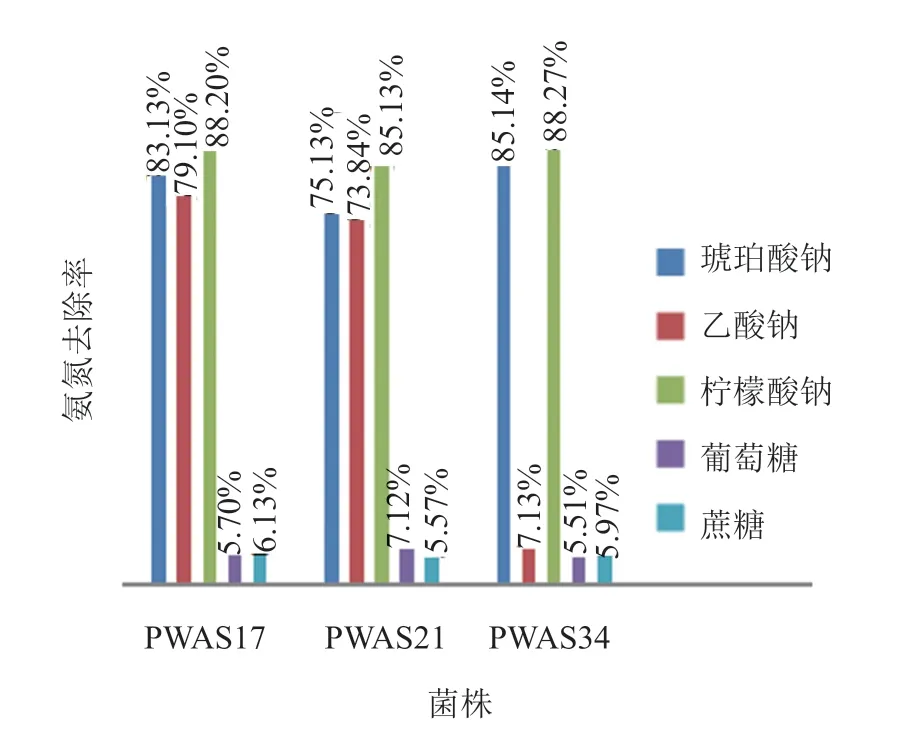
图4 不同碳源对3株菌氨氮去除率的影响Fig.4 Effects of different carbon source on the nitrogen removal rate of strain PWAS17,PWAS21 and PWAS34
(3)碳源不同含量对氨氮去除率的影响 本实验在异养硝化培养基的基础上,接种量为5%(活化菌液A=0.936),调最优pH为9.0,以柠檬酸钠为唯一碳源,分别以(W/V)0.05% 、0.08%、0.1%、0.3%、0.5%、0.8%和1%的柠檬酸钠含量为考察对象,30℃,220 r/min培养36 h后3株菌NH4+-N去除率的影响。由图5可知,随着柠檬酸钠含量的增加,3株菌NH4+-N的去除效率逐渐提升,当含量提高到0.5%~0.8%时达到相对高值,当为0.8%时分别为92.11%、88.64%和92.13%。之后随着柠檬酸钠含量的提高,去除率随之下降。由此,确定最佳碳源量为0.8%。
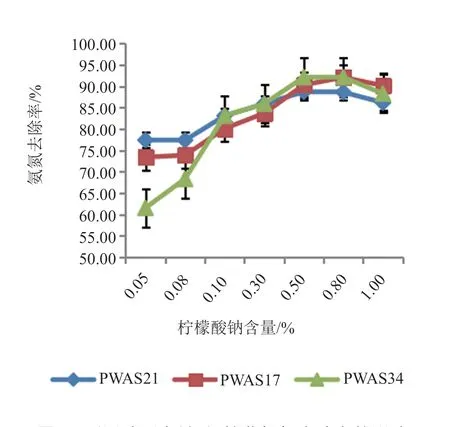
图5 不同碳源含量对3株菌氨氮去除率的影响Fig.5 Effects of the content of carbon on the nitrogenremoval rate of strain PWAS17 and PWAS21
(4)基础NH4+-N浓度对其去除率的影响 本实验在异养硝化培养基的基础上,接种量为5%(活化菌液A=0.936),调最优pH为9.0,以0.8%柠檬酸钠为唯一碳源,220 r/min培养72 h,基础NH4+-N浓度分别为50、100、200、300、400和500 mg/L时对NH4+-N去除率影响。由图6可知当基础氨氮浓度在50~500 mg/L范围内氨氮去除率PWAS17在91.4%上下波动,PWAS21在87.8%上下波动,PWAS34在91.4%上下波动。由此可知,高浓度的基础氨氮浓度对3株菌的去除氨氮能力没有明显的抑制。
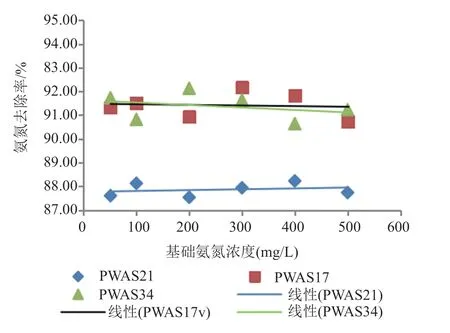
图6 不同基础氨氮浓度对3株菌氨氮去除率的影响Fig.6 Effects of the content of NH4+-N on the nitrogenremoval rate of strain PWAS17,PWAS21 and PWAS34
2.5 讨论
近年来,陆续有同时具有异养硝化好氧反硝化作用的微生物被报道,异养硝化-好氧反硝化 (heterotrophic nitrification-aerobic denitrification,HNAD)菌是一类能够在有机物存在的条件下将氨氮氧化、在溶解氧存在条件下将亚硝态氮、硝态氮代谢为氮气的微生物。最早由Robertson和Kuenen[11]首次发现异养硝化好氧反硝化现象并从脱硫脱氮污水中分离到Thiosphaera pantotropha。近年来,越来越多学者从不同环境中分离筛选到异养硝化好氧反硝化菌株用于各种废水的治理。有报道,研究者从土壤、污水处理反应器海洋等环境中分离到异养硝化好氧反硝化菌株不动杆菌属、假单胞菌属、芽胞菌属以及盐单胞菌属等[12]。但关于Pseudomonas sihuiensis和Alcaligenes aquatilis相关报道尚且极少,迄今仅见Hong等[13]于湖泊沉积物表面分离出1株Pseudomonas sihuiensis具有脱氮能力。Alcaligenes aquatilis尚未见报道。本研究是从制药废水活性污泥中,通过富集培养,快速筛选出3株具有异养硝化好氧反硝化菌株,综合菌株培养特征、显微特征、生理生化特性以及16S rRNA 序列分析,将3株菌初步鉴定为Pseudomonas sihuiensis、Alcaligenes aquatilis和Bacillus cereus。通过对其脱氮性能研究,在去除氨氮过程中同时降解COD,同时几乎无硝基氮和亚硝基氮的积累,实现了同步硝化反硝化过程。对其去除氨氮部分条件pH、碳源种类以及含量探索。确定最优pH9.0,0.8%柠檬酸钠为碳源,PWAS17最高达92.1%,PWAS21最高达88.7%,PWAS34最高达92.1%。并考察了基础氨氮浓度50~500 mg/L之间时对其氨氮去除的影响,由结果可知随着基础氨氮浓度的提高,氨氮的去除率并未受到明显影响,由此断定3株菌对基础氨氮浓度具有一定的耐受性。
3 结论
(1)从制药废水中分离筛选出3株高效异养硝化好氧反硝化菌株,分别鉴定为PWAS17水生产碱杆菌(Alcaligenes aquatilis)、PWAS21为蜡状芽胞杆菌(Bacillus cereus),PWAS34为斯惠假单胞菌(Pseudomonas sihuiensis)。
(2)3株异养硝化好氧反硝化菌去除氨氮最佳pH为9.0,最佳碳源为柠檬酸钠,最佳碳源含量为0.8%。脱单能力PWAS17最高达92.1%,PWAS21最高达88.7%,PWAS34最高达92.1%。
(3)3株菌对基础氨氮浓度具有显著耐受性,在50~500 mg/L范围内保持高效脱单能力。在制药废水治理方面具有很广阔的应用前景。
