中药单体成分防治糖尿病心血管并发症研究进展
2022-10-14贺一凡周子烨崖壮举谢运勇刘继平史永恒
贺一凡,周子烨,崖壮举,谢运勇,王 斌, 2,刘继平, 2,史永恒, 2*
中药单体成分防治糖尿病心血管并发症研究进展
贺一凡1,周子烨1,崖壮举1,谢运勇1,王 斌1, 2,刘继平1, 2,史永恒1, 2*
1. 陕西中医药大学药学院,陕西 咸阳 712046 2. 陕西省中医药管理局 中药药效机制与物质基础重点研究室,陕西 咸阳 712046
中药防治糖尿病心血管并发症具有积极的作用,从中提取分离的单体化合物往往具有较好的糖尿病心血管保护作用。主要检索了近5年国内外中药单体成分防治糖尿病心血管并发症的研究文献,整理了常用的有关中药活性单体类化合物,如黄酮类、环烯醚萜类、三萜皂苷类及生物碱类等化合物,综述了其发挥防治糖尿病心血管并发症的药理作用及机制,以期为糖尿病心血管并发症的防治和药物研发提供参考。
中药单体;糖尿病;心血管并发症;黄酮类化合物;环烯醚萜类化合物;三萜皂苷类化合物;生物碱
糖尿病是以高血糖为主要特征的糖、蛋白质和脂肪代谢障碍性疾病,易导致眼、心、脑、肾、足等多器官急慢性并发症,其中心血管并发症是导致糖尿病患者伤残、死亡的主要原因。我国成年人中糖尿病的患病率从2007年的9.7%已上升到2017年的11.2%,达1.56亿人[1],而糖尿病人群发生心血管疾病的风险约为非糖尿病人群的2.5倍[2]。国外研究发现在2型糖尿病患者(type 2 diabetes mellitus,T2DM)中,合并心血管疾病的患者占30%以上[3-4];国内研究发现合并心血管疾病的患者占14.6%[5]。资料显示,国内糖尿病人群中因心血管并发症死亡人数占总死因的43.2%[6]。因此,防治糖尿病心血管并发症是糖尿病治疗的重要目标。中华医学会糖尿病学分会指出严格控制早期糖尿病患者血糖,可降低糖尿病微血管病变、心肌梗死及死亡的发生风险[7],但多项大型的临床研究,如英国糖尿病前瞻性研究、控制糖尿病患者心血管疾病风险性行动、2型糖尿病强化降压研究及退伍军人糖尿病试验研究(veterans affairs diabetes trial,VADT)等发现,在糖尿病中后期严格控制血糖并不能有效减少心血管并发症的发生和改善[8-10]。故依赖单一降血糖作用的降糖药物控制糖尿病心血管并发症是难以实现的,临床上迫切需要具有良好心血管获益的降血糖药物。
二甲双胍是治疗T2DM的基础药物,具有改善血脂水平、保护内皮细胞和心血管的作用。胰岛素增敏剂噻唑烷酮可以改善胰岛素抵抗,有效降低高血糖,且同时可改善脂质代谢紊乱,抗动脉粥样硬化,防治心血管并发症,但其严重的不良反应如肝毒性、心血管不良事件及致癌性限制了该类药物的应用。近年来,市场上出现了具有良好心血管获益的降血糖药物,如钠-葡萄糖协同转运蛋白(sodium-glucose cotransporter 2,SGLT2)抑制剂能有效降低体质量和血压,对高血压[11]、心衰[12]有确切的疗效,但对糖尿病引起的冠心病、心肌梗死、卒中等主要不良心血管事件的疗效依然存有争议[13-14],对肾脏也有不同程度的损伤[15],易引起泌尿系统感染[16]。胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂在糖尿病心血管并发症的保护作用是肯定的,能有效降低心血管不良事件风险[17],并推荐临床使用[18]。二肽基肽酶-4(dipeptidyl peptidase-4,DPP-IV)抑制剂并不会加重糖尿病心血管疾病[19-20],且有一定的防治作用[21]。这几类药物在糖尿病心血管并发症的防治中发挥了重要的作用,但随着糖尿病患病率不断提升,已不能充分满足患者的需求,临床对具有心血管保护作用的降血糖药物的需求不断增加。
中药复方和中药材对糖尿病的治疗是肯定的,且对糖尿病心血管并发症的防治具有积极作用,中药单体成分是其发挥防治糖尿病心血管并发症的主要物质基础,已有研究报道黄酮类、环烯醚萜类、皂苷类化合物及生物碱对糖尿病心血管并发症具有防治作用[22-23]。因此,从中药单体成分中寻找具有心血管保护作用的降血糖化合物是有意义的。本文主要检索了近5年国内外中药单体成分防治糖尿病治心血管疾病的研究文献,探讨了其发挥防治糖尿病心血管并发症的药理作用和作用机制,以期对糖尿病心血管并发症药物的研发提供借鉴和参考。
1 黄酮类化合物
黄酮类化合物泛指2个具有酚羟基的苯环通过中央3碳原子相互连结而成的一系列结构各异的化合物,是许多中药的活性成分,具有多重药理作用。
1.1 黄酮类
黄芩素(1)和黄芩苷(2)是黄芩的有效活性成分,对糖尿病心血管并发症和糖尿病导致的动脉粥样硬化具有较好的治疗作用。体外实验表明,黄芩素和黄芩苷对高糖诱导的人脐静脉内皮细胞损伤模型具有保护作用,可显著减少活性氧(reactive oxygen species,ROS)的生成,抑制核因子-κB(nuclear factor-kappa B,NF-κB)的激活和细胞黏附因子的表达,具有保护血管内皮的功能[24];另有研究表明黄芩苷可抑制ROS的过量产生,以此减轻高糖诱导的胚胎心血管畸形,可成为治疗妊娠期糖尿病的候选化合物[25]。体内实验研究发现黄芩苷能够激活Keap1/核因子2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)/AMP蛋白激酶(AMP-activated protein kinase,AMPK)通路,增加血红素氧合酶-1(heme oxygenase-1,HO-1)、超氧化物歧化酶(superoxide dismutase,SOD)和醌氧化还原酶-1[NAD(P)H quinone dehydrogenase-1,NQO-1]等抗氧化蛋白的表达,从而有效抑制由链尿菌素(streptozotocin,STZ)联合高脂饲料诱导的小鼠糖尿病心肌病(diabetic cardiomyopathy,DCM)心肌肥大和间质纤维化[26]。
1.2 黄酮醇类
槲皮素(3)为具有多种生物活性的黄酮醇类化合物,是银杏、三七、款冬花、侧柏叶、沙棘、山楂等中药的活性成分。槲皮素和獐牙菜苦苷联合用药可有效降低STZ诱导的糖尿病大鼠血糖水平,调节血脂,且能有效提高血清谷胱甘肽(glutathione,GSH)、SOD、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平,降低脂质过氧化物水平[27];研究发现槲皮素可提高心肌组织Nrf2水平,增加下游抗氧化因子HO-1、SOD、GSH水平,从而抑制DCM引起的心力衰竭,改善DCM大鼠的心功能障碍[28-29]。李雪莲等[30]发现槲皮素能显著抑制DCM大鼠炎症小体的激活,明显降低心肌组织中胶原含量,降低白细胞介素(interleukin,IL)-1β和IL-18蛋白表达水平,减少心肌凋亡,改善心功能。
芦丁(4)又称芸香苷,是中药芸香等的主要活性成分。芦丁可以显著降低四氧嘧啶诱导的糖尿病模型大鼠血糖水平,明显提升GSH-Px和SOD的水平,防止脂质过氧化,对糖尿病心血管并发症具有一定的防治作用[31]。Ganesan等[32]发现芦丁可通过调节代谢性酸中毒相关基因水通道蛋白2(aquaporin 2,)、和血管加压素2受体的表达,改善纤维化和代谢性酸中毒来预防糖尿病肾病和心肌病的进展。
1.3 二氢黄酮类
橙皮素(5)是二氢黄酮类典型的代表化合物,是中药陈皮的主要有效成分。研究表明橙皮素可显著降低STZ诱导的糖尿病大鼠血糖水平,有效调节血脂,恢复肝脏葡萄糖代谢酶和抗氧化酶活性,并指出橙皮素是基于自身的抗氧化作用进而增强实验大鼠的抗氧化能力,从而减轻高血糖和血脂异常[33]。Yin等[34]发现橙皮素可显著降低STZ诱导糖尿病大鼠的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)、I型胶原和III型胶原的表达水平,降低糖尿病心肌的胶原沉积水平,抑制糖尿病心肌炎和心肌纤维化,进而抑制糖尿病大鼠心脏重塑、衰减,其机制与阻断NF-κB信号通路有关。
甘草素(6)和甘草苷(7)属于二氢黄酮类化合物,是甘草的有效活性成分。研究表明甘草苷及其苷元甘草素能有效降低高果糖摄入引起的小鼠脂质积累和胰岛素抵抗,降低I型胶原、II型胶原和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达,抑制小鼠心肌纤维化程度,其机制与甘草苷和甘草素抑制心肌纤维化NF-κB和裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路有关[35-36]。
1.4 异黄酮类
葛根素(8)是C-7位被葡萄糖取代的异黄酮类化合物,是葛根的主要活性成分,对糖尿病和心血管疾病具有良好的防治作用。研究表明葛根素可显著降低模型大鼠空腹血糖、血清肌酸激酶、血清肌酸激酶同工酶水平和心肌组织过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)蛋白的相对表达量,从而恢复妊娠期糖尿病大鼠的血糖水平,有效改善心肌损伤[37]。Tan等[38]认为葛根素通过抑制NF-κB/C-Jun氨基末端激酶(C-Jun-terminal kinase,JNK)和细胞外信号调节激酶1/2(extracellular signal regulated kinase 1/2,ERK1/2)通路,进而改善盐敏感高血压模型大鼠的胰岛素抵抗,产生心血管获益的作用。另有研究发现葛根素对T2DM大鼠主动脉有保护作用,其机制与调节NF-κB水平和抑制NADPH氧化酶2(NADPH oxidase 2,NOX2)、NADPH氧化酶4(NADPH oxidase 4,NOX4)及抑制细胞黏附因子的表达有关[39]。
金雀异黄素(9)属于异黄酮类化合物,是槐角、山豆根等中药的活性单体。金雀异黄素可显著降低大鼠血糖、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL)和极低密度脂蛋白(very low density lipoprotein,VLDL)水平,对糖尿病及其心血管并发症具有积极防治作用[40]。在金雀异黄素对1型糖尿病大鼠心肌纤维化的影响及其机制的研究中,发现金雀异黄素可减轻1型糖尿病大鼠心肌纤维化,其机制可能与减少血清肌酸激酶同工酶和乳酸脱氢酶渗漏、抑制炎症反应、抑制转化生长因子-β1(transforming growth factor-β1,TGF-β1)/Smad3信号通路,调节胶原蛋白表达有关[41]。
1.5 查耳酮类
异甘草素(10)是典型的查耳酮类黄酮类化合物,是甘草的活性成分。研究发现异甘草素可通过抑制糖异生、增加骨骼肌中的苏氨酸激酶2(threonine kinase 2,)mRNA、胰岛素受体底物-2(insulin receptor substrate-2,IRS-2)表达和炎症细胞因子水平,改善胰岛素抵抗,并指出异甘草素是控制代谢紊乱疾病如肥胖、胰岛素抵抗和炎症的一种天然候选药物[42]。Sharifa等[43]发现异甘草素能调节Nrf-2/Keap-1/HO-1信号通路,恢复主动脉氧化/抗氧化应激稳态;同时可恢复主动脉内IL-10水平,抑制主动脉内IL-6和TNF-α水平,抑制主动脉内皮素-1(endothelin,ET-1)的表达,进而防止糖尿病导致的心血管损伤。
具有防治糖尿病心血管并发症的黄酮类化合物的化学结构见图1,作用机制见表1。
2 环烯醚萜类及其他萜类
2.1 环烯醚萜类
环烯醚萜类化合物是臭蚁二醛的缩醛衍生物,是植物在生长过程中的代谢产物,易与糖形成糖苷,其代表化合物主要有栀子苷、京尼平苷、京尼平、梓醇等,对糖尿病和心血管并发症具有良好的防治作用。

图1 黄酮类化合物的化学结构
表1 黄酮类化合物防治糖尿病心血管并发症的作用机制
Table 1 Mechanism of flavonoids on prevention and treatment of cardiovascular complications in diabetes mellitus
化学分类单体作用机制文献 黄酮黄芩素抑制NF-κB的激活、抑制过量ROS形成和CAMs表达24 黄芩苷抑制NF-κB的激活、抑制过量ROS;激活Keap1/Nrf2/AMPK通路25-26 黄酮醇槲皮素抗氧化、降低脂质过氧化物;提高Nrf2水平,增加HO-1;抑制炎症小体的激活,降低IL-1β和IL-18水平,减少心肌凋亡27-30 芦丁提升GSH-Px和SOD的水平,防止脂质过氧化;调节AQP2、AQP3和V2R的表达31-32 二氢黄酮橙皮素抗氧化、抗炎,阻断NF-κB信号通路33-34 甘草苷、甘草素抑制心肌纤维化NF-κB和MAPKs信号通路35-36 异黄酮葛根素下调PPARγ蛋白表达;抑制NF-κB/JNK和ERK1/2通路;调节NF-κB和抑制NOX2、NOX437-39 金雀异黄素调血脂;抑制TGF-β1/Smad3信号通路40-41 查耳酮异甘草素增加AKT2 mRNA和IRS-2表达和抑制炎症细胞因子;调节NrF-2/Keap-1/HO-1信号通路,抑制ET-1表达42-43
2.1.1 典型环烯醚萜类 栀子苷(11)是栀子的主要活性成分。向家培等[44]发现栀子苷能显著降低高糖诱导过程中NADPH的活性及丙二醛(malondialdehyde,MDA)的含量,增强SOD活性;Western blotting结果显示,栀子苷能显著抑制高糖诱导下TGF-β、Ac-Smad3及α-SMA的升高,同时明显逆转沉默信息调节因子1(silent information regulator 1,SIRT1)的下调,指出栀子苷可能通过SIRT1介导的TGF-β/Ac-Smad3信号通路及抗氧化应激作用,抑制心脏成纤维细胞的表型转化及胶原的合成。张伟萍等[45]研究发现栀子苷可通过抑制血管过氧化物酶1(vascular peroxidase 1,VPO1)/ ERK1/2信号通路,进而产生对心肌细胞凋亡和心肌损伤的改善作用。
京尼平苷(12)作为栀子的主要成分,在体内易水解失去糖形成京尼平。研究发现京尼平苷可显著改善糖尿病大鼠的全身状况和增加大鼠体质量;降低血糖、MDA和ROS水平,增强SOD、CAT、GSH-Px活性;改善大鼠心功能,降低心肌梗死的病理损伤,并上调Nrf-2和HO-1的表达,表明京尼平苷可通过激活NrF-2/Keap-1信号通路、抑制氧化应激,从而对糖尿病大鼠心肌缺血再灌注损伤产生保护作用[46]。
2.1.2 4-去甲环烯醚萜类 梓醇(13)是环烯醚萜苷类化合物,是地黄的主要活性成分。研究表明梓醇可有效降低糖尿病大鼠的血糖水平、TC和TG,升高高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C),增强SOD、CAT酶活性,降低MDA,恢复氧化酶和抗氧化酶之间的平衡,从而对糖尿病大鼠心血管并发症产生保护作用[47]。Liu等[48]发现梓醇可显著增强四氧嘧啶诱导的糖尿病兔血浆的总抗氧化作用,并有效减少晚期糖基化终末产物(advanced glycation end products,AGEs),抑制炎症反应,减少细胞外基质在血管壁的聚集,对糖尿病导致的动脉粥样硬化具有潜在的防治作用。Zou等[49]指出梓醇可通过核富集转录体1(nuclear enriched abundant transcript 1,Neat1)/miR-140-5p/组蛋白脱乙酰基酶4(histone deacetylase 4,HDAC4)途径发挥对糖尿病小鼠的心脏保护作用。然而另有研究表明梓醇可通过降低TGF-β1的表达,有效延缓高糖高脂饮食联合STZ诱导的DCM大鼠心肌纤维化的发展[50]。
桃叶珊瑚苷(14)为杜仲、车前草、地黄等的主要活性成分。桃叶珊瑚苷具有抗炎、神经保护、降血糖、抗肿瘤等药理活性[51]。在体外抑制甲基乙二醛修饰的AGEs的形成;在糖尿病大鼠体内能够抑制AGEs在心脏、血管、肾脏和视网膜上的蓄积,发挥防治糖尿病心血管疾病的作用[52]。
另外,其他环烯醚萜类化合物也具有降血糖作用,如肉苁蓉中的肉苁蓉苷(15)[53]、马钱子苷(16)[54],龙胆中的龙胆苦苷(17)[55],獐芽菜中獐芽菜苷(18)[56]等,但其对糖尿病引起的心血管疾病的保护作用报道较少。
2.2 其他萜类
芍药苷(19)为来源于芍药科植物芍药根、牡丹根、紫牡丹根的双环单萜类单体。芍药苷可上调心肌组织中B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白表达,下调心肌组织中Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)蛋白的表达,从而调节糖尿病模型大鼠的糖脂代谢,增强其抗氧化能力,抑制其心肌细胞凋亡,改善心肌损伤[57]。
穿心莲内酯(20)是穿心莲的双环二萜类活性单体。研究发现穿心莲内酯能够增加糖尿病大鼠的Nrf2的核积累,增加HO-1的蛋白表达,进而提高心肌抗氧化能力,同时降低NF-κB蛋白磷酸化水平,减少TNF-α、IL-1β、IL-6等炎症因子的mRNA表达,减少心肌细胞凋亡,改善DCM大鼠心肌纤维化和肥厚[58]。
具有防治糖尿病心血管并发症的环烯醚萜类及其他萜类化合物的化学结构见图2,作用机制见表2。
3 三萜皂苷
三萜类皂苷主要分布于豆科、五加科、桔梗科、毛莨科等中草药中,具有广泛的生物活性,如抗炎、抗肿瘤、降血糖、调血脂、防治心脑血管疾病以及免疫调节等作用。
3.1 人参皂苷
人参皂苷是中药人参C. A. Mey.的干燥根及茎的一类活性物质,属于三萜皂苷,具有多重生物活性。
人参皂苷Rb1(21)可以显著改善高糖高脂饮食联合STZ诱导产生的T2DM大鼠的胰岛素抵抗,降低血清TC、TG、LDL-C水平,升高HDL-C水平;明显减少TNF-α和IL-6水平,改善胰岛素抵抗[59]。研究表明人参皂苷Rb1可上调过氧化物酶体增殖物激活受体γ辅激活因子-1α(peroxisome proliferators-activated receptor γ coactivator-1α,PGC-1α)改善糖尿病小鼠心功能,缓解DCM的心脏损伤,其机制与人参皂苷Rb1降低心肌线粒体ROS产生并减少心肌细胞凋亡有关[60]。
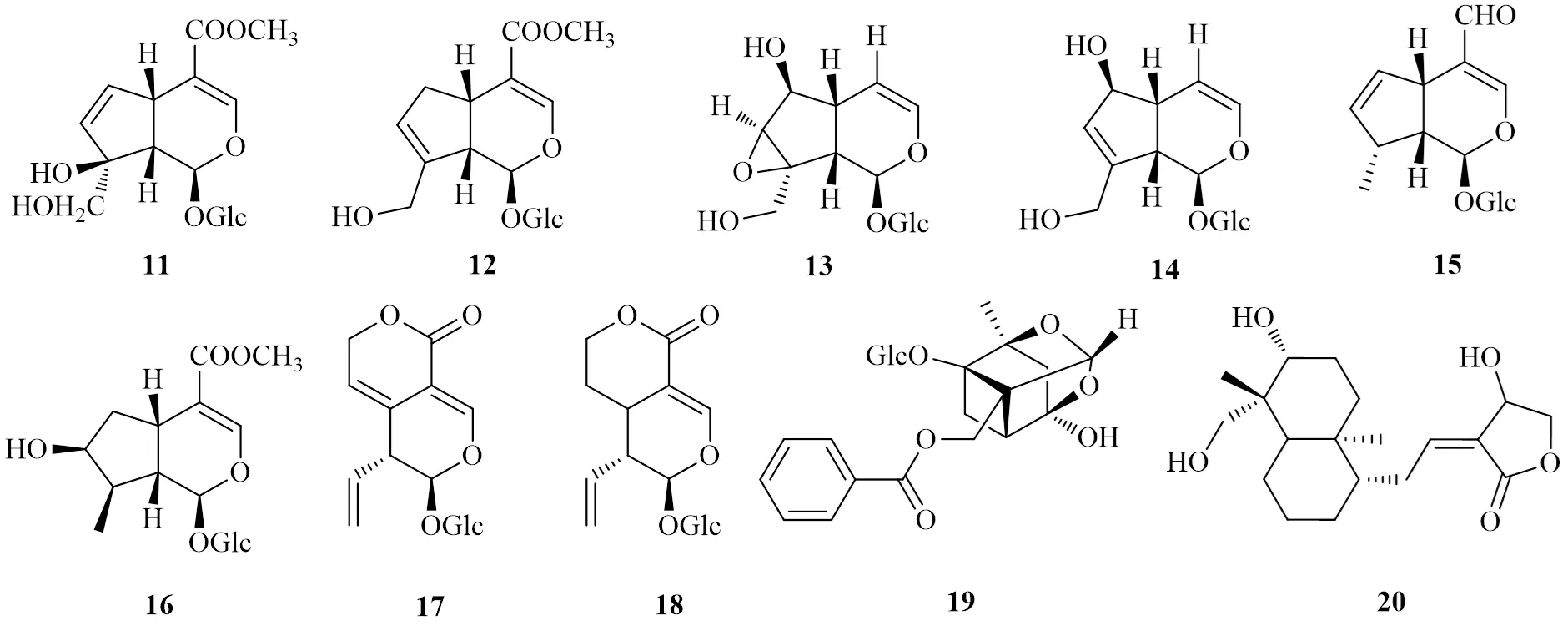
图2 环烯醚萜类及其他萜类化合物的化学结构
表2 环烯醚萜类及其他萜类化合物防治糖尿病心血管并发症的作用机制
Table 2 Mechanism of iridoids and other terpenoids on prevention and treatment of cardiovascular complications in diabetes mellitus
化学分类单体作用机制文献 典型环烯醚萜栀子苷抑制TGF-β/Ac-Smad3信号通路及抗氧化应激;抑制VPO1/ERK1/2信号通路44-45 京尼平苷/京尼平激活NRF2/HO-1信号通路、抑制氧化应激46 4-去甲基环烯醚萜梓醇调血脂,恢复氧化酶和抗氧化酶之间的平衡;降低蛋白羰基和AGEs水平;通过Neat1/miR-140-5p/HDAC4信号通路;降低TGF-β147-50 桃叶珊瑚苷抑制AGEs52 双环单萜芍药苷上调Bcl-2蛋白,下调Bax、Caspase-3蛋白,抗氧化、凋亡57 双环二萜穿心莲内酯激活Nrf2/HO-1信号通路;抑制NF-κB,减少炎症因子58
研究发现人参皂苷Rh2(22)可加强糖尿病心肌纤维化大鼠体内PPAR的活性,抑制信号转导子和转录激活子3(signal transducer and activator of transctiption 3,STAT3)的活化,从而降低糖尿病心肌纤维化结缔组织生长因子和纤连蛋白的表达,从而改善由高血糖引起的心脏功能障碍和心脏纤维化[61]。
人参皂苷Rg3(23)可以通过PPAR受体依赖机制促进巨噬细胞形成M2型,并限制动脉粥样硬化斑块内炎症反应,从而发挥其在防治糖尿病动脉粥样硬化中的潜在作用[62]。
3.2 黄芪皂苷
黄芪甲苷(24)是豆科植物蒙古黄芪(Fisch.) Bge. var.(Bge.) Hisao或膜荚黄芪(Fisch.) Bge.干燥根中的三萜类提取物。李秋芳等[63]研究了当归补血汤对STZ联合高糖高脂饲料诱导的T2DM大鼠动脉粥样硬化的防治作用,并结合网络药理学预测其作用靶点,认为其可能通过NOD样受体家族蛋白3(NOD-like receptor protein 3,NLRP3)/凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)/Caspase-1炎症信号通路改善大鼠糖尿病伴动脉粥样硬化,并认为其中的阿魏酸、黄芪甲苷可能是发挥作用的主要成分;体内研究进一步表明,黄芪甲苷对糖尿病动脉粥样硬化防治作用的机制与下调NLRP3、ASC、Caspase-1蛋白的表达有关[64]。研究发现黄芪甲苷改善了T2DM大鼠心脏收缩和舒张功能,改善了心脏组织病理学改变,可显著改善TC、TG、HDL水平和心脏脂质积累,同时可显著抑制T2DM大鼠TNF-α、IL-6、IL-1β的表达及心肌纤维化,对T2DM大鼠心肌损伤产生改善作用[65]。Zhang等[66]发现黄芪甲苷可通过调节PGC-1、Nrf1的表达,改善DCM引起的心肌线粒体能量代谢异常,抑制细胞凋亡和心肌肥厚,减少DCM引起的心肌损伤。Nie等[67]认为黄芪甲苷通过减少氧化应激和钙蛋白酶-1(calpain-1),增加糖尿病大鼠胸主动脉NO的产生和内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的表达,降低ROS水平,提升SOD和GSH-px活性,进而改善糖尿病大鼠主动脉内皮功能障碍。陈晨等[68]发现黄芪甲苷可剂量相关地降低血糖和乳酸脱氢酶活性,显著增加p-AMPK/AMPK,明显降低磷酸化哺乳动物雷帕霉素靶蛋白(p-mammalian target of rapamyein,p-mTOR)/mTOR,且明显减低心房钠尿肽(atrialnatriureticpeptide,ANP)及脑钠肽(brain-type Natriuretic Peptide,BNP)的蛋白表达,进而改善糖尿病大鼠的心肌肥厚。
3.3 三七皂苷
三七总皂苷能显著降低T2DM大鼠血糖水平,显著降低CD34抗体水平和磷酯酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)蛋白的表达,因此三七总皂苷可能通过下调PI3K/Akt信号通路预防糖尿病大血管病变[69]。
三七皂苷R1(25)是三七(Burk.) F. H. Chen的干燥根及根茎的主要活性成分。Zhang等[70]研究了三七皂苷R1对糖尿病db/db小鼠和AGEs处理的心肌H9c2细胞心脏功能的影响,细胞实验发现三七皂苷R1通过促进雌激素受体α(estrogen receptor α,ERα)的表达来消除ROS,进而激活Akt和Nrf2介导的抗氧化作用,体内研究也证实了这一机制,进而通过抑制氧化应激和细胞凋亡防治DCM心肌纤维化和心肌肥厚。
3.4 其他
甘草皂苷(26)是甘草的三萜类活性成分。甘草皂苷对糖尿病心脏组织具有抗炎作用,可以通过改变氧化应激和炎症来预防心脏损伤,其机制可能与通过激活Nrf2、抑制趋化因子(C-X-C基序)受体4[chemokine (C-X-C motif) receptor 4,CXCR4]/基质细胞衍生因子1(stromal cell-derived factor 1,SDF1)以及TGF-β/p38 MAPK信号通路介导有关[71]。
大豆皂苷A2(27)是豆科植物大豆及其秸秆等植物中的一种三萜类活性化合物。大豆皂苷A1、A2和I能降低血清、肝脏胆固醇、三酰甘油,其中大豆皂苷A2也能降低空腹血糖,改善胰岛素抵抗,对糖尿病心血管并发症可能有积极作用[72]。
积雪草苷(28)是伞形科植物积雪草(L.) Urban.的干燥全草中的单体成分。研究表明积雪草苷可以上调STZ联合高脂喂养的DCM大鼠心肌组织中的mRNA及蛋白表达,进而上调SOD活性,下调MDA的蛋白表达,从而通过抗氧化应激改善DCM,防治心肌纤维化、延缓心脏重构[73]。杨勇等[74]考察了积雪草苷对STZ联合高脂饮食诱导的小鼠糖尿病心肌病干预作用及其机制,发现积雪草苷可能抑制Notch受体1(Notch receptor 1,Notch1)/split多毛增强子1(hairy and enhancer of split 1,Hes1)信号通路、减少心肌细胞凋亡,进而减轻DCM小鼠心肌损伤,减轻心肌纤维化。
具有防治糖尿病心血管并发症的三萜皂苷类化合物的化学结构见图3,作用机制见表3。
4 生物碱
生物碱是自然界中一类含氮的碱性有机化合物,往往具有碱的性质,结构复杂多样,氮原子多嵌在环内,具有显著的生物活性,是中药重要的活性成分。
4.1 异喹啉类生物碱
小檗碱(29)亦称黄连素,是从黄连中分离的一种季铵生物碱,是黄连的主要药效成分。多项研究表明小檗碱可以显著降低高糖高脂饲料联合STZ诱导的糖尿病大鼠血糖水平,同时可以有效调节TC、TG、LDL-C等各项血脂水平,对糖尿病心血管并发症有防治作用[75-76]。霍梦露等[77]发现小檗碱能显著降低T2DM大鼠的肌酸激酶、乳酸脱氢酶、天冬氨酸氨基转移酶含量及心脏质量与体质量比、心脏射血分数和短轴收缩率,进而对DCM大鼠心肌结构和心脏功能的损伤产生保护作用。封芬等[78]发现小檗碱能提高糖尿病大鼠胸主动脉p-PI3K-p85、p-Akt、p-eNOS的表达,进而对T2DM大鼠大血管产生保护作用。芦琨等[79]发现小檗碱可以升高糖尿病大鼠血清中NO、6-酮-前列腺素Fα(6-keto-prostaglandin Fα,6-keto-PGFα)含量,显著降低内皮素(endothelin,ET)和血栓素B2(thromboxane B2,TXB2)及胸主动脉组织和mRNA的表达,从而调节血脂,修复糖尿病大鼠血管收缩与舒张的动态平衡,拮抗动脉粥样硬化,从而对心血管起到一定程度的保护作用。殷文贤等[80]发现小檗碱通过抑制TGF-β1表达,从而抑制T2DM大鼠离体胸主动脉血管平滑肌增殖、迁移,为小檗碱防治糖尿病心血管并发症提供了实验依据。

图3 三萜皂苷类化合物的化学结构
表3 三萜皂苷类化合物的防治糖尿病心血管并发症的作用机制
Table 3 Mechanism of triterpenoid saponins on prevention and treatment of cardiovascular complications in diabetes mellitus
化学分类单体作用机制文献 人参皂苷人参皂苷Rb1调血脂、抗炎;降低ROS产生,减少细胞凋亡59-60 人参皂苷Rh2加强糖尿病大鼠体内PPAR的活性,抑制STAT3的活化61 人参皂苷Rg3通过PPAR受体依赖机制促进巨噬细胞形成M2型62 黄芪皂苷黄芪甲苷调血脂,抗动脉粥样硬化;抑制NLRP3/ASC/Caspase-1炎症信号通路;调节PGC-1蛋白、NRF1的表达;抗氧化;影响AMPK/mTOR通路63-68 三七皂苷三七皂苷R1促进ERα,消除ROS,激活Akt和Nrf2介导的抗氧化作用70 其他皂苷甘草皂苷激活Nrf2,抑制CXCR4/SDF1以及TGF-β/p38 MAPK信号通路71 大豆皂苷A2降低肝脏TC、TG,促进胆固醇、三酰甘油排泄72 积雪草苷上调Nrf2的mRNA及蛋白表达,增强抗氧化租用;抑制Notch1/Hes1信号通路,减少心肌细胞凋亡73-74
巴马汀(30)是防己科植物黄藤Pierre.干燥藤茎中提取得到的生物碱,又称为黄藤素、掌叶防已碱。李端芳等[81]发现巴马汀可激活Nrf2/抗氧化反应元件(antioxidant response element,ARE)/HO-1信号通路,增强抗氧化应激作用,显著降低小鼠血糖、血清TG、TC、糖化血红蛋白(glycosylated hemoglobin,HbA1c)的含量,同时能显著降低血清MDA和ROS的含量,升高SOD和总抗氧化能力(total antioxidant capacity,T-AOC)的含量,进而明显减轻DCM小鼠主动脉内膜增生,减轻小鼠主动脉组织病变程度。
青藤碱(31)是来源于防已科植物青藤(Thunb.) Rehd.et Wils.的根和茎及蝙蝠葛叶DC.的生物碱。Jiang等[82]研究了青藤碱对心血管疾病的防治作用及其机制,发现青藤碱可显著降低TNF-α、IL-1、IL-6水平,促使NF-κB表达降低,NF-κB抑制蛋白(inhibitory protein of NF-κB,IκB)表达增加,从而改善糖尿病大鼠心功能障碍,这可能与NF-κB的失活和炎症细胞因子介导免疫反应的阻断有关。
4.2 西啶类生物碱
苦参碱(32)是从豆科植物苦参Ait.的干燥根、植株、果实中提取的一种生物碱。在苦参碱干预高糖诱导的H9C2心肌损伤细胞实验中,发现苦参碱能明显降低损伤细胞的MDA、p67phox、p-p65、Caspase-3蛋白及、、、mRNA表达和细胞凋亡率,显著增加GSH-Px、CAT的活性和SOD、Bcl-2蛋白及mRNA的表达,因此认为苦参碱通过抗氧化、抗炎和抗凋亡作用来改善心肌细胞损伤[83]。Hou等[84]探讨了苦参碱对STZ诱导DCM大鼠的保护作用及其可能机制,研究结果显示苦参碱能抑制TNF-α和IL-6水平,降低ROS、MDA和TGF-β水平以及PPARβ、PPARγ1活性。Liu等[85]发现苦参碱通过影响活化转录因子6(activated transcription factor 6,ATF6)信号通路,发挥治疗心肌纤维化的作用,改善左心室功能。Wang等[86]通过大鼠体内实验和心肌初代细胞体外实验探讨了苦参碱对AGEs导致的心脏功能障碍的治疗作用及其分子机制,研究发现苦参碱可通过调节心肌兰尼碱受体-2防止心肌细胞凋亡,改善AGEs诱导的心脏功能障碍。
氧化苦参碱(33)也是苦参的干燥根、植株、果实中的一种生物碱。氧化苦参碱能显著降低高糖诱导H9C2细胞中乳酸脱氢酶的外泄,抑制细胞内ROS的产生,显著下调Bax蛋白表达、同时上调Bcl-2蛋白表达,增加Bcl-2/Bax值,抑制下游因子Caspase-3的激活,调节氧化应激从而抑制由高糖引起的H9C2细胞凋亡[87]。Zhang等[88]探讨了苦参碱对糖尿病心肌病模型大鼠和体外离体心肌成纤维细胞的防治作用,发现苦参碱通过抑制糖尿病心肌病模型大鼠中的TGF-β1/Smad信号通路的激活,发挥抗纤维化作用,改善心脏的顺应性和心功能障碍。
4.3 环孕甾烷类生物碱
环维黄杨星D(34)是黄杨科植物小叶黄杨var.M. Cheng及其同属植物中的活性单体成分。环维黄杨星D能够有效改善DCM大鼠的心脏病理损伤、延缓心衰进程,明显提高生存率,其药理作用与血糖控制无关;Western blotting及免疫荧光显示环维黄杨星D能够显著增加Nrf2、NQO-1、过氧化物酶1及微管相关蛋白1轻链3II/I蛋白表达,降低Keap1、p62蛋白表达,表明环维黄杨星D能激动Nrf2通路,抑制氧化应激及提高自噬从而显著延缓糖尿病心肌病心衰进程[89]。
具有防治糖尿病心血管并发症的生物碱类化合物的化学结构见图4,作用机制见表4。
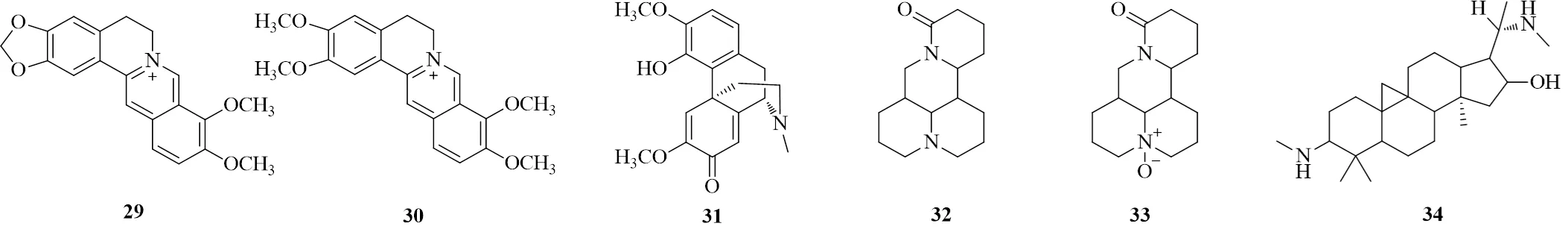
图4 生物碱类化合物的化学结构
表4 生物碱类化合物的防治糖尿病心血管并发症的作用机制
Table 4 Mechanism of alkaloids on prevention and treatment of cardiovascular complications in diabetes mellitus
化学分类单体作用机制文献 异喹啉类生物碱小檗碱调血脂;提高p-PI3K-p85、p-Akt、p-eNOS的表达;降低ET和TXB2及动脉ICAM-1和VCAM-1 mRNA的表达;减少TGF-β1水平75-80 巴马汀激活Nrf2/ARE/HO-1信号通路,增强抗氧化应激81 青藤碱抑制NF-κB的活性,减少炎症细胞因子82 西啶类生物碱苦参碱抗氧化、抗炎和抗凋亡;降低ROS、MDA和TGF-β水平以及PPARβ、PPARγ1活性;调节RyR2介导的钙超载引起的心肌细胞凋亡83-86 氧化苦参碱抗氧化,上调Bcl-2,增加Bcl-2/Bax值,抑制Caspase-3的激活;抑制TGF-β1/Smad信号通路87-88 环孕甾烷类生物碱环维黄杨星D激动Nrf2信号抑制氧化应激及提高自噬89
5 其他
白藜芦醇为蓼科植物虎杖Sieb. et Zucc.、何首乌Thunb.等的干燥根茎和根中提取的芪类化合物。白藜芦醇可降低患者收缩压,显著改善关节活动和心-踝血管指数,同时其还可改善T2DM患者的动脉硬化和减少氧化应激,对糖尿病引起的动脉粥样硬化有较好的防治作用[90]。Yan等[91]发现白藜芦醇可显著降低糖尿病心肌病大鼠的血糖、体质量、血浆三酰甘油水平及炎症因子和氧化应激标志物MDA的水平,并指出白藜芦醇可能通过抑制eNOS和血管内皮生长因子发挥对糖尿病心肌病大鼠的心血管保护作用。
阿魏酸是当归干燥根中的苯丙酸类化合物。徐慧琳等[92]发现阿魏酸通过抗氧化及下调TGF-β1和III型胶原蛋白表达,减小DCM小鼠心脏质量指数和左室质量指数,升高心肌组织SOD活力、减少MDA含量和心肌胶原纤维沉积,发挥防治心功能障碍的作用。
6 结语和展望
在糖尿病发展过程中,脂代谢紊乱[93-94]、AGEs的堆积[95-96]、氧化应激[97]及炎症[98-99]等被认为糖尿病及心血管并发症发生的重要机制。因此如何调血脂、减少AGEs、抗氧化应激和抗炎是防治糖尿病心血管并发症的重要策略。综上可知,黄酮类、环烯醚萜类、皂苷类、生物碱以及芪类等中药单体成分具有降血糖活性,同时可通过抗炎、抗氧化应激、调血脂以及减少AGEs的作用,发挥防治糖尿病心血管并发症的作用(图5)。

图5 中药单体成分防治糖尿病心血管并发症的机制
本文综述了近5年关于中药单体成分防治糖尿病心血管并发症的相关报道,其研究取得了较好进展,但依然存在一些不足之处:(1)一部分中药单体成分防治糖尿病心血管并发症的研究往往限于现象的描述和发现,缺乏对其机制的深入研究;(2)中药单体成分往往已经具有多重药理作用,其在防治糖尿病心血管并发症的作用是否在众多药理活性中显著突出,有待进一步确定;(3)针对此类中药单体成分,通过化学结构改造并进一步评价其糖尿病心血管并发症防治作用的研究较少。鉴于此,提出几点建议供参考:(1)采用计算机数据挖掘和分子对接的模式,对中药单体成分降血糖和心血管保护的共有靶点进行模拟对接,开展分子动力学模拟,对优选的中药单体成分进行药理活性筛选;(2)加大对糖尿病心血管保护活性较好的中药单体成分进行深入研究,明确机制,并将其作为先导化合物开展化学结构改造。
因此,从中药中提取分离有效单体成分,深入研究其防治糖尿病心血管并发症的药理活性和机制,发现先导化合物,并设计新的化合物,这对发现具有防治糖尿病心血管并发症的药物是有指导意义的。
利益冲突 所有作者均声明不存在利益冲突
[1] Li Y Z, Teng D, Shi X G,. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: National cross sectional study [J]., 2020, 369: m997.
[2] Franco O H, Steyerberg E W, Hu F B,. Associations of diabetes mellitus with total life expectancy and life expectancy with and without cardiovascular disease [J]., 2007, 167(11): 1145-1151.
[3] Einarson T R, Acs A, Ludwig C,. Prevalence of cardiovascular disease in type 2 diabetes: A systematic literature review of scientific evidence from across the world in 2007-2017 [J]., 2018, 17(1): 83.
[4] Lautsch D, Wang T T, Yang L F,. Prevalence of established cardiovascular disease in patients with type 2 diabetes mellitus in the UK [J]., 2019, 10(6): 2131-2137.
[5] Ji L N, Hu D Y, Pan C Y,. Primacy of the 3B approach to control risk factors for cardiovascular disease in type 2 diabetes patients [J]., 2013, 126(10): 925.e11-925.e22.
[6] Bragg F, Holmes M V, Iona A,. Association between diabetes and cause-specific mortality in rural and urban areas of China [J]., 2017, 317(3): 280-289.
[7] 中华医学会糖尿病学分会, 中华医学会内分泌学分会. 中华糖尿病杂志 [J]. 中国成人2型糖尿病合并心肾疾病患者降糖药物临床应用专家共识. 2020, 12(6): 369-381.
[8] Nathan D M, Cleary P A, Backlund J Y C,. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes [J]., 2005, 353(25): 2643-2653.
[9] Holman R R, Paul S K, Bethel M A,. 10-Year follow-up of intensive glucose control in type 2 diabetes [J]., 2008, 359(15): 1577-1589.
[10] American Diabetes Association. Standards of medical care in diabetes-2015 [J]., 2015, 38(Suppl 1): S1-S93.
[11] Zinman B, Wanner C, Lachin J M,. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes [J]., 2015, 373(22): 2117-2128.
[12] McMurray J J V, Solomon S D, Inzucchi S E,. Dapagliflozin in patients with heart failure and reduced ejection fraction [J]., 2019, 381(21): 1995-2008.
[13] Zelniker T A, Wiviott S D, Raz I,. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: A systematic review and meta-analysis of cardiovascular outcome trials [J]., 2019, 393(10166): 31-39.
[14] Wiviott S D, Raz I, Bonaca M P,. Dapagliflozin and cardiovascular outcomes in type 2 diabetes [J]., 2019, 380(4): 347-357.
[15] McGill J B, Subramanian S. Safety of sodium-glucose co-transporter 2 inhibitors [J]., 2019, 124(Suppl 1): S45-S52.
[16] Zhou X, Zhou Y Z, Li X M,. Safety concerns of sodium-glucose co-transporter-2 inhibitors in type 1 diabetes: A real-world study from the perspective of the Food and Drug Administration Adverse Event Reporting System [J]., 2020, 22(11): 2204-2206.
[17] Marso S P, Daniels G H, Brown-Frandsen K,. Liraglutide and cardiovascular outcomes in type 2 diabetes [J]., 2016, 375(4): 311-322.
[18] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版) [J]. 中华糖尿病杂志, 2014, 6(7): 447-498.
[19] Green J B, Bethel M A, Armstrong P W,. Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes [J]., 2015, 373(3): 232-242.
[20] Zannad F, Cannon C P, Cushman W C,. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in Examine: A multicentre, randomised, double-blind trial [J]., 2015, 385(9982): 2067-2076.
[21] 王景红, 任健. 西格列汀对2型糖尿病心血管并发症相关因素的影响 [J]. 深圳中西医结合杂志, 2020, 30(22): 164-165.
[22] Clifton P. Do dipeptidyl peptidase IV (DPP-IV) inhibitors cause heart failure? [J]., 2014, 36(12): 2072-2079.
[23] Osadebe P, Odoh E, Uzor P. Natural products as potential sources of antidiabetic drugs [J]., 2014, 4(17): 2075-2095.
[24] Bai L, Li X F, He L,. Antidiabetic potential of flavonoids from traditional Chinese medicine: A review [J]., 2019, 47(5): 933-957.
[25] Wang G, Liang J, Gao L R,. Baicalin administration attenuates hyperglycemia-induced malformation of cardiovascular system [J]., 2018, 9(2): 234.
[26] Li R, Liu Y, Shan Y G,. Bailcalin protects against diabetic cardiomyopathy through Keap1/Nrf2/AMPK-mediated antioxidative and lipid-lowering effects [J]., 2019, 2019: 3206542.
[27] Jaishree V, Narsimha S. Swertiamarin and quercetin combination ameliorates hyperglycemia, hyperlipidemia and oxidative stress in streptozotocin-induced type 2 diabetes mellitus in Wistar rats [J]., 2020, 130: 110561.
[28] Hendrawati A, Akhmad S A, Sadewa A H,. The effect of combination of quercetin and glibenclamide on myocardial nuclear factor erythroid 2-related factor 2 (Nrf2) expression in type 2 diabetic rat [J]., 2017, 16(2): 302-306.
[29] Castillo R L, Herrera E A, Gonzalez-Candia A,. Quercetin prevents diastolic dysfunction induced by a high-cholesterol diet: Role of oxidative stress and bioenergetics in hyperglycemic rats [J]., 2018, 2018: 7239123.
[30] 李雪莲, 李智洋, 李宾公, 等. 槲皮素抑制糖尿病大鼠炎症小体激活并减轻心肌损伤 [J]. 中国病理生理杂志, 2019, 35(8): 1345-1351.
[31] Tanko Y, Salisu A I, Mohammed K A,. Anti-hyperglycaemic effects of rutin on blood glucose, oxidative stress biomarkers and lipid peroxidation in alloxan-induced hyperglycaemic Wistar rats [J]., 2017, 32(1): 91-96.
[32] Ganesan D, Albert A, Paul E,. Rutin ameliorates metabolic acidosis and fibrosis in alloxan induced diabetic nephropathy and cardiomyopathy in experimental rats [J]., 2020, 471(1/2): 41-50.
[33] Jayaraman R, Subramani S, Sheik Abdullah S H,. Antihyperglycemic effect of hesperetin, a citrus flavonoid, extenuates hyperglycemia and exploring the potential role in antioxidant and antihyperlipidemic in streptozotocin-induced diabetic rats [J]., 2018, 97: 98-106.
[34] Yin Y, Xu Y, Ma H,. Hesperetin ameliorates cardiac inflammation and cardiac fibrosis in streptozotocin-induced diabetic rats by inhibiting NF-κB signaling pathway [J]., 2017, 28(1): 223-229.
[35] Zhang Y, Zhang L, Zhang Y,. The protective role of liquiritin in high fructose-induced myocardial fibrosis via inhibiting NF-κB and MAPK signaling pathway [J]., 2016, 84: 1337-1349.
[36] Xie X W. Liquiritigenin attenuates cardiac injury induced by high fructose-feeding through fibrosis and inflammation suppression [J]., 2017, 86: 694-704.
[37] 王湘, 郭玉芳, 王爽, 等. 葛根素对妊娠期糖尿病大鼠心肌损伤的影响 [J]. 中国临床药理学杂志, 2020, 36(17): 2643-2645.
[38] Tan C X, Wang A M, Liu C,. Puerarin improves vascular insulin resistance and cardiovascular remodeling in salt-sensitive hypertension [J]., 2017, 45(6): 1169-1184.
[39] Li W P, Zhao W W, Wu Q,. Puerarin improves diabetic aorta injury by inhibiting NADPH oxidase-derived oxidative stress in STZ-induced diabetic rats [J]., 2016, 2016: 8541520.
[40] Makena W, Hambolu J O, Timbuak J A,. Mormodica charantia L. fruit and Genistein ameliorates type 2 diabetes in rats by preventing lipid accumulation, insulin resistance and enhancing beta cell function [J]., 2020, 19(2): 1303-1310.
[41] Yang R, Jia Q, Liu X F,. Effect of genistein on myocardial fibrosis in diabetic rats and its mechanism [J]., 2018, 17(2): 2929-2936.
[42] Lee Y, Kwon E Y, Choi M S. Dietary isoliquiritigenin at a low dose ameliorates insulin resistance and NAFLD in diet-induced obesity in C57BL/6J mice [J]., 2018, 19(10): 3281.
[43] Alzahrani Sharifa; Said Eman; Ajwah Sadeem,[J]., 2021, 73(2): 193-205.
[44] 向家培, 雷玉华. 栀子苷抑制高糖诱导的乳鼠心脏成纤维细胞向肌成纤维细胞的表型转化 [J]. 中华老年多器官疾病杂志, 2019, 18(9): 699-704.
[45] 张伟萍, 江建军, 陈晓锋, 等. 栀子苷通过抑制VPO1/ERK1/2信号通路减轻糖尿病心肌病大鼠的心肌细胞凋亡 [J]. 中国临床药理学与治疗学, 2021, 26(2): 129-136.
[46] Wang J, Xie D Q, Hong D Q,. Attenuation of Myocardial ischemia reperfusion injury by Geniposide preconditioning in diabetic rats [J]., 2019, 67(2): 35-40.
[47] Zhu H F, Wang Y, Liu Z Q,. Antidiabetic and antioxidant effects of catalpol extracted from(Di Huang) on rat diabetes induced by streptozotocin and high-fat, high-sugar feed [J]., 2016, 11: 25.
[48] Liu J Y, Zheng C Z, Hao X P,. Catalpol ameliorates diabetic atherosclerosis in diabetic rabbits [J]., 2016, 8(10): 4278-4288.
[49] Zou G L, Zhong W L, Wu F,. Catalpol attenuates cardiomyocyte apoptosis in diabetic cardiomyopathy via Neat1/miR-140-5p/HDAC4 axis [J]., 2019, 165: 90-99.
[50] 闫金慧, 邹国良. 梓醇对糖尿病心肌病大鼠心功能及心肌组织TGF-β1表达的影响 [J]. 吉林中医药, 2018, 38(5): 573-575.
[51] Zeng X C, Guo F, Ouyang D S. A review of the pharmacology and toxicology of aucubin [J]., 2020, 140: 104443.
[52] Jung E, Park S B, Jung W K,. Antiglycation activity of aucubinand in exogenous methylglyoxal injected rats [J]., 2019, 24(20): 3653.
[53] Mo F F, Liu H X, Zhang Y,. Anti-diabetic effect of loganin by inhibiting FOXO1 nuclear translocation via PI3K/Akt signaling pathway in INS-1 cell [J]., 2019, 22(3): 262-266.
[54] He C J, Ma L Q, Iqbal M S,.Franch exerts anti-diabetic activity and improves liver injury through IRS/PI3K/AKT signaling pathways in type 2 diabetic db/db mice [J]., 2020, 75: 104204.
[55] 鲁义, 姚嘉茵, 王保, 等. 龙胆苦苷对糖尿病周围神经痛的治疗作用及对AMPK信号通路的影响 [J]. 临床与病理杂志, 2020, 40(12): 3095-3101.
[56] Anyanwu G O, Iqbal J, Khan S U,. Antidiabetic activities of chloroform fraction ofPlanch root bark in rats with diet- and alloxan-induced obesity-diabetes [J]., 2019, 229: 293-302.
[57] 李姗姗, 田春雨, 张国伟, 等. 芍药苷对2型糖尿病模型大鼠心肌损伤的改善作用及机制研究 [J]. 中国药房, 2021, 32(23): 2846-2853.
[58] Liang E S, Liu X, Du Z H,. Andrographolide ameliorates diabetic cardiomyopathy in mice by blockage of oxidative damage and NF-κB-mediated inflammation [J]., 2018, 2018: 9086747.
[59] 朱谋, 巩晓晨, 刘冬阳, 等. 人参皂苷Rb1对改善2型糖尿病大鼠糖脂代谢紊乱的作用 [J]. 食品工业科技, 2022, 43(3): 367-373.
[60] 亓秉超, 胡朗, 邱继欢, 等. 人参皂苷Rb1通过上调PGC-1α缓解糖尿病心肌病 [J]. 现代生物医学进展, 2020, 20(1): 19-23.
[61] Lo S H, Hsu C T, Niu H S,. Ginsenoside Rh2improves cardiac fibrosis via PPARδ-STAT3 signaling in type 1-like diabetic rats [J]., 2017, 18(7): 1364.
[62] Guo M Q, Xiao J, Sheng X,. Ginsenoside Rg3mitigates atherosclerosis progression in diabetic apoE-/-mice by skewing macrophages to the M2 phenotype [J]., 2018, 9: 464.
[63] 李秋芳, 王文恺, 龚曼, 等. 当归补血汤及其活性成分通过NLRP3/ASC/Caspase-1通路调控糖尿病大鼠动脉粥样硬化及网络药理学研究 [J].中成药, 2022, 44(6): 1987-1992.
[64] 葛凡, 王文恺, 朱景天, 等. 黄芪甲苷通过NLRP3炎性小体调节糖尿病动脉粥样硬化早期大鼠血脂及炎症因子的研究 [J]. 南京中医药大学学报, 2021, 37(3): 383-387.
[65] Wang Z Y, Zhu Y F, Zhang Y H,. Protective effects of AS-IV on diabetic cardiomyopathy by improving myocardial lipid metabolism in rat models of T2DM [J]., 2020, 127: 110081.
[66] Zhang Z, Wang J, Zhu Y W,. Astragaloside IV alleviates myocardial damage induced by type 2 diabetes via improving energy metabolism [J]., 2019, 20(5): 4612-4622.
[67] Nie Q, Zhu L P, Zhang L J,. Astragaloside IV protects against hyperglycemia-induced vascular endothelial dysfunction by inhibiting oxidative stress and Calpain-1 activation [J]., 2019, 232: 116662.
[68] 陈晨, 王洪新, 张英杰, 等. 黄芪甲苷通过AMPK/mTOR信号通路改善STZ诱导的糖尿病大鼠的心肌损害 [J]. 中药药理与临床, 2018, 34(3): 80-85.
[69] 杨春宁, 万多, 赵鹏, 等. 三七总皂苷调控PI3K/AKT信号通路预防糖尿病大血管病变的机制 [J]. 中华中医药学刊, 2021, 39(2): 118-121, 270.
[70] Zhang B, Zhang J Y, Zhang C Y,. Notoginsenoside R1protects against diabetic cardiomyopathy through activating estrogen receptor α and its downstream signaling [J]., 2018, 9: 1227.
[71] Thakur V, Alcoreza N, Delgado M,. Cardioprotective effect of glycyrrhizin on myocardial remodeling in diabetic rats [J]., 2021, 11(4): 569.
[72] Xie Q Y, Gu X F, Chen J B,. Soyasaponins reduce inflammation and improve serum lipid profiles and glucose homeostasis in high fat diet-induced obese mice [J]., 2018, 62(19): e1800205.
[73] 金钦阳, 朱勤, 李雪灵, 等. 积雪草苷对糖尿病心肌病大鼠Nrf2的表达及氧化应激的影响 [J]. 心电与循环, 2020, 39(4): 326-332.
[74] 杨勇, 魏东明, 乔锐, 等. 积雪草苷对小鼠糖尿病心肌病的干预作用及机制探讨 [J]. 山东医药, 2021, 61(32): 10-14.
[75] 左秀玲, 朴金龙, 薛丰田, 等. 黄连素对2型糖尿病大鼠血脂调节作用及对IL-6、IL-10及CRP水平的影响 [J]. 陕西中医, 2018, 39(8): 1001-1003.
[76] Chandirasegaran G, Elanchezhiyan C, Ghosh K. Modulatory effects of berberine chloride on lipid profile, oxidant status and insulin signaling molecules in streptozotocin induced diabetic rats [J]., 2019, 34(3): 254-262.
[77] 霍梦露, 王瑞瑶, 李超, 等. 小檗碱对高糖高脂饲料联合链脲佐菌素诱导的糖尿病心肌病大鼠的保护作用 [J]. 中国临床保健杂志, 2019, 22(3): 377-382.
[78] 封芬, 谭安雄, 邓集湘, 等. 黄连素对2型糖尿病大鼠胸主动脉PI3K/Akt/eNOS信号通路的影响 [J]. 中国当代医药, 2018, 25(30): 12-15.
[79] 芦琨, 赫金凤, 常景芝, 等. 小檗碱对糖尿病大鼠心血管的保护作用 [J]. 医药导报, 2018, 37(5): 518-522.
[80] 殷文贤, 赵萌, 吴知桂, 等. 盐酸小檗碱对2型糖尿病大鼠血管平滑肌细胞增殖、迁移的影响 [J]. 重庆医学, 2019, 48(5): 756-759.
[81] 李端芳, 严军, 张克斌, 等. 巴马汀对糖尿病小鼠主动脉的保护作用及机制研究 [J]. 重庆医科大学学报, 2017, 42(11): 1522-1526.
[82] Jiang C, Tong Y L, Zhang D,. Sinomenine prevents the development of cardiomyopathy in diabetic rats by inhibiting inflammatory responses and blocking activation of NF-κB [J]., 2017, 36(1): 65-74.
[83] 胡灿, 唐其柱. 苦参碱对高糖诱导的H9C2心肌细胞损伤的影响 [J]. 中华老年心脑血管病杂志, 2020, 22(2): 180-184.
[84] Hou H J, Zhang Q Q, Dong H W,. Matrine improves diabetic cardiomyopathy through TGF-β-induced protein kinase RNA-like endoplasmic reticulum kinase signaling pathway [J]., 2019, 120(8): 13573-13582.
[85] Liu Z W, Zhang Y, Tang Z G,. Matrine attenuates cardiac fibrosis by affecting ATF6 signaling pathway in diabetic cardiomyopathy [J]., 2017, 804: 21-30.
[86] Wang J K, Tang Z G, Zhang Y,. Matrine alleviates AGEs- induced cardiac dysfunctions by attenuating calcium overload via reducing ryanodine receptor 2 activity [J]., 2019, 842: 118-124.
[87] 杨雪莹, 韩星, 沈祥春. 氧化苦参碱对高糖引起的H9C2细胞氧化应激损伤的影响 [J]. 中国实验方剂学杂志, 2020, 26(11): 113-118.
[88] Zhang Y, Cui L, Guan G C,. Matrine suppresses cardiac fibrosis by inhibiting the TGF‑β/Smad pathway in experimental diabetic cardiomyopathy [J]., 2018, 17(1): 1775-1781.
[89] 蒋朝晖. 环维黄杨星D调控Nrf2信号激活自噬改善糖尿病心肌病实验研究 [D]. 贵阳: 贵州医科大学, 2020.
[90] Imamura H, Yamaguchi T, Nagayama D,. Resveratrol ameliorates arterial stiffness assessed by cardio-ankle vascular index in patients with type 2 diabetes mellitus [J]., 2017, 58(4): 577-583.
[91] Yan F Q, Sun X M, Xu C. Protective effects of resveratrol improve cardiovascular function in rats with diabetes [J]., 2018, 15(2): 1728-1734.
[92] 徐慧琳, 徐郭王君, 姚君, 等. 阿魏酸对糖尿病小鼠心肌病变的影响及其机制 [J]. 中国应用生理学杂志, 2018, 34(3): 238-241.
[93] Femlak M, Gluba-Brzózka A, Ciałkowska-Rysz A,. The role and function of HDL in patients with diabetes mellitus and the related cardiovascular risk [J]., 2017, 16(1): 207.
[94] Wang Y B, Yu Q J, Fan D M,. Coronary heart disease in type 2 diabetes: Mechanisms and comprehensive prevention strategies [J]., 2012, 10(8): 1051-1060.
[95] Vistoli G, de Maddis D, Cipak A,. Advanced glycoxidation and lipoxidation end products (AGEs and ALEs): An overview of their mechanisms of formation [J]., 2013, 47(Suppl 1): 3-27.
[96] Prasad K, Tiwari S. Therapeutic interventions for advanced glycation-end products and its receptor-mediated cardiovascular disease [J]., 2017, 23(6): 937-943.
[97] Vedantham S, Ananthakrishnan R, Schmidt A M,. Aldose reductase, oxidative stress and diabetic cardiovascular complications [J]., 2012, 10(3): 234-240.
[98] Li H, Li H L, Bao Y G,. Free fatty acids induce endothelial dysfunction and activate protein kinase C and nuclear factor-κB pathway in rat aorta [J]., 2011, 152(2): 218-224.
[99] Greenstein A S, Khavandi K, Withers S B,. Local inflammation and hypoxia abolish the protective anticontractile properties of perivascular fat in obese patients [J].2009, 119(12): 1661-1670.
Research progress on prevention and treatment of diabetic cardiovascular complications by traditional Chinese medicine monomer
HE Yi-fan1, ZHOU Zi-ye1, YA Zhuang-ju1, XIE Yun-yong1, WANG Bin1, 2, LIU Ji-ping1, 2, SHI Yong-heng1, 2
1. School of Pharmacy, Shaanxi University of Chinese Medicine, Xianyang 712046, China 2. Key Laboratory of Pharmacodynamics and Material Basis of Chinese Medicine, Shaanxi Administration of Traditional Chinese Medicine, Xianyang 712046, China
Traditional Chinese medicine (TCM) plays a positive role in the prevention and treatment of cardiovascular complications of diabetes. Monomeric compounds extracted from TCM often exhibit good hypoglycemic and cardiovascular protection effects. In this paper, the literatures at home and abroad about TCM monomers on prevention and treatment of diabetic cardiovascular complications in recent 5 years were retrieved. The commonly used active compounds from TCM were sorted out and their structures were classified, such as flavonoids, iridoids, triterpenoid saponins and alkaloids. Furthermore, their pharmacological activities and basic mechanism of action were also reviewed, in order to provide effective reference for prevention and treatment and drug discovery of diabetic cardiovascular complications.
traditional Chinese medicine monomer; diabetes mellitus; cardiovascular complications; flavonoids; iridoids; triterpenoid saponins; alkaloids
R282.710.5
A
0253 - 2670(2022)19 - 6213 - 14
10.7501/j.issn.0253-2670.2022.19.027
2022-05-20
陕西省教育厅专项科研计划项目(21JK0608);陕西省中医药管理局中医药科研项目(2021-ZZ-JC023);陕西中医药大学校级科研课题(2020GP32);陕西省自然科学基础研究计划项目(2019JQ-401)
贺一凡(1999—),女,硕士研究生,研究方向为心脑血管药理学。
史永恒,副教授,博士。E-mail: yhshi@sntcm.edu.cn
[责任编辑 崔艳丽]
