基于UPLC-Q-TOF-MS指纹图谱和分子对接技术筛选藿香正气水抗新冠病毒潜在质量标志物
2022-10-14张雅莉韩建勋图尔荪托合提托合提萨伊普孙兆增张玉松魏海燕肖进进
张雅莉,韩建勋, 2*,图尔荪托合提·托合提萨伊普,孙兆增,宋 薇,张玉松,魏海燕,肖进进
基于UPLC-Q-TOF-MS指纹图谱和分子对接技术筛选藿香正气水抗新冠病毒潜在质量标志物
张雅莉1,韩建勋1, 2*,图尔荪托合提·托合提萨伊普1,孙兆增1,宋 薇1,张玉松3,魏海燕1,肖进进1
1. 谱尼测试集团股份有限公司,北京 100095 2. 谱尼测试集团北京检验认证科学研究院有限公司,北京 100095 3. 北京谱尼医学检验实验室有限公司,北京 100095
基于超高效液相色谱-四极杆-飞行时间串联质谱(UPLC-Q-TOF-MS)指纹图谱和分子对接技术,确定藿香正气水(Huoxiang Zhengqi Shui,HZS)抗新型冠状病毒(SARS-CoV-2)的潜在质量标志物(quality markers,Q-Marker)。对27批HZS样品建立UPLC-Q-TOF-MS指纹图谱,结合化学计量学方法,筛选出HZS的差异性成分;以瑞德西韦为阳性对照,将HZS的差异性成分与SARS-CoV-2主蛋白酶(main protease,Mpro)进行分子对接,进一步确定HZS的潜在Q-Marker。通过建立27批HZS样品的UPLC-Q-TOF-MS指纹图谱,标定了27种共有化合物;结合层次聚类分析(hierarchical clustering analysis,HCA)和主成分分析(principal component analysis,PCA),确定了其中14种共有化合物在27批HZS样品中具有较大的差异性,并鉴定出了橙皮苷、氧化前胡素、新比克白芷内脂、甜橙素、甘草酸、3,5,6,7,8,3′,4′-七甲氧基黄酮、桔皮素、欧前胡素、珊瑚菜素9种差异性化合物;9种差异性化合物的分子对接结果显示,橙皮苷、氧化前胡素、新比克白芷内脂、甘草酸、欧前胡素、珊瑚菜素6种化合物能与SARS-CoV-2 Mpro的活性氨基酸结合,具有抑制SARS-CoV-2 Mpro的潜能,可作为HZS的潜在Q-Marker。将UPLC-Q-TOF-MS指纹图谱、化学计量学分析和分子对接技术交叉使用,确定了HZS的潜在Q-Marker,该方法为药物成分鉴定、同一类药物成分差异性分析,及其功效研究方面提供一定参考。
藿香正气水;质量标志物;UPLC-Q-TOF-MS指纹图谱;分子对接;SARS-CoV-2 Mpro潜在抑制剂预测;橙皮苷;氧化前胡素;新比克白芷内脂;甘草酸;欧前胡素;珊瑚菜素
藿香正气水(Huoxiang Zhengqi Shui,HZS)是由苍术、陈皮、厚朴(姜制)、白芷、茯苓、大腹皮、生半夏、甘草浸膏、广藿香油、紫苏叶油等提取配制而成,具有解表化湿、理气和中的作用,用于外感风寒、内伤湿滞或夏伤暑湿所致的感冒、胃肠型感冒等症[1]。自新型冠状病毒肺炎(corona virus disease 2019,COVID-19)爆发以来,中药治疗发挥了不可或缺的作用,其中藿香正气系列中成药是《新型冠状病毒肺炎诊疗方案(试行第九版)》中医学观察期表现为乏力伴胃肠不适者的推荐用药,现已在抗疫一线初显成效[2-3]。经查证,在国家药品监督管理局备案的HZS产品共有162条记录,且不同HZS产品价格也有很大差异,同规格的产品价格差异可达20倍之多。有文献[4-6]表明,不同厂家的HZS产品质量差异较大。经查询国家药品监督管理局官网,近5年,就有87条HZS违规查处记录,是中成药中的常见风险监控项目。目前,有些厂家为了降低生产成本,采用质量较差的原材料,或以设备简陋、索价低廉的小厂代为提取浓缩[7],这导致了不同厂家HZS的质量差异,从而直接影响了其临床使用中的药物有效性。因此,对HZS进行成分鉴别和成分功效评价,在提高其药物有效性方面具有重大意义。
中药指纹图谱是我国广为接受的中药质量评价方法,可以直观地揭示中药化学特征,从化学信息的角度评价中药质量,用于筛选能够真实反映产品内在品质的标志物[8-11]。目前对于HZS指纹图谱的建立和质量评价研究,主要集中在气相和液相色谱指纹图谱,通过标示HZS特征的共有峰图谱,以评价其均一性和稳定性。例如聂黎行等[12]建立了13个厂家的28批HZS的UPLC指纹图谱,确定了18个共有峰,并采用层次聚类分析(hierarchical clustering analysis,HCA)和主成分分析(principal component analysis,PCA)方法,对指纹图谱进行了模式识别;李红梅等[13]建立了10批HZS气相色谱指纹图谱,确定了16个共有峰。然而液相色谱和气相色谱指纹图谱存在一定的片面性,尚无法实现更为完整全面的质量评价及鉴别目的,且对共有峰的指认较困难。
超高效液相色谱-四极杆-飞行时间串联质谱(UPLC-Q-TOF-MS)将具有高分离度、高灵敏度的液相色谱系统,与能同时提供母离子和碎片离子准确质量数以及元素组成的高分辨质谱有机结合,通过建立指纹图谱,可快速分析和表征中药材复杂成分[14-15]。分子对接技术以结构分子生物学和计算机辅助药物设计相结合的方式,通过将配体与受体进行对接,评价其对接体系的稳定性,筛选与受体活性部位空间和电性特征相匹配的小分子化合物,具有周期短、操作性强等优势,已经逐渐成为中药活性成分筛选的重要手段,广泛应用于中药质量标志物(quality markers,Q-Marker)的筛选过程中[16-19]。有研究表明,藿香正气水中的主要成分包括橙皮苷、甘草酸、欧前胡素、厚朴酚等[5]。其中橙皮苷[20]和甘草酸[21]与新型冠状病毒SARS-CoV-2主蛋白酶(main protease,Mpro)具有较好的结合亲和力,从而对SARS-CoV-2产生一定的抑制作用。因此,为进一步对HZS进行质量评价,明确不同生产厂家HZS的共有物质基础和潜在Q-Marker,提高其质量控制水平,本研究以25个厂家共计27批HZS作为研究对象,建立了HZS的UPLC-Q-TOF-MS指纹图谱,标定了其共有峰并进行化合物表征,通过相似度评价结合HCA和PCA等模式识别方法评价不同厂家的HZS差异性;并选用SARS-CoV-2 Mpro为筛选靶标,与HZS的差异性成分进行分子对接获得抗SARS-CoV-2的潜在活性成分,进一步确定HZS的潜在Q-Marker,为HZS质量评价和有效控制提供科学依据。
1 仪器与材料
1.1 仪器与设备
Xevo G2-XS型超高效液相色谱-四极杆飞行时间串联质谱,美国Waters公司,MassLynx 4.1软件;AB135-S型分析天平(感量0.01 mg)、AB204-S型分析天平(感量0.1 mg),瑞士Mettler Toledo公司;Milli-Q型超纯水系统,美国Millipore公司;有机相滤膜(尼龙),0.22 μm,天津博纳艾杰尔科技有限公司。
1.2 材料与试剂
HZS产品在网上药店进行采购,共收集25个厂家的27个品牌共计27批产品,详见表1。对照品甘草苷(批号111610-201908)、橙皮苷(批号110721-202019)、厚朴酚(批号110729-202015)均购自中国食品药品检定研究院,质量分数均≥98%;对照品甘草酸(批号C0008456)、欧前胡素(批号B0002871)均购自曼哈格检测技术股份有限公司,质量分数均≥98%。乙醇、乙腈,色谱级,美国Fisher Scientific公司;甲酸,美国Acros公司,质量分数98%;水为自制超纯水。
表1 27批HZS样品信息
Table 1 Information of 27 batches of HZS samples
样品编号厂家品牌生产批号 S1云南白药集团股份有限公司云南白药WTEB2102 S2云南万裕药业有限公司葵花210004B S3云南裕丰药业有限公司万通200001A S4云南楚雄天利药业有限公司健之佳20200876 S5云南裕丰药业有限公司东盛友邦200002D S6云南腾药制药股份有限公司腾药20201221 S7广东一力罗定制药有限公司好立康210705 S8广西灵峰药业有限公司金鸡20042902 S9漳州片仔癀药业股份有限公司片仔癀2006038 S10四川彩虹制药有限公司康森210504 S11四川天府康达药业集团有限公司府庆210704 S12四川泰华堂制药有限公司泰华堂210516 S13四川依科制药有限公司蜀中210612 S14四川省通园制药集团有限公司育林200510 S15四川泰华堂制药有限公司正远210607 S16四川德元药业集团有限公司德辉210415 S17四川禾邦旭东制药有限公司禾邦200502 S18太极集团重庆涪陵制药厂有限公司太极2021022 S19湖南时代阳光药业股份有限公司永州20210302 S20湖南汉森制药股份有限公司汉森2004101 S21湖北东信药业有限公司东信210201 S22武汉太福制药有限公司太福210506 S23天津和治药业集团有限公司美舒通210201 S24天津中新药业集团股份有限公司隆顺榕060084 S25北京同仁堂科技发展股份有限公司同仁堂20140162 S26吉林省抚松制药股份有限公司林海191004 S27吉林隆泰制药股份有限公司明复20200614
2 方法
2.1 供试品溶液制备
取HZS样品1.0 mL于10 mL量瓶中,加入50%乙醇溶液定容至刻度,涡旋混匀,取适量过0.22 μm滤膜,即得供试品溶液。
2.2 色谱条件
色谱柱为Acquity UPLC®HSS T3(100 mm×2.1 mm,1.8 μm);柱温45 ℃;体积流量0.3 mL/min;进样量5 μL;流动相为0.1%甲酸水溶液-乙腈;平衡时间15 min;梯度洗脱:0~7 min,10%~20%乙腈;7~30 min,20%~50%乙腈;30~35 min,50%~90%乙腈;35~37 min,90%乙腈;37~37.1 min,90%~10%乙腈;37.1~40 min,10%乙腈;离子源温度100 ℃;脱溶剂气温度550 ℃;脱溶剂气体积流量600 L/h;锥孔气体积流量50 L/h;毛细管电压2 kV;锥孔电压40 eV;离子源:ESI+;工作模式:MSE模式;扫描模式:灵敏度模式;扫描范围50~1000;扫描时间1.0 s;碰撞能量:低碰撞能量为off,高碰撞能量为20~40 eV。
2.3 指纹图谱建立
将27批HZS样品按“2.1”项方法处理后按照“2.2”项方法进行UPLC-Q-TOF-MS分析,生成基峰离子流(base peak chromatogram,BPI)谱图,导入“中药色谱指纹图谱相似度评价系统(2012版)”,建立指纹图谱,并进行相似度分析。
2.4 共有峰鉴定
将UPLC-Q-TOF-MS采集的HZS样品数据,导入到UNIFI 1.9.4软件中完成质量校正、加和离子设定等处理,进行化合物峰提取,并结合UNIFI 1.9.4软件自带的中药数据库以及Chemical Book等线上数据库进行化合物匹配鉴定。UNIFI 1.9.4软件参数设置:高能量下响应阈值为20,低能量下响应阈值为200;精确质量偏差阈值为0.005;可识别的化合物加和峰形式包括+H、+H2O+H、−e峰。
2.5 数据分析
将UPLC-Q-TOF-MS采集的HZS样品相关数据,分别导入到IBM SPSS Statistics 21.0软件以及EZInfo 3.0软件进行HCA和差异显著性检验以及PCA,分析不同HZS样品的差异性。
2.6 分子对接
将“3.4”项中得到的差异性成分与SARS-CoV-2 Mpro进行分子对接筛选出抗SARS-CoV-2的潜在活性成分,进一步确定HZS的潜在Q-Marker。SARS-CoV-2 Mpro蛋白(PDB ID:7AF0)的晶体结构从RSCB PDB数据库(https://www.rcsb.org/)中获取。运用PyMOL(version 2.3.1)(https://pymol. org/)可视化软件移除配体和水分子,用AutoDock(ADT,version 1.5.6)软件加氢、加电荷(compute gastieger),建立刚性盒子,盒子的三维坐标参数如表2所示。筛选出的HZS差异性成分3D结构的SDF格式文件从PubChem数据库(https://pubchem. ncbi.nlm.nih.gov/)中获取,用PyMOL可视化软件获得pdb格式文件,用AutoDock激活其可旋转的氢原子,并且以pdbqt文件的形式保存。前期工作准备好之后,打开Command Prompt命令提示符窗口进行Vina对接。得到的对接结构通过PyMOL软件可视化,通过Ligplot软件(https://www.ebi.ac.uk/ thornton-srv/software/LigPlus/)和蛋白质-配体相互作用分析工具(https://plip.biotec.tu-dresden.de/plip- web/plip/index)分析HZS差异性成分与SARS-CoV- 2 Mpro之间形成的氢键、疏水键等作用力。
表2 刚性盒子的三维坐标参数
Table 2 3D coordinate parameters of rigid box
设置参数数值/nm 盒子的中心坐标值x1.224 0 y−1.325 1 z0.514 5 盒子三维坐标值x4.0 y6.8 z6.8
3 结果与分析
3.1 指纹图谱建立
将27批HZS样品的BPI谱图以cdf格式导入“中药色谱指纹图谱相似度评价系统(2012版)”进行分析,以S1样品谱图为参照图谱,设定时间窗宽度为0.1 min,进行多点校正后自动峰匹配,其指纹图谱叠加见图1,共确定27个共有峰,以中位数法生成对照指纹图谱(图R)。将各样品与R进行比较,得到S1~S27的相似度分别为0.910、0.922、0.972、0.819、0.984、0.982、0.975、0.909、0.927、0.976、0.937、0.790、0.914、0.935、0.837、0.816、0.950、0.973、0.947、0.941、0.900、0.963、0.947、0.966、0.931、0.899、0.855,各样品的相似度分布在0.790~0.984,表明27批HZS样品质量存在一定的差异性。

图1 27批HZS指纹图谱叠加
3.2 主要共有峰鉴定
使用UNIFI软件对27批HZS样品的MSE原始数据进行处理。进行峰识别和对齐后,得到包含母离子质荷比、保留时间RT和离子响应强度的数据矩阵,结合UNIFI软件自带的中药数据库及Chemical Book等线上数据库对“3.1”项中确定的27个共有峰进行鉴定,推断出14种化合物(表3),其中5种化合物经过对照品进行比对验证,1(槟榔次碱)号峰来源于大腹皮,6(甘草苷)、8(新甘草苷)、18(甘草酸)号峰来源于甘草,9(橙皮苷)、15(甜橙素)、19(川陈皮素)、20(3,5,6,7,8,3′,4′-七甲氧基黄酮,3,5,6,7,8,3′,4′-heptamethoxyflavone,HMOF)、21(桔皮素)号峰来源于陈皮,13(氧化前胡素)、14(新比克白芷内脂)、22(欧前胡素)、23(珊瑚菜素)号峰来源于白芷,24(厚朴酚)号峰来源于厚朴。
表3 27批HZS主要共有峰的鉴定
Table 3 Identification of mainly common peaks of 27 batches of HZS samples
峰号tR/min化合物分子式准分子离子(m/z)δ/(×10−6)加和离子来源药材 10.85槟榔次碱C7H11NO2160.096 1−5.0+H2O+H,+H大腹皮[22-23] 66.35甘草苷*C21H22O9419.133 4−0.7+H甘草[24] 87.76新甘草苷C21H22O9419.133 2−1.2+H甘草[25-26] 98.94橙皮苷*C28H34O15611.197 71.0+H陈皮[27-29] 1312.50氧化前胡素C16H14O5305.101 8−0.6+H2O+H白芷[30-31] 1413.30新比克白芷内脂C17H16O6317.102 00.0+H,+H2O+H白芷[31] 1518.40甜橙素C20H20O7373.127 8−1.1+H陈皮[29,32] 1821.64甘草酸*C42H62O16823.411 30.4+H甘草[33-34] 1922.94川陈皮素C21H22O8403.138 5−0.5+H陈皮[28-29] 2024.60HMOFC22H24O9433.149 2−0.2+H,−e陈皮[29] 2125.32桔皮素C20H20O7373.128 30.3+H陈皮[28] 2227.10欧前胡素*C16H14O4271.096 50.0+H白芷[31] 2328.88珊瑚菜素C17H16O5301.107 00.0+H白芷[35] 2431.69厚朴酚*C18H18O2267.137 5−1.5+H厚朴[36]
*为经对照品验证
*compound comfirmed by reference substance
3.3 HCA
将“3.1”项中得到的27个共有峰的峰面积数据导入IBM SPSS Statistics 21.0软件中,运用ward法,以平方欧氏(Euclidean)距离为测度,进行HCA,结果如图2所示。当平方Euclidean距离为5时,各样品聚类效果最好,27批HZS样品可分为3类,S7、S11~S13、S15~S17、S21~S23、S25、S27聚为一类,S3、S5、S6、S8~S10、S14、S18~S20、S24、S26聚为一类,S1、S2和S4聚为一类。
3.4 PCA
应用EZInfo 3.0软件对正离子模式下各HZS样品的UPLC-Q-TOF-MS原始数据进行PCA,图3为其PCA得分图。结果显示,各HZS样品分为3类,S7、S10~S13、S15~S17、S21、S22、S27为一类,S6、S8、S9、S14、S18~S20、S23~S26为一类,S1~S5为一类。除S3、S5、S10、S23、S25样品外,其他样品的PCA结果与“3.3”项HCA结果一致。
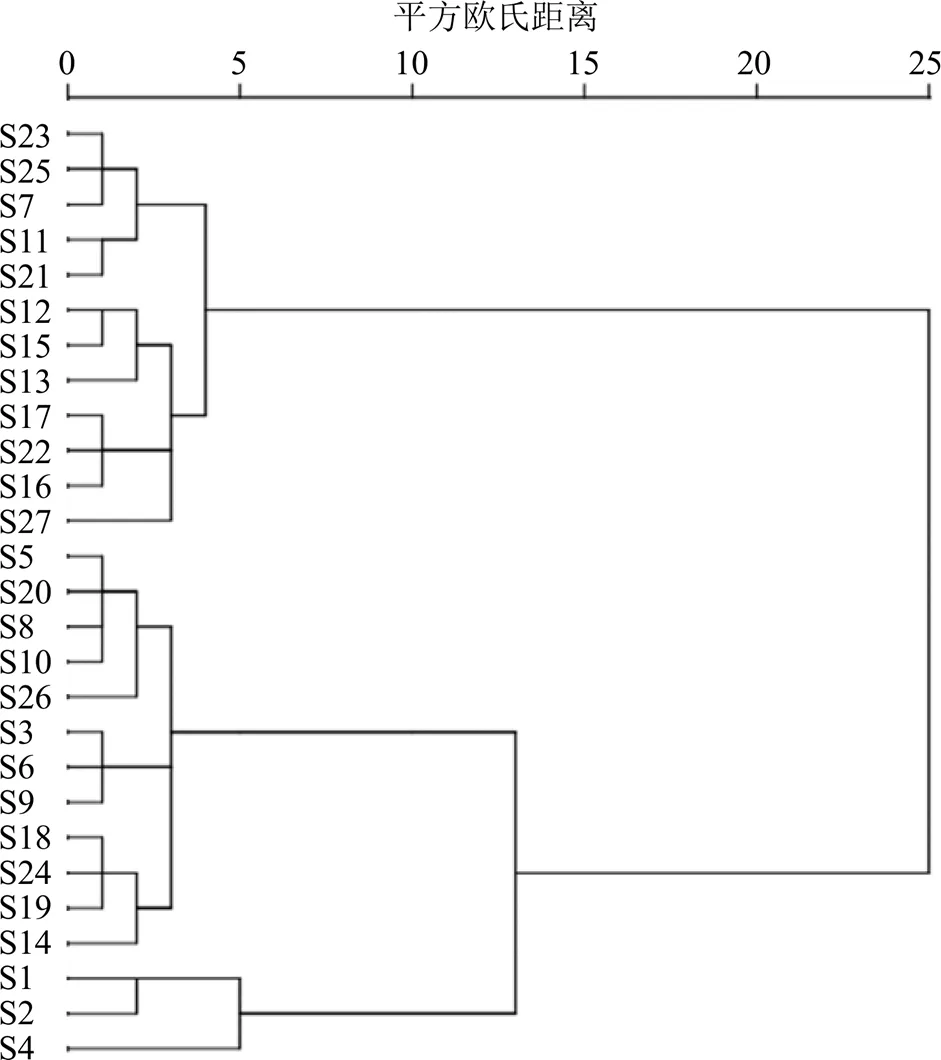
图2 27批HZS样品的HCA

图3 27批HZS样品的PCA得分图
通过载荷散点图进一步对影响HZS质量的化学成分进行比较和分析。在载荷散点图中的各个点表示各个质荷比-保留时间变量,根据变量离原点的距离判定变量对主成分的权重影响,离原点越远则表明该变量对主成分的影响权重越大[37]。图4为各HZS样品27个共有峰的PCA载荷散点图,可以看出9(橙皮苷)、18(甘草酸)、20(HMOF)、21(桔皮素)、26号峰对主成分1的贡献率较大,10、13(氧化前胡素)、14(新比克白芷内脂)、15(甜橙素)、16、17、22(欧前胡素)、23(珊瑚菜素)、25号峰对主成分2的贡献较大,说明以上14种化合物在27批HZS样品中的相对含量存在较大差异,是HZS的差异性成分。
3.5 潜在Q-Marker的确定
以药物瑞德西韦为阳性对照,以HZS 9种已鉴定出的差异性成分橙皮苷、氧化前胡素、新比克白芷内脂、甜橙素、甘草酸、HMOF、桔皮素、欧前胡素、珊瑚菜素作为研究对象,分别与SARS-CoV-2 Mpro进行对接,以结合能大小、结合位点等作为评价指标,筛选出对SARS-CoV-2 Mpro可能有抑制作用的HZS潜在活性成分,作为HZS的潜在Q-Marker。阳性对照和9种差异性成分与SARS-CoV-2 Mpro的对接结果如表4所示。由表4可知,瑞德西韦与SARS-CoV-2 Mpro的结合能为−28.88 kJ/mol,差异性成分中橙皮苷、氧化前胡素、新比克白芷内脂、甜橙素、甘草酸、HMOF、桔皮素、欧前胡素、珊瑚菜素与SARS-CoV-2 Mpro的结合能分别为−36.84、−26.37、−28.46、−26.37、−38.09、−25.53、−26.37、−28.04、−28.46 kJ/mol,可见这9种差异性成分与SARS-CoV-2 Mpro结合能接近于阳性对照与SARS-CoV-2 Mpro的结合能。有文献显示,复合物的稳定性主要由配体和受体之间形成的氢键和疏水键等作用力大小决定,形成的作用力越多,配体与受体结合的稳定性越高[38-39]。由表4可知,瑞德西韦与SARS-CoV-2 Mpro结合,形成2个氢键和13个疏水键,橙皮苷、氧化前胡素、新比克白芷内脂、甜橙素、甘草酸、HMOF、桔皮素、欧前胡素、珊瑚菜素与SARS-CoV-2 Mpro结合分别形成了9、2、3、3、8、3、3、1、1个氢键和9、8、7、7、8、6、6、8、7个疏水键,这可能是这9种化合物与SARS-CoV-2 Mpro的结合能小于或者较为接近瑞德西韦的原因。

图4 27批HZS样品的PCA载荷散点图
表4 HZS的差异性成分与SARS-CoV-2 Mpro的结合能、氢键和疏水键信息
Table 4 Binding affinity, interactions with SARS-CoV-2 Mpro and binding sites of differential compounds in HZS
化合物名称结合能/(kJ∙mol−1)氢键疏水键 数量结合位点数量结合位点 橙皮苷−36.849Thr24, Cys44, His41, Glu166, Cys145, Thr269Thr45, Met49, Ser46, Gln189, His163, Ser144, Leu141, Gly143, Thr25 氧化前胡素−26.372Glu166, Cys1458Met165, Met49, Thr25, Leu27, Gly143, Asn142, His164, His163 新比克白芷内脂−28.463Arg298, Thr111, Thr2927Phe294, Asn151, Asp295, Gln110, Ile106, Ser158, Asp153 甜橙素−26.373Lys137, Leu287, Arg1317Asp289, Leu286, Leu271, Leu272, Tyr239, Tyr237, Thr199 甘草酸−38.098Ser158, Arg298, Asp295, Asn151, Thr111, Gln1108Asp245, Gln107, Val104, Asp153, Phe8, Phe294, Ile249, His246 HMOF−25.533Lys137, Thr199, Ser2846Asp197, Arg131, Leu287, Asp289, Glu288, Leu286 桔皮素−26.373Thr199, Leu287, Lys1376Asp289, Tyr237, Tyr239, Leu272, Leu271, Leu286 欧前胡素−28.041Ser1588 Phe294, Asp295, Asp153, Val104, Ile106, Gln110, Asn151, Thr111 珊瑚菜素−28.461Ser1587Phe294, Gln110, Ile106, Asp153, Lys102, Ile152, Asn151 瑞德西韦−28.882Thr24, Phe14013Thr26, His41, Thr25, Gly143, Cys145, His163, Leu141, Glu166,Met165, Gln189, Ser46, Met49, Asn142
有些氨基酸残基形成2个氢键,因此氢键数量≥氨基酸残基数量
some amino acid residues form two hydrogen bonds, so the number of hydrogen bonds ≥ the number of amino acid residues
据文献报道[40],SARS-CoV-2 Mpro具有S1(Phe140、Leu141、His163、Met165、Glu166、His172)、S2(Met49、Asp187、Gln189)、S1’(Thr25、Leu27、Cys38、Pro39、Val42、Cys145)、S2’(Thr26、Asn28、Tyr118、Asn119、Gly143)和S4(Leu167、Gln192)5个活性口袋,配体通常需要与靶蛋白的关键活性氨基酸残基结合,才能有效抑制其活性[41]。从结合位点角度分析,瑞德西韦位于SARS-CoV-2 Mpro活性口袋S1、S2、S1’、S2’和S4中(图5),且与S1的活性氨基酸残基Phe140结合形成1个氢键,与S1、S2、S1’、S2’的活性氨基酸残基Thr26、Thr25、Gly143、Cys145、His163、Leu141、Glu166、Met165、Gln189、Met49结合形成10个疏水键(表4和图6- A)。而9种差异性成分中橙皮苷和氧化前胡素也位于活性口袋S1、S2、S1’、S2’和S4中(图5),橙皮苷与S1、S1’、S2’的活性氨基酸残基Glu166、Cys145、Thr26结合形成4个氢键,与S1、S2、S1’、S2’的活性氨基酸残基Met49、Gln189、His163、Leu141、Gly143、Thr25结合形成6个疏水键(表4和图6-B);氧化前胡素与S1、S1’的活性氨基酸残基Glu166、Cys145结合形成2个氢键,与S1、S2、S1’、S2’活性氨基酸残基Met165、Met49、Thr25、Leu27、Gly143、His163结合形成6个疏水键(表4和图6-C)。
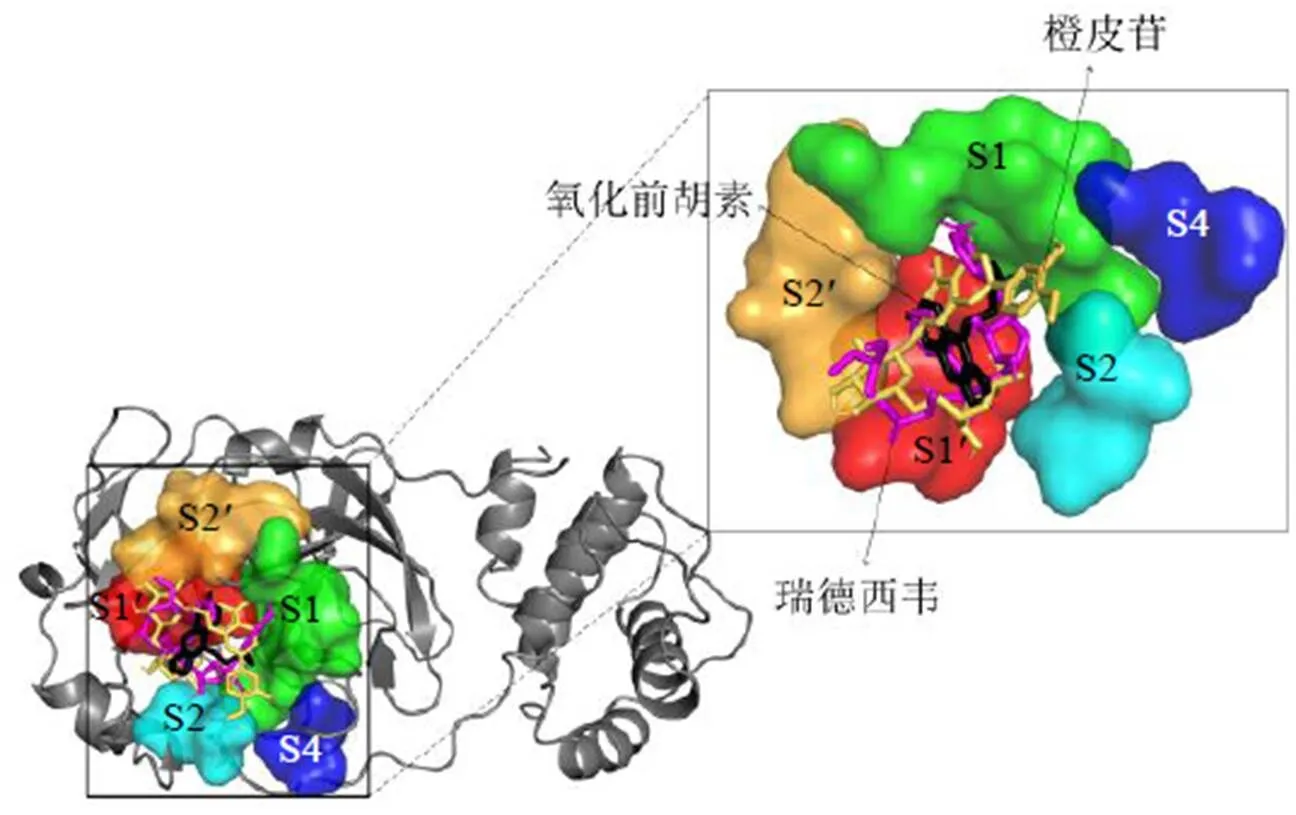
图5 SARS-CoV-2 Mpro活性口袋S1、S2、S1’、S2’和S4与配体瑞德西韦、橙皮苷和氧化前胡素对接的3D示意图

图6 瑞德西韦(A)、橙皮苷(B)、氧化前胡素(C)、新比克白芷内脂(D)、甘草酸(E)、欧前胡素(F)、珊瑚菜素(G)与SARS-CoV-2 Mpro的分子对接2D图
此外,还有文献报道[42-43],Thr24、His41、Cys44、Thr45、Ser46、Asn142、Ser144、His164、Pro168、Arg188、Thr190、Thr111、Thr292、Phe294、Gln110、Asp153、Gln107、Ile249、His246等也是SARS-CoV-2 Mpro的活性氨基酸残基,可形成SARS-CoV-2 Mpro的活性口袋S5(图7)。瑞德西韦、橙皮苷、氧化前胡素、新比克白芷内脂、甘草酸、欧前胡素、珊瑚菜素落在S5口袋中,且与活性氨基酸残基结合(图7)。其中,瑞德西韦与S5的活性氨基酸残基Thr24结合形成1个氢键,与活性氨基酸残基His41、Ser46、Asn142结合形成3个疏水键(表4和图6-A);橙皮苷与S5的活性氨基酸残基Thr24、Cys44、His41结合形成5个氢键,与活性氨基酸残基Thr45、Ser46、Ser144结合形成3个疏水键(表4和图6-B);氧化前胡素与S5的活性氨基酸残基Asn142、His164结合形成2个疏水键(表4和图6-C);新比克白芷内脂与S5的活性氨基酸残基Thr111、Thr292结合形成2个氢键,与活性氨基酸残基Phe294、Gln110、Asp153结合形成3个疏水键(表4和图6-D);甘草酸与S5的活性氨基酸残基Thr111、Gln110结合形成2个氢键,与活性氨基酸残基Gln107、Asp153、Phe294、Ile249、His246结合形成5个疏水键(表4和图6-E);欧前胡素与S5的活性氨基酸残基Phe294、Asp153、Gln110、Thr111结合形成4个疏水键;珊瑚菜素与S5的活性氨基酸残基Phe294、Gln110、Asp153结合形成3个疏水键(表4和图6-F)。

图7 SARS-CoV-2 Mpro活性口袋S5和配体瑞德西韦、橙皮苷、氧化前胡素、新比克白芷内脂、甘草酸、欧前胡素和珊瑚菜素对接的3D示意图
综上,9种差异性化合物中,只有橙皮苷、氧化前胡素、新比克白芷内脂、甘草酸、欧前胡素、珊瑚菜素与SARS-CoV-2 Mpro的关键活性氨基酸残基结合。因此,橙皮苷、氧化前胡素、新比克白芷内脂、甘草酸、欧前胡素、珊瑚菜素可能对SARS- CoV-2 Mpro具有一定的潜在抑制作用,可作为HZS的潜在Q-Marker,以对HZS进行质量评价。
3.6 质量评价
以“3.5”项中确定的6种潜在Q-Marker橙皮苷、氧化前胡素、新比克白芷内脂、甘草酸、欧前胡素、珊瑚菜素在HZS中的峰面积作为指标,评价不同HZS样品的质量。将各HZS样品中6种潜在Q-Marker化合物的峰面积数据导入IBM SPSS Statistics 21.0软件中,进行差异显著性检验,组间均数比较采用单因素方差分析(One-way ANOVA),组间两两比较采用最小显著性差(LSD)检验,结果如表5所示。从表5中可以看出,27批HZS样品中6种潜在Q-Marker的峰面积均存在显著性差异(<0.01)。其中,橙皮苷峰面积较高的样品有S1~S4、S10、S11;氧化前胡素峰面积较高的样品有S2、S6、S9、S23~S25;新比克白芷内脂峰面积较高的样品有S6、S9、S25;甘草酸峰面积较高的样品有S3、S8~S10、S12~S15、S19;欧前胡素峰面积较高的样品有S2、S3、S5、S6、S9、S18、S21、S23~S25;珊瑚菜素峰面积较高的样品有S2、S3、S6、S9、S18、S19、S25、S26。
综合6种潜在Q-Marker峰面积比较结果,27批HZS样品中,样品S2、S3、S6、S9、S25具有较好的抗SARS-CoV-2的潜在活性。
4 讨论
通过建立不同HZS样品的UPLC-Q-TOF-MS指纹图谱,标定了27种共有化合物,相似度在0.790~0.984,说明不同HZS样品具有一定的差异性;通过化学计量学分析,确定了其中14种共有化合物为差异性化合物,共鉴定出了橙皮苷、氧化前胡素、新比克白芷内脂、甜橙素、甘草酸、HMOF、桔皮素、欧前胡素、珊瑚菜素9种差异性化合物。这些差异性化合物主要来源于陈皮、白芷、甘草药材,因此不同HZS样品的差异性可能是以上3种药材原材料质量、投料以及工艺参数存在差异性导致的。唐素芳[4]采用UPLC-Q-TOF组学以及指纹图谱等研究方法,对抽取的22个生产厂家、68批次藿香正气水的质量进行了评价研究,结果发现个别企业陈皮和白芷的特征峰缺失严重,处方中甘草浸膏投料普遍不足,存在提取物投料或替代投料嫌疑,这与本研究结论基本一致。
表5 27批HZS样品中橙皮苷、氧化前胡素、新比克白芷内脂、甘草酸、欧前胡素、珊瑚菜素的峰面积比较 (, n = 3)
Table 5 Peak area of hesperidin, oxypeucedanin, neobyakangelicol, glycyrrhizic acid, imperatorin and phellopterin of 27 batches of HZS samples (, n = 3)
样品编号峰面积/(×106) 橙皮苷氧化前胡素新比克白芷内脂甘草酸欧前胡素珊瑚菜素 S16.02±0.33a1.81±0.02m0.88±0.01m1.50±0.11n1.41±0.03e2.53±0.07fg S25.49±0.09bc4.16±0.09cd2.08±0.08d4.72±0.42hi1.99±0.08b3.25±0.15b S35.82±0.05a4.11±0.03d1.98±0.03e6.14±0.01cd2.09±0.04b3.14±0.04bc S45.59±0.09b0.77±0.02p0.45±0.02p1.82±0.03mn0.64±0.02hi1.07±0.05lm S54.95±0.05e3.92±0.04e1.77±0.03fg5.31±0.18fg1.91±0.07bc2.86±0.09d S63.94±0.05j4.19±0.06cd2.29±0.05c5.79±0.15de2.39±0.06a3.90±0.08a S75.22±0.01d4.10±0.03d1.71±0.02g3.33±0.12kl1.67±0.03d2.35±0.04hi S84.03±0.14j2.12±0.04l0.99±0.03kl6.16±0.06cd0.88±0.05g1.72±0.08jk S94.61±0.06fg5.97±0.13a3.83±0.11a6.73±0.37b2.39±0.31a3.89±0.16a S105.45±0.04bc2.38±0.01k0.75±0.01n6.12±0.31cd1.45±0.07e2.24±0.10i S115.30±0.07cd1.35±0.01o0.47±0.01p5.49±0.30ef1.06±0.02f1.57±0.01k S124.67±0.03fg1.94±0.02m0.59±0.00o7.16±0.09a1.20±0.02f1.75±0.02j S134.14±0.04ij3.69±0.06f1.61±0.04h7.27±0.17a1.65±0.05d2.53±0.04fg S144.72±0.05f2.51±0.07jk1.32±0.06i6.24±0.07c0.85±0.01g1.16±0.02l S154.33±0.11hi1.25±0.05o0.44±0.02p6.76±0.07b0.57±0.01i0.99±0.02m S164.33±0.04hi2.42±0.05k0.92±0.02lm5.06±0.09gh1.16±0.02f1.61±0.03jk S173.53±0.09k2.43±0.05jk1.01±0.02kl3.11±0.18l0.35±0.01j0.69±0.01n S182.72±0.09o2.56±0.13ij1.04±0.04k5.71±0.07ef1.76±0.05cd3.08±0.11bc S192.78±0.06no2.68±0.02hi1.19±0.02j6.24±0.28c1.68±0.04d3.02±0.06c S202.96±0.06mn3.83±0.03e1.85±0.02f4.12±0.10j1.41±0.06e2.39±0.05gh S214.47±0.02gh3.42±0.01g1.56±0.01h4.89±0.17h1.93±0.08bc2.74±0.04de S224.00±0.12j1.64±0.04n0.68±0.02n2.08±0.13m0.77±0.03gh1.07±0.04lm S232.72±0.01o4.28±0.05c1.74±0.01g3.47±0.04kl1.81±0.04cd2.70±0.09de S242.05±0.10p4.26±0.11c2.01±0.09de4.18±0.05j1.79±0.04cd2.58±0.05ef S253.07±0.12lm5.10±0.06b2.68±0.06b3.65±0.10k2.03±0.04b3.13±0.07bc S261.86±0.01p2.75±0.02h1.30±0.01i4.32±0.06j1.71±0.05d3.01±0.01c S273.20±0.03l0.43±0.01q0.26±0.00q4.38±0.09ij0.50±0.00ij0.79±0.01n
表中同列不同小写字母表示27批HZS样品中化合物峰面积存在显著差异(<0.01)
different lowercase letters in the same column in the table indicate that there are significant differences in peak areas of compounds in 27 batches of HZS samples (< 0.01)
通过分子对接确定了橙皮苷、氧化前胡素、新比克白芷内脂、甘草酸、欧前胡素、珊瑚菜素6种差异性化合物对SARS-CoV-2 Mpro有潜在抑制作用,可作为HZS的潜在Q-Marker。其中,已有研究结果显示,橙皮苷[44-46]、甘草酸[46-49]以及欧前胡素[50-51]对SARS-CoV-2有一定的抑制作用,而氧化前胡素、新比克白芷内脂和珊瑚菜素尚未有文献报道,这为SARS-CoV-2小分子抑制剂的研究提供了新思路。《中国药典》2020年版[1]规定HZS处方中需检测厚朴和陈皮2项原材料含量,二者分别以厚朴酚、和厚朴酚总量以及橙皮苷含量作为评价标准,建议增加处方中白芷和甘草原材料的检测方法,以得到更加综合完整的藿香正气水质量评价体系。
另外,后续研究仍需通过体外实验等进行验证,以进一步确定本研究预测结果的准确性。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 1881.
[2] 杜海涛, 王平, 马青云, 等. 藿香正气汤抑制新型冠状病毒复制过程的有效成分及机制初探 [J]. 世界科学技术—中医药现代化, 2020, 22(3): 645-651.
[3] 徐铁龙, 谢青萍, 周旭, 等. 江西省新冠肺炎中医临床应用特征分析 [J]. 江西中医药, 2022, 53(1): 35-38.
[4] 唐素芳. 藿香正气水质量评价方法研究[EB]. 天津市: 天津市药品检验研究院, 2018-12-28.
[5] 聂黎行, 何雨晴, 于建东, 等. 藿香正气水快速质量评价 (II): 超高效液相色谱波长切换法同时测定7个成分的含量 [J]. 中国药学杂志, 2017, 52(24): 2192-2195.
[6] 刘征辉, 叶挺祥, 赵洪芝, 等. 藿香正气水指纹图谱及模式识别对质量控制的研究 [J]. 药物分析杂志, 2012, 32(11): 2064-2067.
[7] 孙小红, 葛建, 王国夫, 等. 不同厂家藿香正气水质量比较研究及分析 [J]. 中国药房, 2010, 21(28): 2671- 2673.
[8] Zhang H B, Zhang T J, Xu J,. Rapid analysis and identification of absorbed components and their metabolites of Yuanhu Zhitong Dropping Pill in rat plasma and brain tissue using UPLC-Q-TOF/MS with multivariate statistical analysis [J]., 2016, 8(2): 154-163.
[9] 胡晓茹, 王海南, 王亚丹, 等. 中成药质量控制的思考与建议 [J]. 中国食品药品监管, 2021(9): 10-15.
[10] 陈丽华, 肖发林, 黄诗雨, 等. 中药质量评价研究思路及创新发展趋势 [J]. 中草药, 2021, 52(9): 2541-2547.
[11] 王帅, 包永睿, 李天娇, 等. 中药质量评价关键问题与分析方法探讨 [J]. 分析测试学报, 2021, 40(1): 132-138.
[12] 聂黎行, 何雨晴, 戴忠, 等. 藿香正气水快速质量评价(I): 化学计量学辅助的UPLC指纹图谱研究 [J]. 中国药学杂志, 2017, 52(20): 1862-1866.
[13] 李红梅, 茹鑫, 梁悦, 等. 藿香正气水气相色谱指纹图谱特性研究 [J]. 中成药, 2010, 32(1): 6-10.
[14] 程斌, 童静玲, 周爱珍, 等. 基于UPLC-Q-TOF-MS谱-效分析的浙贝母化痰质量标志物的初步筛选及含量差异研究 [J]. 中国药学杂志, 2021, 56(6): 462-471.
[15] 程斌, 周爱珍, 彭昕, 等. 浙贝母UPLC-Q-TOF-MS/ MS指纹图谱的建立及其抗炎质量标志物的分析 [J]. 中国药房, 2020, 31(17): 2129-2135.
[16] 许啸, 张淹, 任雪阳, 等. 基于特征图谱、化学计量学和分子对接的复方阿胶浆质量标志物研究 [J]. 中草药, 2021, 52(23): 7148-7161.
[17] 王信, 李莉, 张瑞, 等. 基于指纹图谱和网络药理学的白花蛇舌草质量标志物预测分析[J]. 中国医院药学杂志, 2022, 42(16): 1633-1641.
[18] 王慧, 梁燕青, 于兴泰, 等. 基于指纹图谱和网络药理学的江枳壳质量标志物预测分析 [J]. 中国实验方剂学杂志, 2022, 28(13): 198-208.
[19] 张雨恬, 伍振峰, 黄艺, 等. 基于网络药理学与分子对接技术的鲜竹沥治疗“咳、喘、痰”机制及其质量标志物预测分析 [J]. 中草药, 2021, 52(24): 7538-7549.
[20] Jahan R, Paul A K, Bondhon T A,.: Ayurvedic uses of the plant and in silico binding studies of selected phytochemicals with mpro of SARS-CoV-2 [J]., 2021, 16(10): 1934578X2110317.
[21] Sinha S K, Prasad S K, Islam M A,. Potential leads from liquorice against SARS-CoV-2 main protease using molecular docking simulation studies [J]., 2021, 24(4): 591-597.
[22] 田莲超, 秦少荣, 易红, 等. 同源中药大腹皮与槟榔中4种生物碱的含量比较研究 [J]. 中国中药杂志, 2018, 43(14): 2850-2856.
[23] 郁红礼, 汤丽娟, 吴皓, 等. 多指标正交优选大腹皮饮片切制工艺 [J]. 中药材, 2014, 37(12): 2178-2181.
[24] Wang H, Riemann M, Liu Q,. Glycyrrhizin, the active compound of the TCM drug Gan Cao stimulates actin remodelling and defence in grapevine [J]., 2021, 302: 110712.
[25] 陈佳, 聂黎行, 胡晓茹, 等. 基于超高效液相色谱-四极杆飞行时间质谱法分析乌拉尔甘草与光果甘草化学成分差异[J/OL]. 中国药物警戒, 2022, http://kns.cnki.net/ kcms/detail/11.5219.R.20211014.1627.004.html.
[26] 周越美, 冯超, 史煜华, 等. 甘草浸膏HPLC指纹图谱及多指标成分含量测定研究 [J]. 中国现代应用药学, 2020, 37(9): 1046-1051.
[27] Wang T H, Sun Y X, Chen T Y,. Spectral properties of the interaction between hesperidin of tangerine peel’s active ingredient with protein [J]., 2018, 14(8): 1060-1065.
[28] Ho S C, Kuo C T. Hesperidin, nobiletin, and tangeretin are collectively responsible for the anti-neuroinflammatory capacity of tangerine peel () [J]., 2014, 71: 176-182.
[29] Fu M Q, Xiao G S, Wu J J,. Chemical constituents from[J]., 2017, 9(1): 86-91.
[30] Kiyonga A N, Hong G, Kim H S,. Facile and rapid isolation of oxypeucedanin hydrate and byakangelicin fromby using [Bmim]Tf2N ionic liquid [J]., 2021, 26(4): 830.
[31] Zhao A H, Zhang Y B, Yang X W. Simultaneous determination and pharmacokinetics of sixteencoumarinsby LC-ESI-MS/MS following oral delivery in rats [J]., 2016, 23(10): 1029-1036.
[32] Zhang Y, Yu Y P, Li H,. Effects ofand grapefruit juice on the pharmacokinetics of omeprazole in rats [J]., 2022, 46(3): e13804.
[33] Al-Kamel H, Grundmann O. Glycyrrhizin as a potential treatment for the novel coronavirus (COVID-19) [J]., 2021, 21(16): 2204-2208.
[34] van de Sand L, Bormann M, Alt M,. Glycyrrhizin effectively inhibits SARS-CoV-2 replication by inhibiting the viral main protease [J]., 2021, 13(4): 609.
[35] Han H S, Jeon H, Kang S C. Phellopterin isolated fromreduces blood glucose level in diabetic mice [J]., 2018, 4(3): e00577.
[36] Niu L, Hou Y Y, Jiang M,. The rich pharmacological activities ofand secondary effects based on significant intestinal contributions [J]., 2021, 281: 114524.
[37] 刘慧, 肖金超, 张庆捷, 等. 金骨莲胶囊HPLC指纹图谱及化学模式识别研究 [J]. 中草药, 2021, 52(14): 4185-4192.
[38] Hussein R K, Elkhair H M. Molecular docking identification for the efficacy of some zinc complexes with chloroquine and hydroxychloroquine against main protease of COVID-19 [J]., 2021, 1231: 129979.
[39] Naik S R, Bharadwaj P, Dingelstad N,. Structure-based virtual screening, molecular dynamics and binding affinity calculations of some potential phytocompounds against SARS-CoV-2 [J]., 2021, 40(15): 11-18.
[40] Mishra D, Maurya R R, Kumar K,. Structurally modified compounds of hydroxychloroquine, remdesivir and tetrahydrocannabinol against main protease of SARS-CoV-2, a possible hope for COVID-19: Docking and molecular dynamics simulation studies [J]., 2021, 335: 116185.
[41] Pan F, Zhou N, Li J X,. Identification of-phycocyanin-derived peptides as angiotensin converting enzyme and dipeptidyl peptidase IV inhibitors via molecular docking and molecular dynamic simulation [J]., 2020, 2: 58-69.
[42] Gajjar N D, Dhameliya T M, Shah G B. In search of RdRp and Mpro inhibitors against SARS CoV-2: Molecular docking, molecular dynamic simulations and ADMET analysis [J]., 2021, 1239: 130488.
[43] Skariyachan S, Gopal D, Chakrabarti S,. Structural and molecular basis of the interaction mechanism of selected drugs towards multiple targets of SARS-CoV-2 by molecular docking and dynamic simulation studies- deciphering the scope of repurposed drugs [J]., 2020, 126: 104054.
[44] Agrawal P K, Agrawal C, Blunden G. Pharmacological significance of hesperidin and hesperetin, twoflavonoids, as promising antiviral compounds for prophylaxis against and combating COVID-19 [J]., 2021, 16(10): 1934578X2110425.
[45] Cheng F J, Huynh T K, Yang C S,. Hesperidin is a potential inhibitor against SARS-CoV-2 infection [J]., 2021, 13(8): 2800.
[46] 曾永长, 梁少瑜, 姜倩倩, 等. 经方华盖散抗新型冠状病毒肺炎的网络药理学分析 [J]. 中药新药与临床药理, 2021, 32(4): 484-491.
[47] Li J J, Xu D G, Wang L L,. Glycyrrhizic acid inhibits SARS-CoV-2 infection by blocking spike protein- mediated cell attachment [J]., 2021, 26(20): 6090.
[48] Sun Z, He G Z, Huang N H,. Glycyrrhizic acid: A natural plant ingredient as a drug candidate to treat COVID-19 [J]., 2021, 12: 707205.
[49] Zhao Z Y, Xiao Y C, Xu L Q,. Glycyrrhizic acid nanoparticles as antiviral and anti-inflammatory agents for COVID-19 treatment [J]., 2021, 13(18): 20995-21006.
[50] Kiba Y, Oyama R, Misawa S,. Screening for inhibitory effects of crude drugs on furin-like enzymatic activities [J]., 2021, 75(4): 1080-1085.
[51] Sathish K C, Daoud A, Saud A,. In silico molecular docking: evaluation of coumarin based derivatives against SARS-CoV-2 [J]., 2020, 13(11): 1671-1677.
Screening potential Q-Marker from Huoxiang Zhengqi Shui based on UPLC-Q-TOF-MS fingerprints and molecular docking
ZHANG Ya-li1, HAN Jian-xun1, 2, TUERSUNTUOHETI·Tuohetisayipu1, SUN Zhao-zeng1, SONG Wei1, ZHANG Yu-song3, WEI Hai-yan1, XIAO Jin-jin1
1. Pony Testing International Group Co., Ltd., Beijing 100095, China 2. Pony Testing International Group Beijing Academy of Inspection and Certification Co., Ltd., Beijing 100095, China 3. Beijing Pony Medical Laboratory Co., Ltd., Beijing 100095, China
To screen the potential quality markers (Q-Marker) of anti-coronavirus of Huoxiang Zhengqi Shui (藿香正气水, HZS) based on the ultra-performance liquid chromatography-quadrupole-time of flight-mass spectrometry (UPLC-Q-TOF-MS) fingerprints and molecular docking.UPLC-Q-TOF-MS fingerprints and chemometric methods were employed to establish fingerprints and find out the difference between the peaks for the 27 batches of HZS samples. The SARS-CoV-2 main protease (Mpro) inhibition potential of the differential compounds among the 27 batches of HZS were further predicted by molecular docking with remdesiviras positive control.The UPLC-Q-TOF-MS fingerprints of 27 batches of HZS samples were set up with 27 common peaks. Combined with hierarchical clustering analysis (HCA) and principal component analysis (PCA), 14 common peaks were determined as differential compounds, and nine of them were identified as hesperidin, oxypeucedanin, neobyakangelicol, sinensetin, glycyrrhizic acid, 3,5,6,7,8,3′,4′-heptamethoxyflavone, tangeretin, imperatorin and phellopterin. Molecular docking results showed that a total of six differential compounds were proven to have a certain inhibitory effect on SARS-CoV-2 Mpro, which can be used as potential Q-Marker of HZS, including hesperidin, oxypeucedanin, neobyakangelicol, glycyrrhizic acid, imperatorin and phellopterin.The potential Q-Marker of HZS was determined by UPLC-Q-TOF-MS fingerprints, chemometric analysis and molecular docking. This method may provide a certain reference for the identification of various drug components, analysis of the differences of the same type drug components and pharmaceutical activity evaluation.
Huoxiang Zhengqi Shui; Q-Marker; UPLC-Q-TOF-MS fingerprint; molecular docking; SARS-CoV-2 Mpro potential inhibitor prediction; hesperidin; oxypeucedanin; neobyakangelicol; glycyrrhizic acid; imperatorin; phellopterin
R283.6
A
0253 - 2670(2022)19 - 6023 - 12
10.7501/j.issn.0253-2670.2022.19.009
2022-04-12
北京市“科技助力经济2020”重点专项(SQ2020YFF0414333);2020年苏州市新型冠状病毒感染应急防治专项(XG56)
张雅莉,硕士,中级工程师,研究方向为药品分析与检测。E-mail: yfh@ponytest.com
韩建勋,博士,副研究员,研究方向为药品质量与安全控制。E-mail: yfb@ponytest.com
[责任编辑 郑礼胜]
