硫化氢的制备及检测方法研究进展
2022-10-13赵家有支伟茹
赵家有,支伟茹
(中昊光明化工研究设计院有限公司,辽宁 大连 116031)
1 前 言
硫化氢(H2S)是一种无色、剧毒、酸性和具有特殊气味的气体[1]。硫主要存在于矿石、橡胶、沼泽、天然气、大气、食品和人体等中[2]。H2S主要用于制造有机硫化物(甲硫醇和乙硫醇等)和无机硫化物(硫酸和硫化锌等)。H2S侵入人体的主要途径为吸入。当H2S浓度<0.41×10-6时,人会闻到难闻的气味;H2S浓度在(25~120)×10-6,会刺激黏膜、损伤呼吸道,严重的会使嗅觉失灵;当H2S浓度>400×10-6时,会抑制中枢神经系统,如长时间暴露会致人死亡[3]。除对人体有损害外,对金属材料也会产生腐蚀作用。因此,不论是在化学、工业和医学等领域的使用价值,还是对人体和生活中带来的危害,研究H2S的制备、回收及检测都具有非常重要的意义。
2 硫化氢的制备方法
2.1 实验室制法
实验室最常用的H2S制取方法是使用稀硫酸和硫化亚铁反应生成H2S气体。FeS与H2SO4反应方程式如式(1):
FeS+H2SO4=FeSO4+H2S↑
(1)
陈花果等人[4]介绍了一种使用石蜡、硫磺和石棉制备H2S气体的方法。将石棉粉、石蜡粉和硫磺粉按照1∶2∶2的配比填充在玻璃试管中,用酒精灯加热试管,生成H2S气体。此法装置简单,操作简便,产生的H2S速度容易控制,但是H2S中杂质较多。
卜艳慧等人[5]介绍了一种使用硫化钙制备H2S的方法。首先烧制磷石膏制备硫化钙,在其中加入蒸馏水制成硫化钙悬浊液,通入二氧化碳,生成H2S气体,最后通过冷冻分离法去除杂质气体,得到高纯度的H2S气体。剩余残渣由于含硫量低,可以作为生产水泥的原材料。通过实验得到最优的工艺参数为反应时间5 h,温度50 ℃,气泡速率110个/min。此方法操作简单,可以得到高纯的H2S气体,并且残渣利用率高、环保。CaS生成H2S反应方程式如式(2):
CaS+CO2+H2O=CaCO3↓+H2S↑
(2)
张儒杰[6]介绍了一种从水蒸气、天然气和硫中制备H2S气体的方法。γ-Al2O3作为催化剂,温度650~750℃,H2O∶CH4∶S=2.2∶1∶2~2.5∶1∶2。这种方法确定了制备H2S原始试剂的最佳比例,制备的H2S产率高。
2.2 工业制法
将氢气纯化后与硫磺直接反应合成H2S,经纯化后H2S的纯度可达到99.5%~99.99%。反应方程式如式(3):
H2+S=2H2S
(3)
工艺流程:氢气经过纯化后进入反应釜直接与硫黄反应,生成H2S,之后进入洗涤,洗去杂质(氢和部分硫蒸气)。再进入冷凝器将剩余硫蒸气冷凝,回收硫黄。最后H2S气体进入冷凝器形成液态H2S,再经减压精馏后得到高纯H2S产品。(工艺流程如图1所示)。

图1 H2S工艺流程
将水和硫黄作为原料制备H2S的方法,工艺过程简单、产物纯度高、副产物少。
但是由于硫化氢是大气污染公害,会散发恶臭气味,具有污染范围广、影响大的特点,所以硫化氢回收工艺在保护环境方面起到越来越重要的作用。
李忠于[7]介绍了一种将废硫酸和硫化氢酸性气体联合回收的工艺方法。废硫酸与硫化氢酸性气体联合回收工艺流程主要包括焚烧、余热回收、气体净化、转化和尾气吸收等,其工艺流程如图2所示。排放尾气中ρ(SO2)≤50 mg/m3,ρ(H2SO4)雾≤50 mg/m3符合国家超低排放标准。该工艺具有以下特点:1.技术和设备安全国产化,建设周期短、维护费用低;2.热能利用率高,经济效益显著;3.以硫化氢酸性气体为燃料,为废硫酸裂解提供热能,节省常规燃料气的消耗,不但处理了废硫酸,又处理了酸性废气,实现“以废治废”。

图2 废硫酸与硫化氢酸性气联合回收装置工艺流程
3 H2S的检测方法
由于H2S应用领域比较广泛,所以根据气体浓度的不同采用不同的检测方法。
3.1 亚甲基蓝分光光度法
龙金满[8]介绍了一种使用亚甲基蓝分光光度法分析大气中H2S的方法。由于H2S在大气中不稳定,所以使用氢氧化镉、氢氧化钠溶液吸收,生成硫化镉沉淀。并且加入保护剂(d-半乳糖),保证硫化镉沉淀不受光照影响。吸收液在盐酸溶液的作用下与对氨基-N,N-二甲基苯胺、三氯化铁生成亚甲基蓝,经过分光光度计测定吸光度值,计算出H2S浓度值。H2S与Cd(OH)2反应方程式如式(4):
H2S+Cd(OH)2=CdS↓+2H2O
(4)
魏阳吉等人[9]也以此法检测葡萄酒中H2S浓度。将氮气作为载气把葡萄酒中的H2S带出,以图3所示方法得到亚甲基蓝,测量亚甲基蓝溶液吸光度,得出H2S与吸光度的线性关系,计算出H2S浓度。

图3 S2-在酸性和Fe3+条件下和对氨基-N,N-二甲基苯胺的反应机理
亚甲基蓝分光光度法对实验设备要求低、试验原料易得、成本低、操作容易,但适用范围较小。
3.2 电化学分析法
徐后传[10]介绍了一种使用丝网印刷电极检测H2S的方法。在丝网印刷电极释放连续脉冲电压,使含有Fe3+/Fe2+的溶液发出氧化还原信号,加入S2-(H2S),由于氧化还原反应使得S2-被氧化成S单质,溶液中的Fe3+被还原成Fe2+,随着反应进行S单质增多并沉淀在丝网印刷电极表面,Fe3+减少,导致氧化还原信号减少,根据信号减少差值计算出S2-的含量(反应原理如图4所示)。H2S浓度在3.16×10-6~1×10-3M时,最低检测限为5.889×10-8M。

图4 丝网印刷电极H2S反应原理
姚磊明等人[11]介绍了一种使用石蜡油碳糊电极检测大气中H2S的方法。将石蜡油碳糊电极放入含有HS-离子的溶液,通过每次测量的电位最低值与HS-浓度值呈线性响应(范围为2.0×10-7~3.0×10-6mol/L)得出检出限为1.0×10-7mol/L。
杜宝中等人[12]介绍了一种使用锑电极测量废水中硫化物的方法。配制硫化物抗氧化缓冲液时加入硫化钠溶液(防止硫化钠氧化),然后使用硫电极和锑电极测定溶液电位值,得出线性范围为5.0×10-7~1.0×10-2mol/L。此方法响应速度快,消除了使用甘汞电极引起的电位漂移,使得检测下限降低。
电化学法可以在实验室自制、易于操作、价格低廉,不仅可以检测H2S气体,还可以用于各类水样中硫化物的测定。
3.3 气相色谱法
李新华等人[13]介绍了一种使用火焰光度检测器(FPD)测量大气中痕量H2S的方法。使用GC-7890II型气相色谱仪,以Chromosorb G作为吸附剂,液氮作为冷冻剂,低温吸附大气中痕量H2S,在经过解析后,将H2S通入检测器内检测,检出限为0.192 ng/L。
李玉琴等人[14]介绍了一种使用热导池检测器(TCD)测量空气中H2S的方法。使用GC-9A气相色谱仪,以高纯氦作为载气,流速为40 mL/min。在注射器抽洗空气后直接进样,用检测器测定,检出限为1×10-3μg/mL。
郭启芬等人[15]使用便携式气相色谱仪(Scentograph PLUS II)测定空气样品中H2S。而且还进行了与硝酸银目视比色、亚甲基蓝分光光度、传统气相色谱法的采样时间和最低检出浓度对比,表明便携式气相色谱法优于其他三种方法。
姚华群[16]介绍了一种使用脉冲火焰光度检测器(PFPD)测定天然气中H2S的方法。使用Varian CP3800气相色谱仪,用样品置换定量管进样分析,对H2S进行有效的分离和检测。
气相色谱法精密度高、简便、重现性好、灵敏度高、回收率高、样品采集时间短、对于气态H2S检测效果好。
3.4 光谱分析法

颜金良等人[18]介绍了一种采用顶空冷原子吸收法测定空气中H2S的方法。将H2S标准液加入含有汞的标准液中,用移液管取出放入汽化瓶,再加入氯化亚锡,经振摇后,使用注射器抽取汽化瓶上部空气,注入测汞仪(F-732V)检测,得出H2S与吸光度线性关系,计算出H2S浓度。
吴解明等人[19]介绍了一种使用气相分子吸收光谱法测定废水中硫化物的方法。在样品中加入醋酸锌,S2-与醋酸锌反应生成硫化锌沉淀,用滤膜将沉淀过滤,去除大多数的干扰成分,再加入磷酸溶解硫化物沉淀并分解成H2S气体。根据H2S气体对锌空心阴极灯的吸光值,通过校准曲线计算硫化物的含量,直接测定检测限为0.05 mg/L,样品沉淀后测定检测限为0.005 mg/L。反应方程式如式(5)~(6):
(CH3COO)2Zn+S2-=2CH3COO-+ZnS↓
(5)
3ZnS+2H3PO4=Zn3(PO4)2+3H2S↑
(6)
光谱分析法缩短了原有采样时间、抗干扰能力强、操作简便快捷、结果准确。
3.5 快速检测法
史宝成等人[20]使用吸附层析柱测定水中硫化物。首先硼氢化钾在酸性条件下发生化学反应生成氢气,水中硫化物在酸性作用下生成H2S,并通过氢气带入吸附层析柱中,通过显色比长来计算出样品的浓度。定性检出浓度为0.05 mg/L,定量检测最低浓度为0.1 mg/L。这种方法不受样品水中其他杂质的影响,并且检测仪结构简单、分析时间短,适用于现场快速、应急检测。反应方程式如式(7)~(9):
(7)
S2-+2H+→H2S↑
(8)
Pb2++S2-→PbS
(9)
成强[21]介绍了一种使用经过整理的天然纺织品检测H2S的方法。用氯磺酸和硝酸银对硅胶进行改性,制备功能材料Ag-SSA。通过对Ag-SSA检测发现其对硫离子有明显的变色反应。使用超声整理的方法将Ag-SSA整理到纯棉织物上,实现纺织品对H2S的检测。最低检测理论值为320 μg/kg。这种方法使纺织品具有检测H2S的功能,具有便携性和可穿戴性的优点。
3.6 荧光探针法
谭丽[3]介绍了一种使用荧光增强型探针CC-H2S检测H2S的方法。CC-H2S由于氯原子的重原子效应,没有荧光,但与H2S发生取代反应后,经测试发现荧光增强,可以实现对H2S的检测(反应原理如图5所示),检测最低浓度为1.48 μM。
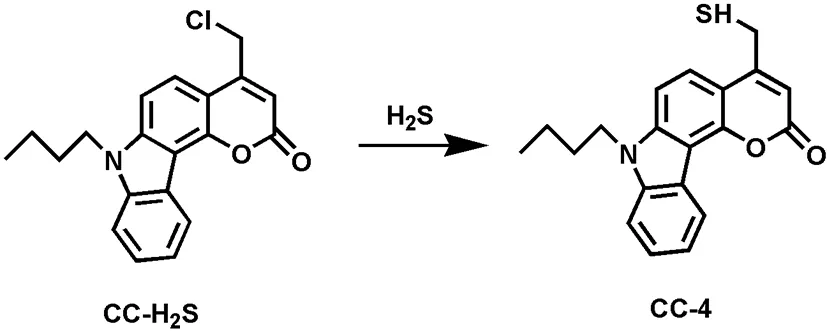
图5 探针CC-H2S与H2S反应机理

谢子恒[23]介绍了一种使用比色化学探针—PAN-Zn2+检测H2S含量的方法。PAN-Zn2+与H2S反应生成ZnS和PAN,溶液由粉红色变成黄色,达到检测H2S目的(反应原理如图6所示)。检测限为1.9 μM。

图6 PAN-Zn2+检测H2S的反应机理
荧光探针法具有容易制造、检测便捷、准确可靠、灵敏度高的特点。
ZHAO等人[24]设计了一种H2S荧光探针(Flu-N3),检测限为0.031 μM(反应原理如图7所示),并且在细胞成像和小鼠活体实验中证明可以应用于检测生物系统中的H2S。

图7 探针Flu-N3检测H2S原理
解畅等人[25]设计了一种荧光共振能量迁移-分子内电荷转移(FRET-ICT)双反应的H2S荧光探针(反应原理如图8所示),检测限为40 nmol/L,并且可以检测活细胞中的H2S。

图8 探针识别点位
人体细胞也能产生浓度异常的H2S,由于H2S属于剧毒物质,所以会引起许多常见疾病。传统检测方法由于对样品处理复杂,所以不适合对内源性H2S进行检测[2]。因为荧光探针对生物体基本无损伤、识别专一、灵敏度高的特点,这种方法广泛应用于生物系统中H2S的检测。
4 结 语
现如今国家经济快速发展,各行业对于硫化氢的需求也日渐增加,以水和硫磺作为原料制备硫化氢的制法工艺流程短、产品质量稳定、能够满足市场对不同纯度硫化氢的需求。在其他工业领域中会排放硫化氢废气,由于国家对环保管控日益严格,对于废硫化氢处理的需求将会越来越大,将硫化氢废气作为燃料,可以降低装置运行成本,使硫资源循环利用,节能降耗效果显著。由于硫化氢在各行业应用广泛,所以现有检测H2S的方法有很多。传统的分析方法已广泛用于硫化氢的检测,但是荧光探针法的快速、高稳定性等特点使其适用于内源性硫化氢的检测,因此使用荧光探针法检测内源性硫化氢是当今社会的主流。
