结缔组织病相关肺动脉高压的临床特点及生存分析
2022-10-13樊丽娟李闪闪刘佳佳贺世豪李天方
樊丽娟,李闪闪,王 衍,刘佳佳,贺世豪,李天方
郑州大学第一附属医院风湿免疫科 郑州 450052
肺动脉高压(pulmonary arterial hypertension,PAH)是结缔组织病(connective tissue diseases,CTDs)的严重并发症,也是导致CTDs患者死亡的主要原因之一。在美国与欧洲,CTDs相关肺动脉高压(CTDs-PAH)最常与系统性硬化(systemic sclerosis,SSc)相关,患病率为10%~12%[1-3]。然而,亚洲国家进行的队列研究[4-5]显示,系统性红斑狼疮(systemic lupus erythematosus,SLE)是CTDs-PAH最常见病因,其次是原发性干燥综合征(primary Sjogren′s syndrome,pSS)和混合性结缔组织病(mixed connective tissue disease,MCTD)。这些差异提示亚洲CTDs-PAH患者的特点和预后可能与西方国家有所不同。有研究[6-7]表明,与特发性PAH患者相比,CTDs-PAH患者的治疗效果及预后通常较差。目前,大部分研究数据来自于西方国家,而亚洲国家关于CTDs-PAH的研究资料缺乏[5,8]。目前,SLE、MCTD、pSS及SSc导致PAH生存率差异的机制尚不完全清楚,不良预后的危险因素也未明确。在本研究中,作者分析了与这4种CTDs相关的PAH患者的基线临床特征和实验室数据,并评估这些差异与患者生存的关联性。
1 对象与方法
1.1 研究对象2016年1月至2021年6月在郑州大学第一附属医院接受随访的PAH伴SLE、MCTD、SSc或pSS患者均纳入本研究。CTDs的类型在登记时定义如下:不同CTDs的诊断采用美国风湿病学会(American College of Rheumatology,ACR)、欧洲风湿病联盟(European League against Rheumatism,EULAR)和美国欧洲共识组(American European Consensus Group,AECG)提出的标准[9-12]。诊断为2个或以上CTDs的患者被排除在分析之外。该研究获得郑州大学第一附属医院伦理委员会批准,受试者对该研究知情并同意。PAH定义为静息状态下平均肺动脉压(mean pulmonary artery pressure,mPAP)升高≥25 mmHg(1 mmHg=0.133 kPa),肺动脉楔压≤15 mmHg,右心导管测得肺血管阻力增加或根据超声心动图测量的收缩期肺动脉压(systolic pulmonary artery pressure,sPAP)>35 mmHg[13]。对sPAP进行分级,≤50 mmHg为轻度,50 mmHg
1.2 数据收集通过标准评估表收集人口统计学数据、CTDs相关自身抗体、临床特征和治疗方案。实验室结果包括全血计数和肝功能酶、肌酐、补体和N端脑钠肽前体(NT-proBNP)水平等。由于RHC的有创性,且仅有少数患者通过RHC确诊,因此作者收集PAH患者接受经胸超声心动图检查的百分比信息。记录PAH患者发病180 d内各种药物的使用情况:CTDs治疗包括糖皮质激素 (glucocorticoids,GCs)、免疫抑制剂等;PAH特异性治疗包括内皮素-1受体拮抗剂(endothelin-1 receptor antagonists,ERAs)、磷酸二酯酶5型(phosphodiesterase type 5,PDE5)抑制剂等。治疗方案由临床医生根据指南及药物可获得性,并考虑患者的经济能力后制定。同时记录诊断PAH后患者的生存时间。
1.3 随访所有患者每3~6个月至我院进行随访。通过与主治医生的沟通或患者家庭成员的陈述确定患者是否死亡及其死亡的原因,纳入因自身免疫性疾病相关肺动脉高压死亡的患者。以首次经胸超声心动图诊断PAH至死亡记录日期或2021年6月(审查日期)之间的时间间隔为生存时间。无失访患者。
1.4 统计学处理采用SPSS 26.0及R语言对数据进行分析。对连续变量进行正态性检验,不符合正态分布的资料以M(P25,P75)表示,进行Mann-WhitneyU检验或Kruskal-Wallis检验。分类资料以数量和百分比(%)表示,应用χ2检验进行比较。生存评估采用Kaplan-Meier分析,应用Log-rank检验进行比较。生存分析曲线交叉时,采用Landmark法比较两组生存率。通过Cox比例风险回归模型确定PAH诊断后死亡风险增加的相关因素,并对单因素分析选择的变量进一步进行多因素分析,结果以HR(95%CI)表示。检验水准α=0.05。
2 结果
2.1 研究人群一般资料共计179例CTDs-PAH患者被纳入研究。所有患者的基线人口学资料、临床特征、治疗方案、实验室检查和影像学资料见表1和表2。系统性红斑狼疮(47.5%)是CTDs-PAH最常见的原发疾病,其余依次是混合性结缔组织病(26.8%)、系统性硬化症(13.4%)和干燥综合征(12.3%)。研究期间,有10例患者因CTDs-PAH死亡。

2.2 生存分析对患者进行5 a的随访,共有10名患者死亡。无失访患者。诊断CTDs-PAH后患者的1 a、3 a和5 a生存率分别为99.4%、88.7%和80.9%(图1)。其中,SLE-PAH 1 a、3 a和5 a生存率分别为100%、97.8%和97.8%;MCTD-PAH为100%、87.4%和72.8%;pSS-PAH为95.0%、95.0%和76.0%;SSc-PAH为100%、71.1%和71.1%(图1)。

图1 不同CTDs-PAH患者的生存曲线
2.3 CTDs-PAH患者的单因素和多因素Cox回归分析结果纳入变量的赋值及纳入方式:肺间质纤维化(0=无;1=有),雷诺现象(0=无;1=有),ANA 滴度(1=1∶100;2=1∶320;3=1∶640;4=1∶1 000;5=1∶3 200),抗U1RNP抗体(0=阴性;1=阳性),肺动脉压分级(1=轻度;2=中度;3=重度),心包积液(0=无;1=有),NYHA 分级(1=1级;2=2级;3=3级;4=4级),糖皮质激素(0=未应用;1=应用),免疫抑制剂(0=未应用;1=应用),上述指标均采用直接纳入法;特异性药物(0=未用药;1=ERAs;2=PDE5抑制剂;3=ERAs+PDE5抑制剂)采用哑变量化后纳入,参照=0。详见表3和图2。由表3可知,患者诊断CTDs-PAH时的年龄[HR(95%CI)为1.079( 1.016~1.145),P=0.013]、肺动脉压[HR(95%CI)为1.043(1.019~1.066),P<0.001)、糖皮质激素的应用[HR(95%CI)为5.929(1.101~31.930),P=0.038) 是死亡风险增加的危险因素。
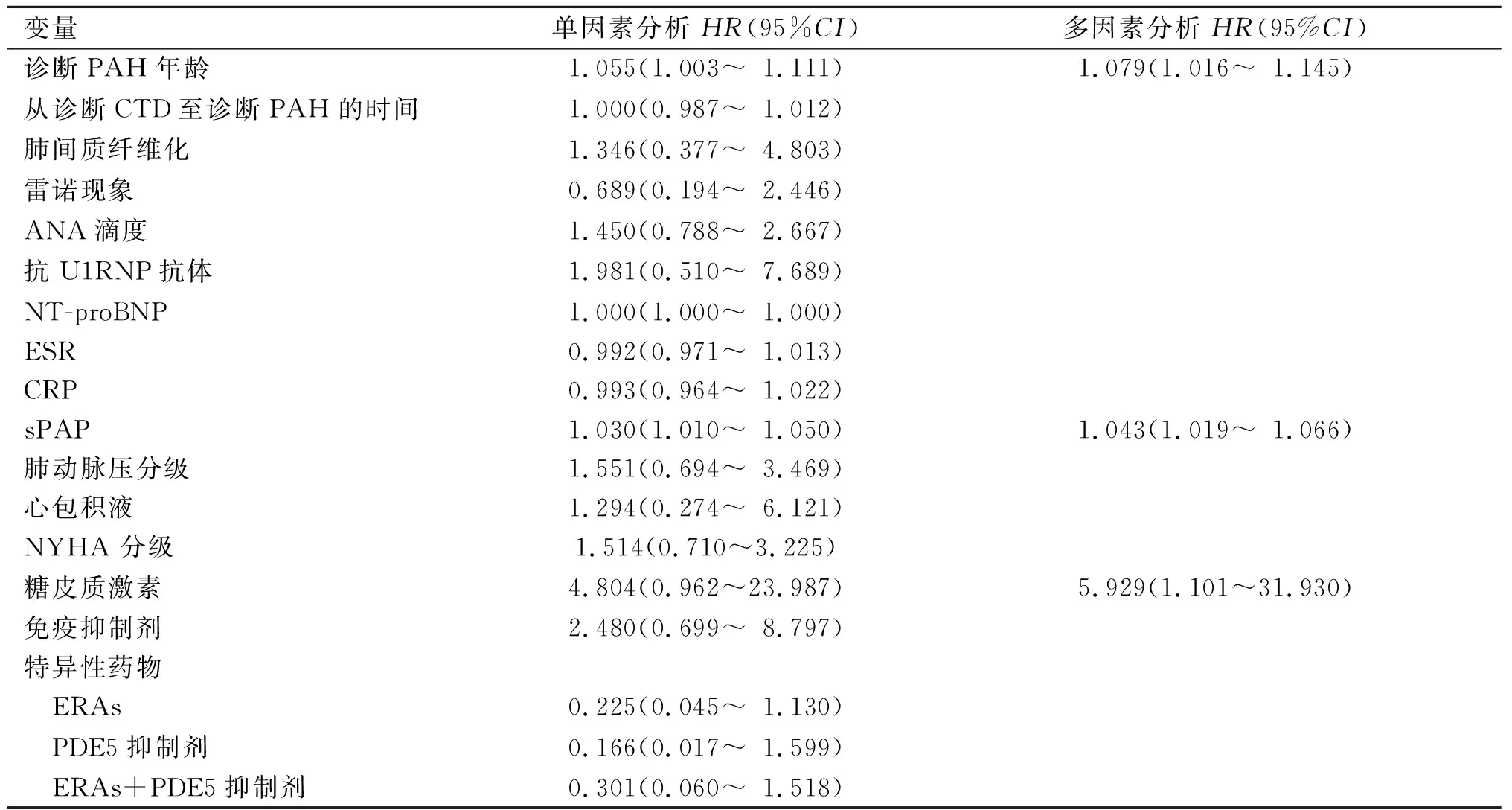
表3 CTDs-PAH患者死亡的单因素和多因素Cox回归分析结果
由图2可知,随访时间≤20个月时,各组累积生存率差异无统计学意义,而随访时间>20个月时,SLE-PAH组累积生存率优于MCTD-PAH组(P=0.040)(图2A)。随访时间>24个月时,SLE-PAH组累积生存率优于SSc-PAH组(P=0.019)(图2C)。其余各组患者的累积生存率差异无统计学意义。

1:SLE-PAH;2:MCTD-PAH;3:pSS-PAH;4:SSc-PAH。A:SLE-PAH和MCTD-PAH患者累积生存率的比较;B:SLE-PAH和pSS-PAH患者累积生存率的比较;C:SLE-PAH和SSc-PAH患者累积生存率的比较;D:MCTD-PAH和pSS-PAH患者累积生存率的比较;E:MCTD-PAH和SSc-PAH患者累积生存率的比较;F:pSS-PAH和SSc-PAH患者累积生存率的比较。采取Landmark法比较两组的生存率,P1为曲线交叉前的生存率的统计差异的P值;P2为曲线交叉后的生存率的统计差异的P值
3 讨论
PAH是CTDs的严重并发症之一,可导致患者死亡。不同国家CTDs-PAH患者的构成不同,SSc-PAH在西方国家较为常见,而在亚洲,尤其是中国,以SLE-PAH最为常见。作者的研究证实,在我国CTDs-PAH患者中,SLE-PAH和MCTD-PAH的发病率更高,这与日本的一项队列研究[5]结果一致。最近,我国台湾的一项研究[4]显示,SLE是CTDs-PAH的主要原因,其次是SSc、pSS。而在欧洲开展的一项前瞻性的基于互联网的对波生坦上市后的监测结果显示,SSc(75%)是CTDs-PAH的最常见原因,而SLE-PAH(9%)仅占CTDs-PAH患者的一小部分[14]。亚太地区人群中SLE的患病率远高于西方人群,这可能是造成这种差异的原因[15]。此外,MCTD的诊断仍具有一定争议,根据2013年ACR/EULAR发布的SSc新分类标准,大多数MCTD病例可被归类为SSc[10,16],这在美国和欧洲的队列中均有所显示。在作者的研究中,在诊断PAH时,SLE-PAH患者以年轻女性为主,与其他CTDs-PAH相比,抗U1RNP抗体检测阳性的可能性较低,这与Chung等[1]的研究结果一致。而且,雷诺现象和肺间质纤维化在SLE-PAH患者中较为少见[1]。作者的研究显示CTDs-PAH诊断的平均年龄为42岁,低于西方国家报道的49~56岁[1,17]。这种差异可能与作者研究中CTDs-PAH患者中SLE和MCTD发病率较高有关。此外,不同CTDs-PAH的种族分布差异的机制目前尚不清楚,这可能与遗传和环境因素密切相关。
早期发现和治疗干预对于提高PAH患者的生存率具有重要意义[18]。作者发现患者首次诊断CTDs-PAH的年龄、确诊时的肺动脉压以及糖皮质激素的应用是引起患者死亡的危险因素,这与我国北京协和医院的一项队列研究[19]一致。作者没有观察到使用PAH特异性药物治疗对于短期预后的改善,但这可能与患者数量较少并且随访时间相对较短有关。考虑到随患者病情变化,在随访过程中治疗方案的个体化,采用病例对照研究设计或进行更复杂的分析(如时间依赖的Cox回归)来准确评估这些药物的影响会更合适。为了更好地实现早发现、早治疗及改善预后,筛查PAH高危人群是至关重要的。因此,建议每年对这类患者进行超声心动图检查[20]。通过相关的前瞻性研究,以确定并预测亚洲CTDs患者PAH发生的危险因素也是有必要的。
作者的研究表明,与近期其他亚洲及西方国家的相关研究相比,我国CTDs患者的生存率更高[2,4-5,19]。作者猜测,这些差异可能与总体人群中基础CTDs、不同的样本量和随访时间有关。目标研究人群的异质性、PAH的不同研究设计或定义、不同筛查算法或诊断工具的使用也可能造成结果的偏差。通过比较不同CTDs-PAH的5 a累积生存率,作者发现SLE-PAH患者的短期累积生存率与其他CTDs-PAH患者差异无统计学意义。而随访时间>24个月时,SLE-PAH患者的累积生存率优于其他CTDs-PAH(MCTD-PAH,SSc-PAH)患者,这与其他学者[7]的研究结果相一致。在作者的研究中,SLE-PAH患者与pSS-PAH患者的5 a累积生存率差异无统计学意义,pSS-PAH患者与MCTD-PAH患者和SSc-PAH患者5 a累积生存率差异亦无统计学意义;但法国的一项研究纳入了9例pSS-PAH患者,3 a生存率为83%,低于作者的结果[21]。作者推测这可能与pSS-PAH患者的数量较少有关,确定pSS-PAH的真实生存率以及阐明法国pSS-PAH患者的生存率远远低于我国pSS-PAH患者的原因是困难的。延迟诊断可能是pSS-PAH预后较差的原因。此外,个体异质性导致患者对免疫抑制治疗的反应并不相同。不同CTDs的发病机制存在差异亦可能是造成结果差异的原因,其中,炎症和免疫系统失调在SLE-PAH发病机制中起主要作用[22-23]。
作者的研究有一些局限性:首先,作者选择的CTDs-PAH患者是通过综合经胸超声心动图及血液实验室数据诊断,并非所有CTDs-PAH的患者都得到了RHC的确诊,这导致与预后相关的血流动力学参数(如mRAP、mPAP、心脏指数、肺血管阻力等)的缺乏。有研究[24]表明,pSS-PAH的血流动力学参数更差,这在一定程度上能够对pSS-PAH患者预后较差作出解释。因此,在考虑作者的研究结果时,慎重结合CTDs-PAH患者进行RHC的百分比。其次,对于纳入本研究的CTDs的疾病活动性缺乏统一的评估手段。患者心功能(NYHA分级)评估的主要根据是患者的描述及临床经验,可能会对结果造成一定偏倚。此外,炎性肌病患者没有纳入作者的研究。最后,结合患者实际经济情况及意愿,药物的选择具有限制性:目前主要的临床药物为安立生坦和西地那非,多种PAH特异性靶点治疗,如依前列醇、伊洛前列素、马西替坦等药物没有被考虑,这可能会对患者的预后产生影响。
综上,作者对中国CTDs-PAH患者进行了分析,结果显示,SLE-PAH最为常见,且其5 a累积生存率优于其他CTDs-PAH。患者诊断为CTDs-PAH时的年龄、肺动脉压力数值及糖皮质激素的应用是死亡的影响因素。但仍需要进一步的研究来确定适合不同基础CTDs患者的治疗策略,从而改善患者预后,提高其生活质量。
