酸浆苦味A通过抗炎和抗凋亡途径延缓骨关节炎的进展
2022-10-13鲁锐瞿云昆杨卿何琰泽梁爽
鲁锐 瞿云昆 杨卿 何琰泽 梁爽
骨关节炎是一种常见的关节退行性疾病,主要特征是关节软骨退变、关节间隙变窄、软骨下骨骨质增生硬化和滑膜炎,临床表现为慢性疼痛和功能障碍[1]。关节软骨由细胞外基质和软骨细胞构成。细胞外基质的维持依赖于软骨细胞合成代谢和分解代谢的动态平衡[2]。蛋白聚糖(ACAN)和二型胶原(COL2A1)是软骨细胞合成代谢中两个至关重要的蛋白,合成代谢的减弱预示着软骨的降解,因此增强软骨细胞合成代谢有利于细胞外基质的维持。此外,基质金属蛋白酶13(MMP13)、Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶(ADAMTS5)是软骨细胞分解代谢的指标,其表达量的增加会加速细胞外基质的降解,引起软骨退变[3]。
骨关节炎发病机制还未完全明了,研究认为,骨关节炎与炎症反应、凋亡等因素密切相关,这些因素能介导软骨细胞外基质合成代谢和分解代谢的失衡,进而引起细胞外基质的降解和破坏,导致骨关节炎的发生和发展[4]。抗炎反应和促炎反应的失衡可导致软骨细胞外基质稳态的失衡,促炎因子能抑制软骨细胞的合成代谢,增强软骨细胞的分解代谢[5]。在骨关节炎的众多炎症因子中,白细胞介素-1β(IL-1β)被认为是导致骨关节炎进展最重要的促炎因子之一[6]。因此,在骨关节炎的基础研究中,IL-1β造就的软骨细胞炎症模型被认为是骨关节炎领域成熟的体外模型,且降低软骨细胞的炎症反应水平被认为有利于延缓骨关节炎的进展。诱导型一氧化氮合酶(iNOS)、环氧合酶2(COX-2)、白细胞介素6(IL-6)等促炎因子也在骨关节炎中发挥重要作用[7]。此外,关节软骨的退变除了与细胞外基质降解有关之外,还与软骨细胞的凋亡密切相关[8]。细胞生理状态的稳定有赖于促凋亡和抗凋亡的平衡,抗凋亡蛋白[B淋巴细胞瘤-2(Bcl-2)]和促凋亡蛋白[Bcl-2相关X蛋白(Bax)]的失衡同样是引起软骨退变的机制之一。
酸浆苦味A(Physalina,PA)是从灯笼果中提取的化合物(C28H30O10),研究发现其具备抗炎、镇痛、镇咳、抗真菌等作用[4,9],在不同的病理生理条件下能介导多种信号通路,比如核因子E2 相关因子2(Nrf2)[10]、丝裂原活化蛋白激酶(MAPK)[11]、核因子-κB(NF-κB)[12]等信号通路。虽然抗炎镇痛药的使用是目前治疗骨关节炎疾病中主要的治疗措施,但其所引发的心血管和胃肠道风险越来越受到广大学者的关注。寻找替代的、副作用小的药物成为一种趋势。在骨关节炎的机制研究中,天然化合物逐渐走入学者的视野。前期实验结果发现,PA能通过抑制MAPK 和NF-κB 信号通路发挥保护关节软骨的作用[13],本研究旨在进一步研究PA 在凋亡途径对软骨细胞的影响。
材料与方法
一、主要试剂和仪器
酸浆苦味A(CAS No.23027-91-0)购自中国ChemFaces。培养基为HyClone DMEM/F12 培养基(HyClone,美国),血清为Bioind胎牛血清(BioInd,澳大利亚),胰蛋白酶-EDTA(Gibco,美国),Ⅱ型胶原酶(索莱宝公司,中国)。小鼠源IL-1β购自美国R&D 公司;细胞活力检测试剂盒(CCK-8 kit),RIPA裂解液、蛋白酶抑制剂、磷酸酶抑制剂、ADAMTS5抗体(货号:A02802-1)、山羊抗兔和抗鼠二抗均购自武汉博士德公司;GAPDH 抗体(货号:60004-1-Ig),MMP13(货号:18165-1-AP),ACAN(货号:13880-1-AP),COL2A1 抗体(货号:28459-1-AP)均购自中国Proteintech公司;iNOS抗体(货号:13120)、COX-2抗体(货号:12282)、IL-6(货号:12912)、Bax 抗体(货号:2772)、Bcl-2 抗体(货号:3498)均购自美国CST公司。酶标仪、蛋白印迹电泳仪、转膜仪和凝胶成像系统均购自美国Bio-Rad公司。
二、小鼠软骨细胞的分离和培养
5 日龄的C57BL/6 乳鼠购自武汉鼠来宝生物科技有限公司。将乳鼠处死后放于75%的酒精中浸泡消毒后,在生物安全柜中使用显微镊取出乳鼠的膝关节软骨颗粒,注意清除掉软骨颗粒周围的关节囊、滑膜组织和肌腱。将软骨颗粒剪碎并移至无菌的含0.25%的胰蛋白酶-EDTA EP 管中,在含5% CO2的37 ℃细胞敷育箱中敷育30 min。随后1 500 r/min离心5 min,去掉胰蛋白酶,加入0.2%的Ⅱ型胶原酶,在37 ℃的杂交炉中继续消化6~8 h。随后1 500 r/min离心5 min,去掉Ⅱ型胶原酶,将软骨细胞重悬混匀后种在T25 细胞培养瓶中,细胞培养液为含10%Bioind 胎牛血清的HyClone DMEM/F12 培养基。原代软骨细胞被用于随后的细胞实验。所有动物操作均经华中科技大学同济医学院实验动物伦理委员会批准。
三、细胞活力检测
将软骨细胞种于96 孔板中(5 000~10 000 个细胞/孔),24 h 后细胞贴壁,用不同浓度的PA(0、2.5 μmol/L、5 μmol/L、10 μmol/L)、IL-1β(5 ng/mL)、不同浓度的PA(0,2.5 μmol/L、5 μmol/L、10 μmol/L)联合IL-1β(5 ng/mL)分别干预软骨细胞24 h。随后,去掉旧培养基,每孔加入100 μL新培养基和10 μL CCK-8 试剂,在37 ℃下避光敷育1~4 h,使用酶标仪在450 nm处检测各组细胞的吸光度。
四、软骨细胞总蛋白提取
将原代软骨细胞种在6 孔板中,待细胞完全贴壁且细胞融合率达到70%时,使用IL-1β(5 ng/mL)单独或联合不同浓度的PA(2.5 μmol/L、5 μmol/L、10 μmol/L)进行干预,具体分组为对照组、IL-1β组、IL-1β+PA(2.5 μmol/L)组、IL-1β+PA(5 μmol/L)组、IL-1β+PA(10 μmol/L)组。待软骨细胞干预24 h后,进行细胞总蛋白的提取。细胞总蛋白提取步骤如下:冰上操作,去掉6孔板中的培养基,PBS漂洗3次并滤纸吸净残留液体后,每孔中加入100 μL细胞裂解液(由RIPA裂解液、蛋白酶抑制剂、磷酸酶抑制剂按100∶1∶1的比例配制所得),冰上裂解15 min后蛋白刮刮下细胞及裂解液混合物并收集至1.5 mL EP管中。经超声裂解后,14 000 r/min离心20 min,将上清计量并收集到新的1.5 mL EP管中,测量蛋白浓度后,加入蛋白上样缓冲液,混匀后置于100 ℃金属浴中变性5 min,随后蛋白样品放置于-20 ℃中保存。
五、Western blot检测蛋白表达
采用Western blot检测ACAN、COL2A1、MMP13、ADAMTS5、iNOS、COX-2、IL-6、Bcl-2、Bax 蛋白的表达。将等质量等体积的蛋白样品按组别加入到上样孔中,恒压80 V 在浓缩胶中电转30 min 后,改为恒压120 V 继续电转至所需目的蛋白所在区间显现。随后采用湿转法在275 mA 的恒流作用下进行转膜。转膜结束后将聚偏氟乙烯(PVDF)膜放置于5%的脱脂牛奶中封闭1 h。随后裁切条带敷一抗,在4 ℃条件下敷育过夜。TBST 洗膜,10 min/次×3 次;随后在室温条件下敷育二抗1 h,继续TBST 洗膜,10 min/次×3 次。最后均匀涂抹ECL 显色发光液于PVDF 条带上,在凝胶成像系统中进行蛋白曝光成像分析。
六、统计学分析
本实验中所有数据均来自于三次独立的实验,以均数±标准差()表示,采用one-way ANOVA 对蛋白灰度值进行统计学分析。P<0.05 为差异具有统计学意义。
结 果
一、PA不影响软骨细胞的活力
实验研究发现,在单独给予不同浓度的PA(0、2.5 μmol/L、5 μmol/L、10 μmol/L)或联合IL-1β(5 ng/mL)干预24 h 后,软骨细胞的活力没有受到明显的影响,表明实验浓度下的PA 和IL-1β对软骨细胞没有明显的毒性(P>0.05,图1)。因此,2.5 μmol/L、5 μmol/L、10 μmol/L的PA和5 ng/mL的IL-1β被用于后续的实验研究。

图1 PA和IL-1β对小鼠软骨细胞活力的影响 a:单独给予不同浓度的PA对软骨细胞活力无明显改变(P>0.05);b:不同浓度的PA联合IL-1β对软骨细胞活力无明显改变(P>0.05)
二、PA 上调IL-1β诱导的软骨细胞合成代谢标志蛋白的表达
如图2 所示,相比于对照组,IL-1β组能够抑制软骨细胞合成代谢关键蛋白ACAN 和COL2A1的表达(P<0.05);相比于IL-1β组,IL-1β+PA(2.5 μmol/L)组、IL-1β+PA(5 μmol/L)组、IL-1β+PA(10 μmol/L)组中合成代谢的关键蛋白(ACAN、COL2A1)表达水平逐渐升高(P<0.05),且呈浓度依赖性。这表明IL-1β能抑制软骨细胞的合成代谢,而不同浓度的PA(2.5 μmol/L、5 μmol/L、10 μmol/L)能逆转IL-1β对软骨细胞合成代谢的抑制效应。
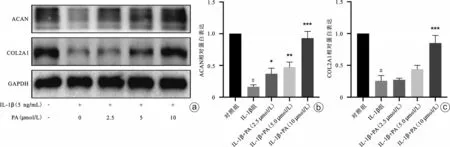
图2 PA对IL-1β诱导的软骨细胞合成代谢的影响 a:Western blot结果;b、c:蛋白灰度值定量分析柱状图。与对照组比较,#P<0.05;与IL-1β组比较,*P<0.05,**P<0.01,***P<0.001
三、PA 下调IL-1β诱导的软骨细胞分解代谢标志蛋白的表达
Western 蛋白印迹结果显示,相比于对照组,IL-1β能增强软骨细胞的分解代谢水平,即上调软骨分解代谢标志蛋白(MMP13和ADAMTS5)的表达(P<0.05)。相比于IL-1β组,IL-1β+PA(2.5 μmol/L)组、IL-1β+PA(5 μmol/L)组、IL-1β+PA(10 μmol/L)组中分解代谢的关键蛋白MMP13和ADAMTS5的表达水平出现了下调(P<0.05),并呈现浓度依赖性。这表明IL-1β能增强软骨细胞的分解代谢,而不同浓度的PA(2.5 μmol/L、5 μmol/L、10 μmol/L)能逆转IL-1β对软骨细胞分解代谢的增强效应(图3)。

图3 PA对IL-1β诱导的软骨细胞分解代谢的影响 a:Western blot结果;b、c:蛋白灰度值定量分析柱状图。与对照组比较,#P<0.05;与IL-1β组比较,*P<0.05,**P<0.01,***P<0.001
四、PA抑制IL-1β诱导的软骨细胞炎症反应
如图4,与对照组比较,IL-1β组中的炎性蛋白(iNOS、COX-2、IL-6)的表达水平在IL-1β刺激后升高(P<0.05);相比于IL-1β组,iNOS、COX-2、IL-6等炎性蛋白的表达水平在IL-1β+PA(2.5 μmol/L)组、IL-1β+PA(5 μmol/L)组、IL-1β+PA(10 μmol/L)组中呈现下降趋势,并呈浓度依赖性(P<0.05),表明PA在软骨细胞中能抑制IL-1β引起的炎性反应。这说明IL-1β能增强软骨细胞的炎症反应,而不同浓度的PA(2.5 μmol/L、5 μmol/L、10 μmol/L)能抑制IL-1β导致的炎症增强效应。
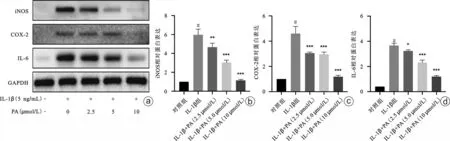
图4 PA对IL-1β诱导的软骨细胞炎症反应的影响 a:Western blot结果;b~d:蛋白灰度值定量分析柱状图。与对照组比较,#P<0.05;与IL-1β组比较,*P<0.05,**P<0.01,***P<0.001
五、PA抑制IL-1β诱导的软骨细胞凋亡
相比于对照组,在IL-1β组中可见IL-1β抑制了Bcl-2 蛋白的表达。而相比于IL-1β组,IL-1β+PA(2.5 μmol/L)组、IL-1β+PA(5 μmol/L)组、IL-1β+PA(10 μmol/L)组中Bcl-2蛋白的表达水平呈现一定程度的回升;对于Bax蛋白,相比于对照组,在IL-1β组中可见IL-1β能引起Bax蛋白的表达上调,而相比于IL-1β组,IL-1β+PA(2.5 μmol/L)组、IL-1β+PA(5 μmol/L)组、IL-1β+PA(10 μmol/L)组中的Bax蛋白表达未见明显变化(图5 a)。但综合分析显示,相比于对照组,Bcl-2/Bax的比值在IL-1β组下降,表明IL-1β能促进软骨细胞的凋亡发生(P<0.05);而相比于IL-1β组,Bcl-2/Bax 的比值在IL-1β+PA(2.5 μmol/L)组、IL-1β+PA(5 μmol/L)组、IL-1β+PA(10 μmol/L)组中上升,表明2.5 μmol/L、5 μmol/L、10 μmol/L 的PA能抑制IL-1β诱导的软骨细胞凋亡(P<0.05),表明PA具有抗凋亡作用(图5 b)。
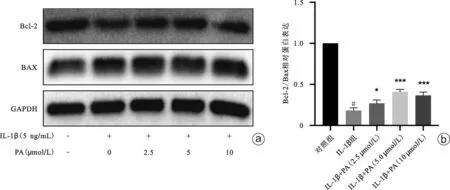
图5 PA对IL-1β诱导的软骨细胞凋亡水平的影响 a:Western blot结果;b:蛋白灰度值定量分析柱状图。与对照组比较,#P<0.05;与IL-1β组比较,*P<0.05,***P<0.001
讨 论
骨关节炎是以关节软骨损害为主要病理改变的慢性退行性疾病,多见于老年人,以疼痛和功能障碍为主要症状。该疾病病程长且多为进行性加重,治疗周期长,严重影响病人的生活质量,给社会造成巨大的经济负担[14]。
一、软骨细胞合成代谢和分解代谢在关节软骨中的作用
在软骨的合成代谢酶中,ACAN和COL2A1是主要的细胞外基质蛋白[15]。ACAN是软骨细胞合成代谢标志物,是软骨中的主要蛋白聚糖,具有承重和抗压缩特性,这对于维持软骨的生理特性至关重要。COL2A1 是另一个软骨合成代谢的关键指标,关节软骨的抗拉伸特性得益于COL2A1 的特殊网络结构,胶原酶介导的胶原蛋白降解导致早期骨关节炎的发生[16]。在软骨细胞的分解代谢中,分解代谢酶如MMPs(MMP1、MMP3、MMP13)和ADAMTS(ADAMTS4、ADAMTS5)在软骨降解中起关键作用,其中MMP13是软骨细胞分解代谢中最重要的分解酶,它可以靶向降解胶原蛋白,并优先降解ACAN 和COL2A1[17-18]。临床研究证实骨关节炎病人中MMP13 的表达升高,而动物实验显示,MMP13 缺陷小鼠没有表现出明显的表型异常,而过表达MMP13的转基因小鼠表现出关节软骨破坏,并伴有ACAN和COL2A1的减少,提示MMP13升高可能是软骨退变的原因[19]。此外,ADAMTS5 是ADAMTS 家族中可以降解ACAN 的重要成员之一,其在骨关节炎软骨组织中显著上调,单敲ADAMTS5 基因可减轻软骨退化[20]。
二、炎症反应失衡通过降解软骨细胞外基质导致骨关节炎进展
软骨细胞外基质的降解被认为是导致骨关节炎发生发展的关键因素之一,而炎症反应是引起细胞外基质降解的重要机制[21]。抗炎反应和促炎反应的失衡能引起软骨细胞合成代谢和分解代谢的紊乱,进而引起软骨细胞外基质的降解[22]。促炎反应能抑制合成代谢关节蛋白的表达,并能引起软骨细胞分解代谢的增强,而抗炎反应则能起到相反的作用。在IL-1β刺激下,软骨细胞的炎症反应明显增强,而促炎因子的过度产生会引起基质金属蛋白酶(MMPs)、其他细胞因子和前列腺素的生成增多,进而导致ACAN 和COL2A1 的合成减少,加速了软骨细胞外基质的降解,引起关节软骨的退变[23]。因此,抑制IL-1β介导的炎症反应被认为是抑制骨关节炎进展的有效治疗策略[24]。在我们的实验中,我们发现IL-1β抑制了软骨细胞的合成代谢(ACAN 和COL2A1 表达下调),增强了软骨细胞的分解代谢(MMP13 和ADAMTS5 表达上调),且增强了软骨细胞的炎症反应(iNOS、COX-2、IL-6 表达上调),而PA 能逆转IL-1β对上述指标的影响,表明PA 能增强软骨细胞的合成代谢、抑制分解代谢,且具备抗炎效应。
三、软骨细胞凋亡促进骨关节炎进展
软骨细胞是关节软骨中的唯一细胞类型,其存活状态和生理功能直接关系到关节软骨的稳态[25]。研究发现,软骨细胞死亡可与细胞外基质丢失形成恶性循环,而细胞凋亡是一个高度调节的细胞死亡过程,与癌症、发育异常和退行性疾病(如骨关节炎)密切相关[26]。促凋亡和抗凋亡的失衡同样是介导关节软骨退变的重要机制[26]。Bcl-2 蛋白家族是一个特殊的蛋白家族,由抗凋亡成员(如Bcl-2、Bcl-x)和促凋亡成员(如Bax、Bad、Bid)组成[27]。在抗凋亡成员中,Bcl-2 是一个关键的抗凋亡基因,能够阻止细胞色素c 从线粒体释放到细胞质,从而抑制了细胞凋亡[28];在促凋亡基因中,Bax基因是非常重要的促细胞凋亡的基因之一,其编码的Bax蛋白与Bcl-2形成二聚体,能抑制Bcl-2抗凋亡作用的发挥[27-28]。研究认为,Bax和Bcl-2蛋白表达量比值的高低可反映细胞发生凋亡的强弱[29]。我们的研究发现,相比于对照组,单纯使用IL-1β抑制了Bcl-2蛋白的表达,增加了Bax 蛋白的表达水平。而在IL-1β诱导的软骨细胞中,2.5 μmol/L、5 μmol/L、10 μmol/L 的PA 能上调Bcl-2 蛋白的表达并抑制Bax 蛋白的表达;Bcl-2/Bax的比值表明IL-1β能促进软骨细胞的凋亡,而PA能抑制IL-1β诱导的软骨细胞凋亡。
此外,我们的前期小鼠体外实验结果表明,PA通过整合素αVβ3 抑制MAPK 和NF-κB 信号通路发挥保护软骨细胞的作用,且体内实验证实膝关节腔注射PA能缓解膝关节软骨的磨损和退变[13]。因此,我们认为,PA 增强软骨细胞的合成代谢、抑制分解代谢,且具备抗炎和抗凋亡效应,表明了PA 具备保护软骨细胞的特性,有望成为骨关节炎的潜在治疗药物。