2 种曝气条件对附着硅藻生长的影响
2022-10-13王小冬刘兴国吴含含
王小冬,刘兴国,田 亿,吴含含,车 轩,朱 林
(1. 中国水产科学研究院渔业机械仪器研究所,上海 200092;2. 湖南农业大学动物科学技术学院,湖南 长沙 410128)
蓝藻、绿藻和硅藻是浮游植物主要的3 个门类。自然条件下,浮游植物有明显的季节演替,硅藻通常在冬、春季的弱光照和低温度条件下形成优势[1],而蓝藻优势或蓝藻水华喜好高温天气[2]。这种机制与不同藻类对光照、温度、营养盐等理化因子的需求差异有关。河流型硅藻优势主要是浮游态生长的硅藻。对河流型硅藻水华发生规律的研究表明,水文状况是河流硅藻水华最重要的影响因子,水文状况会影响光照、营养盐的吸收等,而且水动力搅动可能造成河流中不同河段藻类群落结构的差异[3]。
硅藻除了以浮游态生长外,还喜好附着在多种基质上生长[4]。附着硅藻的变化与多种因素有关,比如营养盐、温度、光照、水动力条件等[5]。对河道型水库中附着硅藻群落的研究表明,温度是影响浮游植物、浮游硅藻和附着硅藻的关键变量,溶解氧(DO)和硝态氮也是影响附着硅藻的变量[6]。浅水湖泊中附着硅藻群落组成和水文湖沼条件有关[7]。对海洋底栖硅藻的研究表明,氧含量和附着面积影响海洋底栖硅藻的生长,在氧含量高、可附着面积大的条件下,硅藻的生长繁殖速率快[8]。农业地区中的强水流和高溶氧特征直接影响附着硅藻的密度和种类丰度[9]。
可见除了温度、光照、营养盐等基本因素外,水动力扰动以及形成的溶氧条件也是影响藻类变化的重要因素。为此,在冬季保证合适营养盐和温度的条件下,进行不同的曝气扰动试验,旨在探寻藻类生长的变化规律,为有效培养藻类提供有益借鉴。
1 材料与方法
1.1 试验设计
试验于冬季在玻璃温室中进行,试验时间持续34 d。试验设1 个对照组和1 个处理组,各3 个重复,均进行曝气,对照组为空气曝气,处理组为高纯氮气曝气,以促进水中形成不同的溶解氧(DO)水平。采用60 cm×35 cm×40 cm 的玻璃缸进行试验,试验期间的水深为36 cm,每3 d 左右以自来水补充蒸发耗水。玻璃缸中均不添加沉积物。试验期间各玻璃缸均使用一支300 W 加热棒持续加热,预设温度为28℃,由于气温变化,实际水温有波动。其中第15天至第27 天由于没有控制好高纯氮气曝气,导致处理组水中DO 增高。
试验初始用水为少量饲料腐烂液、少量的微囊藻水华和自来水混合而成。初始水中叶绿素a(Chl-a)浓度为112.04 μg/L,其中微囊藻细胞浓度为6.33×107cells/L。试验初始的微囊藻来自太湖梅梁湾,在玻璃温室中以高浓度保存至试验时使用。饲料腐烂液为鱼类配合饲料与自来水混合腐烂4 个月后获得的黑褐色液体,已基本无臭味。
试验过程中第7 天、第12 天各添加一次300 目过滤后的饲料腐烂液作为促进藻类生长的营养盐,具体添加情况见表1。

表1 试验期间2 次添加饲料腐烂液后各容器中养分的瞬时增加量 (mg/L)
1.2 水质指标测定
试验期间检测水质,包括水温、DO、pH 值、氧化还原电位(ORP),这4 个指标大约每天9:00 和14:00 各测定1 次;总氮(TN)、总磷(TP)、溶解性总氮(DTN)、溶解性总磷(DTP)、活性磷(SRP)、硝态氮(NO3--N)、氨氮(NH4+-N)、溶解性有机碳(DOC)等,这8 个指标每7~10 d 测定1 次。
水温、DO、pH 值、ORP 的测定采用多参数水质分析仪(Professional plus,YSI,美国)原位测定;水样过Whatman GF/F(0.7 μm 孔径,英国)膜后,采用过硫酸钾联合消解法[10]测定DTN、DTP、TN 和TP;水样过Whatman GF/F 膜后,采用磷钼蓝分光光度法测定[11]SRP,采用纳氏比色法[11]测定NH4+-N;NO3--N 依据行业标准HJ/T 346—2007 采用紫外分光光度法测定;DOC 使用Multi N/C 2100(analytikjena,德国)仪测定。
1.3 浮游植物和附着藻类的鉴定
浮游植物生物量以Chl-a 表示,每2 d 左右使用浮游植物荧光仪(PHYTO-PAM,Walz GmbH,德国)测定1 次。由于试验过程中对照组和处理组均未出现蓝藻和硅藻大量浮游生长的现象,于是仅在试验结束时检测浮游植物的种类组成,种类鉴定参考胡鸿钧等[12]的方法进行。没有计算浮游植物的具体细胞浓度和生物量。
由于试验过程中出现了藻类的附着生长,试验结束时,测算对照组和处理组各玻璃缸内壁的藻类附着面积,并选取对照组和处理组内壁上藻类生长密实处,刮取附着藻类后计算其附着密度和生物量。附着藻类的生长不是均匀的,往往先在内壁上某处随机出现少量藻类的附着生长,然后扩散生长。因此,该研究采用网格法测算藻类附着面积,具体步骤为:先将一侧玻璃面以“田”字法平均分为4份,然后对每个格以“田”字法再平均分为4 份,依此类推地细分3 次,测算藻类附着面积的大小,并计算附着面积占水中内壁面积的百分比。附着藻类的获取方法:将缸内水适当移除部分后,利用干净牙刷刷洗一个3~4 cm 直径的圆形区域内附着藻类,并利用纯水定容到10 mL,每个缸选取3 处藻类密集处进行取样。
使用光学显微镜奥林巴斯CX41(Olympus, Japan)在400 倍下进行附着藻类的种类鉴定[12],用0.1 mL浮游生物计数框计数,再根据附着的面积换算成附着藻类的密度。附着藻类的生物量以湿质量表示,藻体积与湿质量的转换标准为1 mm3等于1 mg湿质量[13]。
1.4 数据处理
对照组和处理组的水温、DO、pH 值、ORP、Chl-a、TN、DTN、TP、DTP、SRP、N-N、NH4+-N和DOC 的比较,采用SPSS 16.0 软件针对2 个因子变量(采样时间和处理)的一般线性分析模型(GLM)进行分析,并且先开平方以增加数据齐性[14],其中ORP 是负值,故取相反值后再开平方。对藻类附着面积的比例和附着密度进行比较时,先开平方以增加数据齐性[14],然后进行单因素方差分析,差异显著水平选择 α=0.05。采用Sigmaplot 10.0 软件作图,其中各图所用数据形式为平均值±标准差。
2 结果与分析
2.1 水 质
试验期间所有水缸的平均水温为26.3℃,对照组和处理组间的水温没有显著差异(P>0.05)。试验中后期对照组和处理组的pH 值、ORP 均逐渐升高,对照组上午和下午的DO、ORP 均显著高于处理组(P<0.05),对照组上午和下午的pH 值均显著低于处理组(P<0.05)(图1),即:处理组进行高纯氮气曝气,显著降低了水中的DO 和ORP 值,其中15~27 d 由于没有控制好高纯氮气曝气量,导致处理组DO 明显增高(图1)。

图1 对照组和处理组中水温、DO、pH 值和ORP 的变化
从图2 中可以看出,试验期间水池中的TN、TP浓度范围分别为4.5~9.0 mg/L、1~4 mg/L。对照组的TN、DTN、NO3--N 含量均显著高于处理组(P<0.05),而对照组和处理组间的TP、NH4+-N、DOC 浓度均无显著差异(P>0.05)。这说明不同的曝气处理对水中营养盐水平造成了一定的影响。
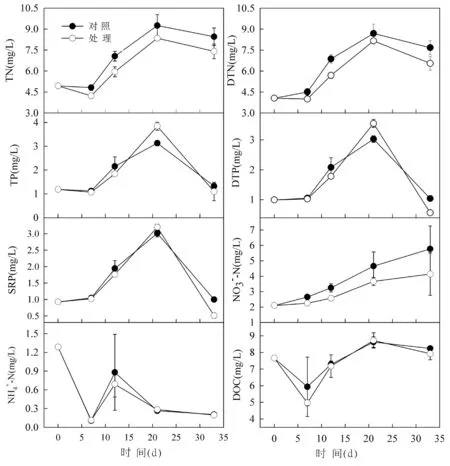
图2 对照组和处理组的营养盐随时间的变化
2.2 Chl-a 和浮游植物
由图3 可知,试验过程中对照组和处理组间的Chl-a 浓度均无显著差异(P>0.05)。试验结束时,对照组和处理组的浮游植物组成接近,主要是绿藻门的种类,具体有栅藻属(Scenedesmus)、小球藻属(Chlorella)、衣藻属(Chlamydomonas)、微芒藻属(Micractinium)、胶网藻属(Dictyosphaerium),另外还有隐藻门的隐藻属(Cryptomonas)、少量硅藻门的异极藻属(Gomphonema)以及一些未知的细丝状体,几乎没有微囊藻。

图3 对照组和处理组中Chl-a 随时间的变化
2.3 附着藻类
试验期间对照组和处理组均出现了棕褐色藻类的附着生长,至试验结束时,对照组和处理组各缸内壁上均附着大量的棕褐色藻类(试验期间的水深为36 cm),在显微镜下观察为硅藻,除细菌外,没有其他藻类,且对照组和处理组中附着生长的硅藻种类相同。取新鲜的附着藻类样品直接在显微镜下观察,发现附着硅藻的优势类群为硅藻门的菱形藻属(Nitzschia)和异极藻属(Gomphonema),硅藻细胞大小比较均匀,单个硅藻细胞的长度约25~30 μm,最宽处约7~10 μm(图4)。

图4 试验结束时对照组(A、B)和处理组(C、D)玻璃缸内壁的附着硅藻
硅藻在玻璃缸内壁上呈斑块状逐渐扩大生长,附着密度不均匀。由表2 可知,对照组的硅藻附着面积显著小于处理组的(P<0.05);而生长密实处附着硅藻的密度、湿质量之间对照组与处理组均无显著差异(P>0.05)。

表2 试验结束时玻璃缸内壁上硅藻附着生长的面积占比、密度、湿质量
3 结论与讨论
冬季将水温控制在26.3℃,通过曝气扰动形成不同的溶解氧环境,硅藻容易大量附着生长,而且溶解氧浓度低时,硅藻附着面积更大;附着硅藻的优势类群为菱形藻和异极藻,其中富营养条件为TN 浓度4.5~9.0 mg/L,TP 浓度1~4 mg/L。
试验处理组纯氮气曝气后的DO 显著低于空气曝气的对照组,并且DO 水平的差异导致了ORP 和pH值的差异,但水温、Chl-a 无显著差异。浮游植物响应方面,对照组和处理组中均未出现蓝藻和硅藻大量浮游生长的现象,优势藻类为绿藻,但容器内壁上均出现了大量附着硅藻。这表明冬季在玻璃温室环境中对高度富营养且含微囊藻的水加温(平均水温为26.3℃)、曝气处理未能让微囊藻取得优势,浮游植物以绿藻为优势,但促进了硅藻大量附着生长。因此,出现附着硅藻优势时并不一定出现浮游硅藻优势,硅藻附着生长优势比浮游硅藻优势更容易形成。
该试验的附着藻类全是硅藻,优势类群为菱形藻属和异极藻属,这2 个属为常见的富营养硅藻,是野外环境中常见的优势硅藻。比如,异极藻 (Gomphonema parvulum)经常生长在污染较严重的水中,而谷皮菱形藻(Nitzschia palea)等藻类是磷污染的指示种[15];据 Besse-Lototskaya 等[16]统计,谷皮菱形藻是一种生活在富营养水体中的藻类;广东鉴江水系和华南地区东江及其支流增江的底栖硅藻优势类群为舟形藻属、菱形藻属和异极藻属[17-19];东江惠州河流段人工基质附着硅藻的主要优势属成员为异极藻属和菱形藻属[20];海洋赤潮研究中甚至发现菱形藻属硅藻附着生长在衰老的球形棕囊藻囊体和泡沫上[21]。笔者的试验结果表明,自然水体中常见的附着硅藻种类——菱形藻和异极藻在人工富营养条件下也容易附着生长并形成优势。
附着硅藻的生长同样受到多种理化因素的影响,如光照、营养盐、温度、水动力等。对东江惠州河流段人工基质附着硅藻群落的季节性动态研究表明,研究区域内河流中的大多数硅藻适合在春秋季生长,季节性变化趋势较明显,水温、DO、N-N、PO43--P、电导率、pH 值等对附着硅藻群落结构有重要影响;相对而言,其中许多藻类都喜好在透明度较好、溶解氧较高及温度相对较低的春、秋季节的水环境中生长[20];并且电导率是影响东江流域附着硅藻群落最大的环境变量[22]。对河道型水库中附着硅藻群落的研究表明,除了温度的影响外,DO 和硝态氮也是影响附着硅藻的变量[6]。Winter 等[23]发现底栖硅藻种群与总磷浓度有显著相关性。笔者试验测定的各水质指标中,对照组和处理组之间有显著差异的指标包括DO、pH值、ORP 以 及TN、DTN、DTP、NO3--N、SRP, 其他指标没有显著差异。虽然该试验中处理组和对照组的附着密实处硅藻的附着密度之间没有显著差异,但是高纯氮气曝气后DO 水平低的处理组中附着硅藻的面积显著大于对照组(P<0.05),表明在该试验条件下,低水平DO 有利于附着硅藻的生长扩散。这可能与处理组中DO 水平降低后,相应形态营养盐的可利用性发生变化有关。
对照组和处理组中均出现了硅藻的附着生长,表明对照组和处理组均满足了硅藻附着生长的基本条件;尽管硅藻的附着面积有差异,但对照组和处理组之间DO 水平的差异并不是影响硅藻附着生长的根本原因,影响硅藻附着生长的基本条件可能还是光照、营养盐、水动力扰动等。该试验在冬季加温条件下使用透明玻璃缸进行自来水曝气处理(水动力扰动),处理前添加饲料腐烂液营造了富营养条件,这些因素很可能满足了附着硅藻生长对温度、光照、营养盐和水动力条件的需求。但是浮游植物没有出现硅藻优势,可能是由浮游硅藻和附着硅藻对环境因子需求的差异引起的,也表明在温度、光照、营养盐等条件合适时,与浮游态生长相比,硅藻更容易以附着态生长并形成优势。
同一水体中浮游植物和附着藻类的种类组成会有较大差异[24]。对河道型水库浮游植物和附着硅藻群落的研究表明,水体中的浮游硅藻和附着硅藻的种类差异很大,浮游硅藻主要是颗粒直链藻,而附着硅藻主要是舟形藻和菱形藻[6]。对白洋淀3 大典型水体附着藻类群落结构的研究表明,白洋淀的浮游植物与附着藻类的群落结构差异很大,其中附着硅藻所占比例远远大于浮游硅藻,附着硅藻种类数目多于浮游硅藻种类数目;同时浮游植物与附着藻类之间存在一定的竞争排斥关系[24]。因此,在富营养水体中,通过附着藻类的生长来控制藻类水华可能是水体富营养治理的一条新途径[25]。笔者的试验中没有出现大量浮游态生长的硅藻,其中的机理还需要进一步研究。
近年来,对硅藻的研究主要是针对天然水体中硅藻的自然生长,而在人工模拟条件下重现硅藻优势的研究比较少[4]。淡水附着硅藻或者底栖硅藻的研究主要从群落结构研究藻类的相对丰度[6,20],很少关于绝对生物量的研究;在自然条件下,硅藻容易附着生长在自然基质上,且往往与其他藻类间杂生长[4],不是单纯的硅藻生长。而笔者的试验中附着生长的基本只有硅藻。关于附着硅藻的人工培养研究主要集中在海水贝类的饵料培养,因为附着硅藻是水产养殖对象优质的生物活饵料。例如,对1 株热带底栖硅藻——双眉藻(Amphora sp. HN08)的附着培养发现,该双眉藻在玻璃板和 PVC 塑料板上的生物质产量最高,细胞干重达到3. 64 g/m2[26];利用人工培养基在实验室条件下培养双眉藻时,附着细胞浓度可达1.33×106cells/cm2;室外培养时,细胞附着浓度可达1.00×106cells/cm2[27],稍低于笔者试验中对照组和处理组附着密实处的硅藻密度(1.14×106和1.27×106cells/cm2)。由此可见,细胞附着密度方面,笔者试验中附着密实处的硅藻附着密度与室内纯培养的密度接近,藻类附着效果好。硅藻在水产养殖中具有重要的生物饵料价值,尤其是附着硅藻,它是鱼、虾、贝类幼体的重要生物活饵料,而且底栖硅藻形成的生物膜有助于贝类幼虫附着变态过程的顺利完成,也有利于生态、高效的商业化贝类种苗培育[28]。因此,附着硅藻的培养在水产养殖中具有重要意义[24]。从淡水硅藻附着培养的角度出发,该研究为淡水硅藻的附着培养提供了方法参考,在冬季弱光照条件下,适宜加温、曝气扰动可促进富营养水体中硅藻的附着生长。
