重组人釉原蛋白促进人脐静脉内皮细胞成血管分化作用的研究
2022-10-13庄齐翔夏一如董家辰谢玉峰
庄齐翔,夏一如,董家辰,谢玉峰,束 蓉
牙周病可引起牙周支持组织发生不可逆性破坏,理想治疗结果是实现牙周组织再生[1]。成血管作用是组织再生的关键步骤,新生血管可供给组织所需的营养物质及细胞因子[2]。内皮细胞(endothelial cell,EC)是参与成血管作用的主要细胞,人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)源自于脐带静脉内皮,能较好地模拟生理状态下EC特性,是构建成血管细胞模型的良好基础[3-4]。
釉基质蛋白(enamel matrix proteins,EMPs)属于蛋白质混合物,是诱导牙周支持组织发育的重要成分,釉原蛋白(amelogenin,Am)是其主要的活性成分[5]。EMPs是天然提取的混合物,获取困难、成本高昂、每次提取产量有限且不是纯净的Am。通过基因工程技术可制得单一组分的重组釉原蛋白 (recombinant amelogenin,rAm),rAm来源广泛、性质稳定、能批量纯化获得[6]。
猪或鼠来源的EMPs可促进HUVEC的成血管作用,但重组人釉原蛋白(recombinant human amelogenin,rhAm)的相关研究仍不足。因此本研究拟探讨不同浓度rhAm对HUVEC成血管作用的影响,为后续rhAm在牙周组织血管化再生的临床应用提供理论依据。
1 材料与方法
1.1 主要试剂和仪器
DMEM培养基(Hyclone,美国),胎牛血清、青霉素、链霉素、0.25%胰酶(Gibco,美国),RNA反转录试剂盒(Takara,日本),酶联免疫检测仪(Bio-Tek Instruments,美国),倒置显微镜(Nicon,日本),LightCycler 480Ⅱ(Roche,美国),抗E-selectin抗体、抗VEGFR-2抗体(proteintech,中国),抗VEGFR-1抗体、抗ICAM-1抗体(abcam,英国),Matrigel Matrix(Corning,美国)。研究采用的rhAm是本课题组在前期实验中,通过选择BL21/pET28a-His-SUMO-rhAm表达系统,在适宜条件下,经诱导表达融合蛋白His-SUMO-rhAm,酶切纯化得到25 ku全长rhAm。
1.2 HUVEC培养
将HUVEC细胞系EA.Hy926(AllCells,美国)在DMEM培养液(含10%胎牛血清,100 U/mL青霉素及100 U/mL链霉素)中复苏,37 ℃、5% CO2培养箱中培养,待皿底细胞汇集至90%,使用0.25%胰酶消化,按1∶3传代,将复苏后3代内且生长状态良好的细胞进行实验。
1.3 MTT法检测
将HUVEC以2×104个/mL浓度接种于96孔板中,每孔100 μL,标准条件下培养24 h。将细胞分为5组,对照组为空白培养液,其余各组分别含0.1、10.0、50.0、100.0 μg/mL rhAm(各组均不含胎牛血清),每组设5个副孔。按上述分组更换培养液,标准条件下培养,分别观察1、2、3、4、5 d后,每孔加入150 μL MTT溶液(5 mg/mL),37 ℃、5% CO2培养箱孵育4 h后弃除孔内液体,再加入200 μL二甲基亚砜,振荡器震荡5 min。使用酶联免疫检测仪测其在波长490 nm处的OD值,根据OD值绘制生长曲线。
1.4 划痕实验
将HUVEC以3×105个/mL浓度接种于6孔板中,每孔加入2 mL,培养至HUVEC爬满皿底,取200 μL枪头垂直孔底作一划痕后,换用空白培养液(对照组)或含10.0 μg/mL rhAm的培养液继续培养(均不含胎牛血清),每组设3个副孔,每24 h倒置显微镜观察HUVEC的迁移,拍照记录。
1.5 实时荧光定量PCR
将HUVEC以3×105个/mL浓度接种于6孔板中,每孔加入3 mL,培养24 h后换用空白培养液(对照组)或含10.0 μg/mL rhAm的培养液继续培养(均不含胎牛血清),每组设3个副孔,培养24 h后弃去培养液,加入适量Trizol进行细胞裂解,提取细胞总RNA,TaKaRa反转录试剂盒将RNA反转录为cDNA,采用SYBR绿色荧光法检测细胞间黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)、E-选择素(E-selectin)、血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)和VEGFR-2的mRNA表达变化。本实验所用的引物序列参见表1。

表1 成血管相关基因的实时荧光定量PCR引物Tab.1 Specific primer sequences used for real-time PCR angiogenesis-related genes
1.6 蛋白免疫印迹检测
将HUVEC细胞以3×105个/mL浓度接种于6 孔板中,每孔加入3 mL,培养24 h后换用空白培养液(对照组)或含10.0 μg/mL rhAm的培养液继续培养(均不含胎牛血清),每组设3个副孔,培养24 h后弃去培养液,加入适量细胞裂解液,提取细胞总蛋白,测定蛋白浓度后以等量蛋白量进行凝胶电泳,转至PVDF膜,膜封闭,孵育一抗E-selectin、GAPDH、ICAM-1、VRGFR-2(均为1∶1 000);VEGFR-1(1∶2 000),洗膜,孵育二抗FITC抗兔IgG(1∶5 000),ECL显影。
1.7 小管生成实验
取48孔板,每孔加入150 μL Matrigel Matrix铺底,标准条件下培养1 h成胶。将HUVEC以1×106个/mL浓度接种于48孔板中,分别加入空白培养液(对照组)或含10.0 μg/mL rhAm的培养液(均不含胎牛血清),每组分配3个副孔,每4 h倒置显微镜观察,待HUVEC排列成小管结构后拍照记录。
1.8 统计学分析
取各副孔平均值作为结果,每组实验重复3次。采用SPSS 26.0、GraphPad Prism 9.1.1、ImageJ软件对实验数据进行分析,双因素方差分析和配对t检验进行统计。P<0.05为差异有统计学意义。
2 结 果
2.1 rhAm对HUVCE增殖的影响
不同浓度rhAm对HUVEC增殖影响的检测结果见图1。对照组HUVEC在第2天细胞数量开始增加,随后进入对数生长期,第4天进入平台期。0.1 μg/mL rhAm组的细胞数量在5 d内呈稳定增加,在第5天时与对照组相比有统计学差异(P<0.05);10.0 μg/mL rhAm组的细胞数量从第3天开始快速增加,第4天达到高峰,细胞数量明显高于对照组(P<0.05),第5天时细胞数量开始下降;50.0 μg/mL rhAm组的细胞数量在5 d内稳定增加,但与对照组相比无明显差异;100 μg/mL rhAm组的细胞数量在第1~3天内稳定增加,但第3天后细胞数量出现明显下降,第5天时其细胞数量明显低于对照组(P<0.01)。MTT检测结果显示10.0 μg/mL rhAm在刺激HUVEC 24 h后对HUVEC增殖的促进效果相对最佳,因此后续实验选择10.0 μg/mL作为刺激浓度。
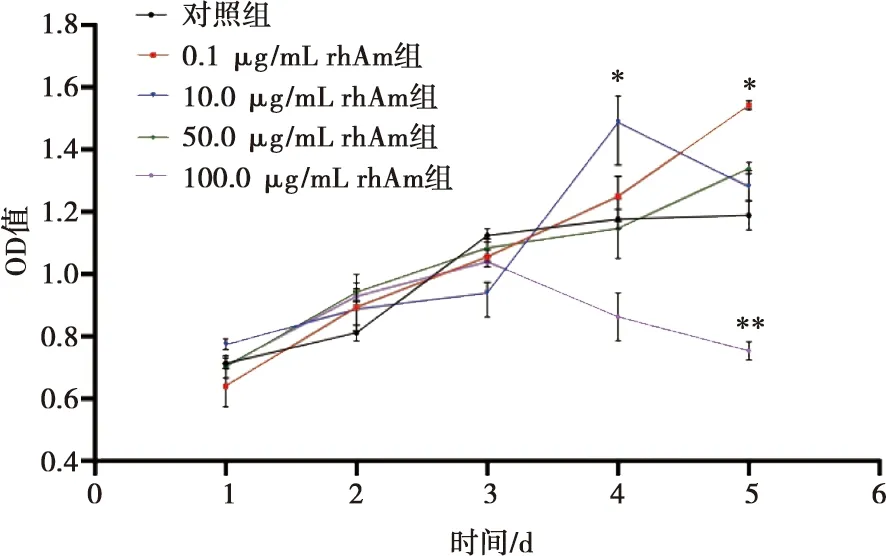
与对照组相比,*:P<0.05,**:P<0.01
2.2 rhAm对HUVEC迁移的影响
24 h时,对照组的愈合面积约占划痕面积的3/4,10.0 μg/mL rhAm组的划痕则已完全愈合,愈合面积与对照组相比存在统计学差异(P<0.05);48 h时,对照组的划痕也达到完全愈合(图2)。

A:对照组和10.0 μg/mL rhAm组不同时间点HUVEC迁移情况( ×40);B:划痕愈合面积,与对照组相比,*:P<0.05
2.3 HUVEC中成血管相关mRNA的表达
培养24 h后,10.0 μg/mL rhAm组中ICAM-1、E-selectin、VEGFR-1和VEGFR-2的mRNA相对表达量均高于对照组,其中ICAM-1(P<0.01)、E-selectin(P<0.05)mRNA表达与对照组相比存在统计学差异(图3)。
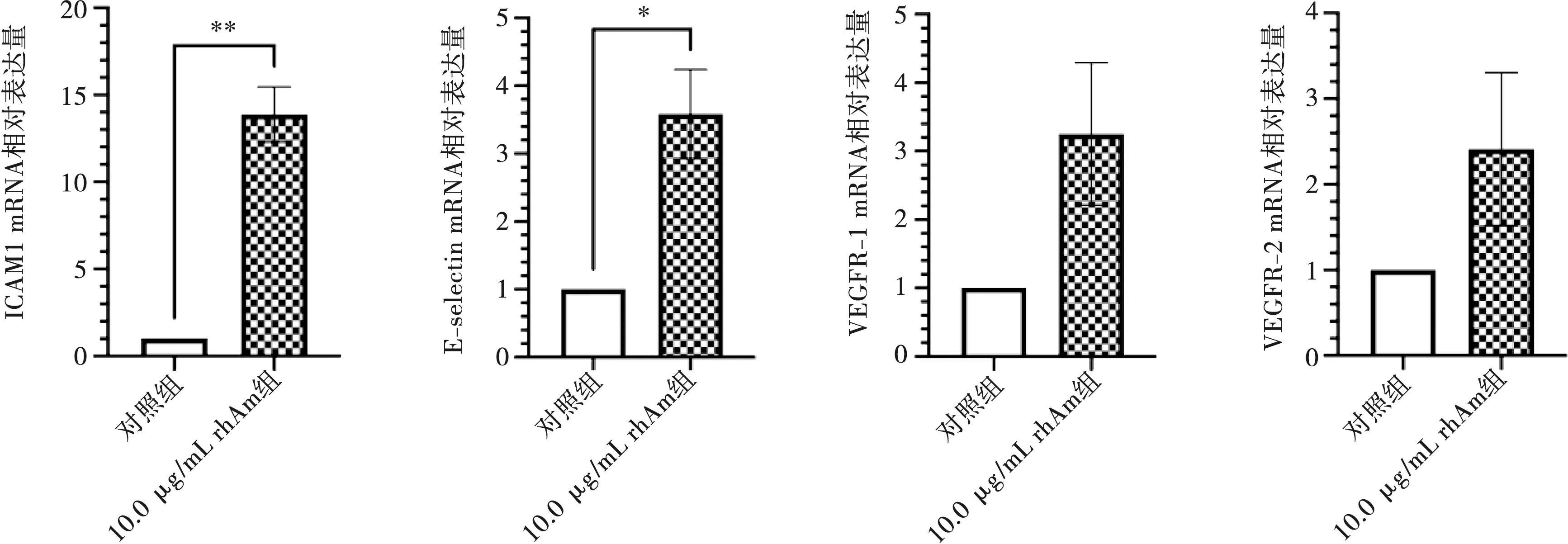
与对照组相比,*:P<0.05,**:P<0.01
2.4 HUVEC中成血管相关蛋白的表达
在蛋白水平上,10.0 μg/mL rhAm浓度下,HUVEC的ICAM-1、E-selectin、VEGFR-1和VEGFR-2表达在24 h时增强,其中ICAM-1的表达与对照组相比存在统计学差异(P<0.01)(图4~5)。
2.5 rhAm对HUVEC成管的影响
16 h时,对照组与10.0 μg/mL rhAm组均表现出明显的成管效果;20 h时,两组成管趋于稳定,成管效果无显著差异(图6)。
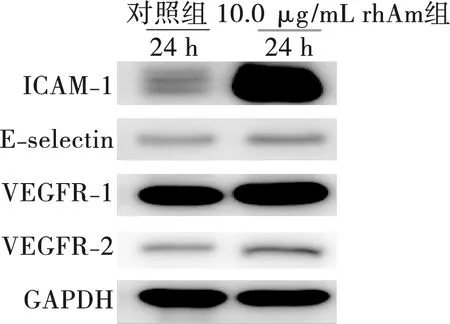
图4 rhAm对HUVEC中成血管相关蛋白表达的影响Fig.4 The effect of rhAm on the expression of angiogenesis-related proteins of HUVEC
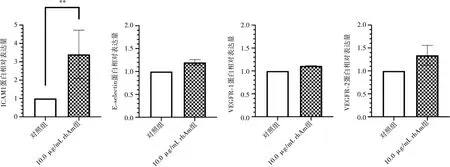
与对照组相比,**:P<0.01
3 讨 论
使已丧失的牙周支持组织得到修复和再生是牙周病的治疗难点。近年来,随着组织工程和干细胞再生技术的日趋成熟,结合种子细胞、生长因子及支架材料的牙周组织工程已成为牙周组织再生研究中的新兴热点[7-8]。Am在EMPs中的占比达90%,克隆Am的成熟肽编码区基因,经过载体构建、基因表达、产物分离和纯化后,可得到纯净的rAm。林智恺等[9]的研究显示rhAm可促进牙周膜成纤维细胞(periodontal ligament cell,PDLC)的增殖、迁移和黏附;Hakki等[10]研究发现rhAm可上调成牙骨质细胞对Ⅰ型胶原纤维(collagen type Ⅰ,COL Ⅰ)、骨桥蛋白(osteopontin,OPN)和牙骨质附着蛋白(cementum attachment protein,CAP)等成牙骨质相关基因的表达;廖蔚文等[11]发现rhAm在炎症微环境下可抑制人牙周膜成纤维细胞(human periodontal ligament cell,hPDLC)中炎症相关细胞因子的表达,上述实验均提示rhAm有促进牙周组织修复和再生的能力,是牙周组织工程常用的生长因子之一。

图6 rhAm对HUVEC成管的影响( ×40)Fig.6 The effect of rhAm on the tube formation of HUVEC( ×40)
成血管作用是组织修复和再生过程中的关键步骤,组织内既存的内皮细胞前期细胞(endothelial progenitor cell,EPC)或是脱离成熟血管壁基底膜的EC,在发生细胞增殖的同时也向组织缺损区迁移,EC在此过程中会构建成管状结构,最终形成成熟的血管,并与周围血管产生吻合,达成血管的新生[2,12]。PDLC是牙周膜的主要细胞,Amin等[13]的研究指出富含酪氨酸的釉原蛋白多肽(tyrosine-rich amelogenin peptide,TRAP)可促进PDLCs分化成EC,此外,牙周膜是高度血管化的结缔组织,这都奠定了牙周组织血管化再生的基础。
本研究发现低浓度(0.1、10.0 μg/mL)rhAm在早期对HUVEC的增殖无明显作用,随着时间累积,在后期可对细胞增殖起到促进作用;但高浓度(100.0 μg/mL)rhAm在后期会对细胞增殖产生抑制作用。釉基质蛋白衍生物(enamel matrix derivatives,EMD)是EMPs精制、纯化后的产物,Andrukhov等[14]的研究显示低浓度的8~55 ku EMD成分在刺激24 h后对HUVEC的增殖无促进作用,但高浓度的8~55 ku EMD成分对细胞有抑制作用,其结果与本研究相似。
EC的迁移是成血管过程的重要步骤[12],本实验通过划痕实验模拟成血管过程中HUVEC横向迁移的能力。实验结果发现rhAm能明显促进HUVEC的迁移,加快划痕的愈合。Jonke等[15]采用Transwell法同样也发现TRAP可促进HUVEC的迁移。
牙周组织的炎症环境会降低牙周组织再生相关细胞的分化能力,影响细胞的生物学特性和牙周组织的再生[16]。ICAM-1和E-selectin是存在于EC表面的黏附分子,两者在炎症介质的刺激下会上调表达,可促进炎症细胞的黏附,并招募这类细胞向病损区域迁移,此外,ICAM-1还参与EC的迁移[17-18]。本实验的结果显示,rhAm可显著提高HUVEC对ICAM-1的表达,同时也提高对E-selectin的mRNA表达。Andrukhov等[14]研究指出EMD、8~55 ku EMD成分和小于8 ku的EMD成分均会提高HUVEC中ICAM-1和E-selectin的表达。血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管新生过程中重要的调节因子,VEGFR-1和VEGFR-2是表达于EC表面的VEGF受体[19]。被激活的VEGFR-1会诱导EC和炎性细胞的迁移、促进炎性细胞因子的分泌、招募髓系祖细胞、激活蛋白水解酶,在炎症等病理性血管新生中发挥重要作用[19]。被激活的VEGFR-2表现出较强的成血管活性,可诱导造血细胞分化为EC,抑制EC的凋亡,促进EC的增殖、迁移和血管的形成,不仅直接参与胚胎发育期间的血管发生,同时还促进生理性及病理性的血管新生[19]。Afacan等[20]的研究指出牙周炎患者龈沟液中的VEGF浓度较牙周健康者高,提示牙周炎会提高牙龈组织的VEGF浓度。本实验结果显示rhAm有上调HUVEC表达VEGFR-1和VEGFR-2的趋势。Jonke等[15]研究显示,10 μg/mL TRAP和EMD有上调HUVEC表达VEGFR-1和VEGFR-2的趋势,50 μg/mL TRAP和EMD则可显著上调。在本次实验中,VEGFR-1和VEGFR-2的上调程度不明显可能与rhAm的刺激浓度不足有关。rhAm可能通过提高EC中ICAM-1、E-selectin和VEGFR-1的表达,诱导炎症细胞向牙周组织病损区聚集,加快病原微生物和坏死组织的清除,有助于牙周组织的愈合;另一方面,rhAm使VEGFR-2表达上调有助于EC的增殖,ICAM-1、VEGFR-1和VEGFR-2表达增多也可促进EC的迁移。
本实验观察HUVEC体外成管效果后发现不含rhAm或含10.0 μg/mL rhAm的培养液均能诱导HUVEC排列成小管样结构,且两组之间差异不明显。Jonke等[15]的研究显示10 μg/mL TRAP在标准条件下培养15 h后可诱导HUVEC排列成小管样结构,且较对照组有明显差异。VEGF与VEGFR-2结合后,可促进HUVEC的成管作用[19],本实验虽然提示10.0 μg/mL rhAm有上调HUVEC表达VEGFR-2的趋势,但该结果与对照组相比无统计学意义,且本实验选用的基质胶不含VEGF,可能是导致本次小管生成实验差异不明显的原因,如果参考Jonke等[15]的研究结果,选择同样的实验条件,提高rhAm的浓度使HUVEC增强对VEGFR-2的表达,同时选用含VEGF的基质胶,可能会得到与目前不一样的实验结果。
本研究发现rhAm可促进HUVEC的增殖和迁移,上调细胞黏附蛋白的表达,提示rhAm在牙周组织局部的炎症环境中有促进组织内血管新生及调节组织炎症的作用。如何在牙周病治疗中应用rhAm,解决牙周组织局部炎症的同时也促进病损组织的血管新生,将是今后的重点研究方向。
