柴胡桂枝汤加减治疗PD-1/PD-L1抑制剂治疗肿瘤后腹泻的临床研究
2022-10-13时红萍刘洪敬黄姝陈友山刘国庆
时红萍,刘洪敬,黄姝,陈友山,刘国庆
1.菏泽市立医院肿瘤内科,山东菏泽 274000;2.菏泽市立医院骨外科,山东菏泽 274000
近年来,随着医疗技术的不断进步,肿瘤免疫治疗逐渐兴起。随着程序性细胞死亡蛋白-1(programmed cell death protein 1,PD-1)和程序性死亡配体-1(programmed cell death-ligand 1,PD-L1)在临床的不断应用,其疗效得到广泛的认可[1]。但是,随之发生的不良反应也得到了大家的关注[2]。临床应用发现,PD-1/PD-L1会产生肿瘤免疫治疗所特有的免疫相关的不良反应(immune ralated adverse events,irAEs)。这些不良反应主要包括胃肠道不良反应、肝不良反应、皮肤不良反应以及内分泌系统不良反应等[3]。因为大多数的免疫检查点抑制剂(immune checkpoints inhibitors,ICPIs均具有一定的消化道毒性,因此,在接受肿瘤免疫治疗的患者中,几乎一半以上都会发生腹泻、恶心等症状[4]。为此,消除irAEs对于采取肿瘤免疫治疗的癌症患者尤为重要。
中药作为我国的瑰宝,在多种疑难疾病的治疗中起着至关重要的作用。尤其是在肿瘤的治疗中,化疗和放疗联合中药的治疗手段也取得了一定的成效[5]。为此,本研究根据纳排标准方便选取2019年1月—2021年6月在菏泽市立医院肿瘤科就诊的92例癌症患者,探究柴胡桂枝汤加减预防PD-1/PD-L1免疫抑制剂治疗肿瘤后腹泻的疗效。现报道如下。
1 资料与方法
1.1 一般资料
根据纳排标准方便选取该院肿瘤科就诊的92例癌症患者为研究对象。根据是否使用柴胡桂枝汤加减治疗,将92例癌症患者分为两组,研究组46例,所有患者均使用柴胡桂枝汤加减治疗。对照组46例,未使用柴胡桂枝汤加减治疗。其中,研究组男25例,女21例;年龄45~80岁,平均(63.35±7.63)岁;使用PD-1治疗患者40例,使用PD-L1治疗患者6例;肿瘤类型包括:胆囊癌(3例)、肺癌(14例)、肝癌(9例)、结直肠癌(2例)、膀胱癌(2例)、肾癌(3例)、食管癌(9例)、头颈部肿瘤(3例)以及胃癌(1例)。对照组男28例,女18例;年龄45~80岁,平均(63.04±8.56)岁;使用PD-1治疗患者40例,使用PD-L1治疗患者6例;肿瘤类型包括:胆囊癌(2例)、肺癌(16例)、肝癌(10例)、结直肠癌(1例)、膀胱癌(2例)、肾癌(3例)、食管癌(9例)、头颈部肿瘤(2例)以及胃癌(1例)。研究组和对照组在性别、年龄、免疫抑制剂使用类型以及肿瘤类型等一般资料的对比,差异无统计学意义(P>0.05),具有可比性。具体内容见表1。本研究已经过医院医学伦理委员会批准,患者或家属已签署知情同意书。
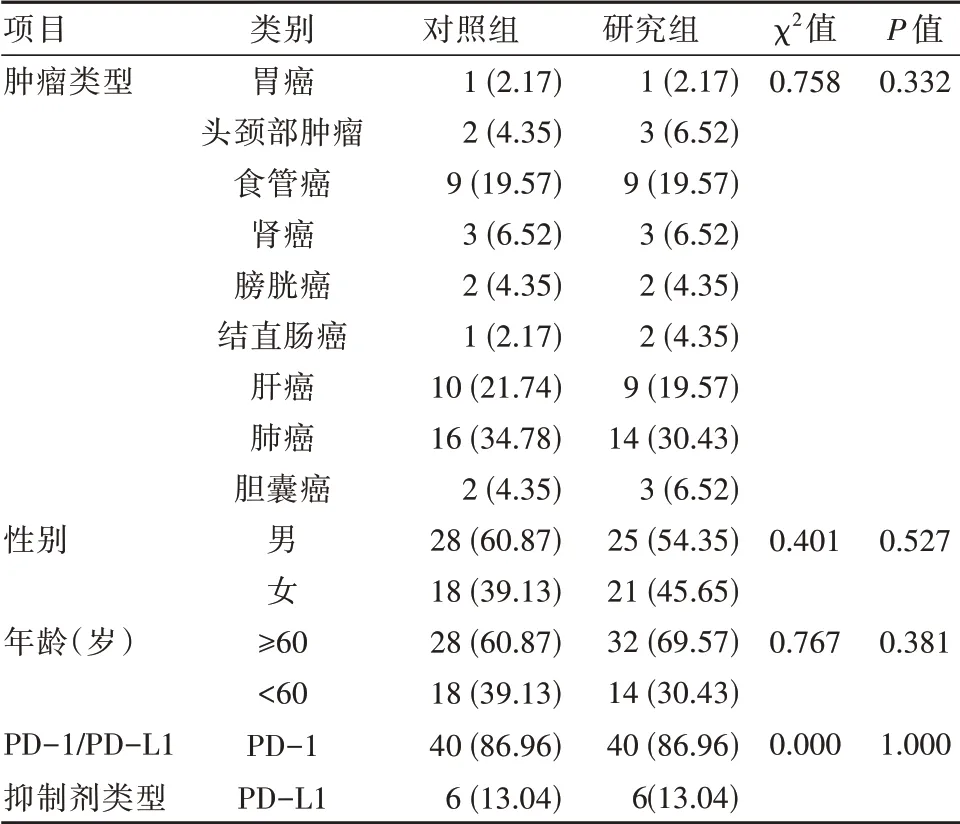
表1 两组患者一般资料的对比[n(%)]Table 1 Comparison of the general data of the two groups of patients[n(%)]
1.2 纳入与排除标准
纳入标准:所有患者均经过病理学确诊符合相应肿瘤类型的确诊标准;年满18周岁;无长期慢性腹泻病史(大便次数>3次/d);接受肿瘤免疫治疗之前未使用过导泻剂或止泻剂;无先天性免疫缺陷者。
排除标准:合并消化道出血或急性肠梗阻的患者;有严重电解质紊乱或酸碱失衡情况的患者;接受抗生素治疗或者接受肿瘤免疫治疗前使用抗生素时间超过1周的患者;因自身缘故无法坚持服用本研究的药物,依从性较差的患者;临床资料不全者。
1.3 方法
两组患者均接受肿瘤免疫治疗。免疫制剂类型包括PD-1和PD-1L。
1.3.1 对照组对照组采用肿瘤免疫治疗+对症支持治疗的方式。免疫治疗:选用帕博利珠单抗(规格:100 mg/4 mL,国药准字S20180019)/信迪利单抗(规格:10 mL∶100 mg,国药准字S20180016)/卡瑞利珠单抗(规格:200 mg×1瓶,国药准字S20190027)静滴,每3周1次,同时根据病情联合其他化疗等方案。对症支持治疗:于化疗第1天予以甲氧氯普胺注射剂20 mg注射,1次/d;盐酸昂丹司琼注射液(规格∶4 mL∶8 mg,国药准字H10970064)8 mg静脉注射,1次/d,连用3 d,根据患者恶心呕吐反应情况,必要时可延长使用时间;地塞米松注射液(规格:1 mL∶5 mg×10支,国药准字H41020036)5 mg配入5%葡萄糖注射液(规格:250 mL∶125 g,国药准字H13022474)100 mL中,静滴1次/d。化疗期间出现口腔溃疡者予以康复新液(规格:100 mL,国药准字Z43020995)20 mL含漱,3次/d;出现腹泻者,予盐酸洛 哌 丁 胺 胶 囊(规 格:2 mg×6粒,国 药 准 字H10910085)2 mg口服,1次/d,大便恢复正常后停服;便秘者予以开塞露(规格:10 mL,国药准字H42021082)20 mL通便。
1.3.2 研究组在对照组抗肿瘤免疫治疗的基础上,研究组采用肿瘤免疫治疗+对症支持治疗+柴胡桂枝汤加减的方式。柴胡桂枝汤加减组方:柴胡30g,生姜30 g,桂枝24 g,白芍20 g,黄芩10 g,炙甘草10 g,清半夏15 g,党参15 g,大枣5枚。对于有便秘的患者加黄大酒6 g;对于有腹胀的患者加厚朴10 g和枳实10 g;对于消化不良的患者加焦三仙焦麦芽、焦山楂和焦神曲各10 g。药物均由医院药房提供,取汤汁200 mL,于化疗第1天起,每日服用中药汤剂一剂,分2次温服,连续服用21 d。
1.3.3 合并用药各组病例除基础治疗和必要的支持治疗外,不得使用其他中药。
1.4 观察指标
记录并统计两组患者发生腹泻、恶心等情况。对患者的腹泻情况进行评估,具体评估指标如下:大便次数每日增加2~3次为1级;大便次数每日增加4~6次,且夜间有大便伴有中度腹部绞痛的情况为2级;大便次数每日增加7~9次,且夜间有大便伴有重度腹部绞痛的情况为3级。
1.5 统计方法
本研究所有数据均使用SPSS 22.0统计学软件进行分析,符合正态分布的计量资料以(±s)表示,组间差异比较以t检验;计数资料以频数及百分比表示,组间差异比较以χ2检验;等级资料两组间的秩和检验使用Kruskal-Wallis方法进行。单因素分析相关因素;连续型变量采用广义线性回归模型;二分类变量,采用Logistic逻辑回归模型;多元回归分析独立影响因素,即通过多变量构建两个不同的模型回归模型,包括非调整模型(未调整协变量)以及调整模型(调整了年龄、性别、肿瘤类型、抑制剂类型),同时记录单因素分析与多元回归分析的95%置信区间的效应大小。P<0.05为差异有统计学意义。
2 结果
2.1 研究组和对照组间腹泻情况的对比
两组在进行肿瘤免疫治疗后均发生了腹泻,且研究组和对照组在腹泻评级间的差异无统计学意义(P>0.05)。但是,研究组的腹泻持续时间(6.39±2.82)d显著少于对照组(8.65±2.63)d,差异有统计学意义(t=3.975,P<0.001)。见表2。

表2 研究组和对照组间腹泻情况的对比[n(%)]Table 2 Comparison of diarrhea between study and control groups[n(%)]
2.2 研究组和对照组间结肠炎发生情况的对比
两组在进行肿瘤免疫治疗后部分腹泻患者发生了结肠炎的情况,但研究组和对照组在结肠炎发生数量上的差异无统计学意义(P>0.05)。研究组的结肠炎发生持续时间(4.94±2.32)d显著低于对照组(7.46±2.37)d,差异有统计学意义(t=5.153,P<0.001)。见表3。
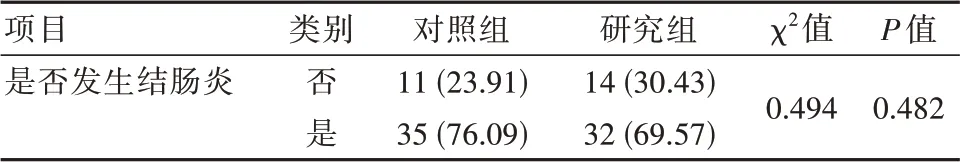
表3 研究组和对照组间结肠炎发生情况的对比[n(%)]Table 3 Comparison of the incidence of colitis between the study group and the control group[n(%)]
2.3 研究组和对照组在发生恶心症状的对比
两组在进行肿瘤免疫治疗后部分患者出现了恶心的症状,但研究组和对照组在恶心症状发生数量上对比,差异无统计学意义(P>0.05)。研究组的恶心情况持续时间(4.90±2.88)d显著低于对照组(6.05±2.35)d,差异有统计学意义(t=2.098,P=0.039)。见表4。

表4 研究组和对照组在发生恶心症状的对比[n(%)]Table 4 Comparison of nausea symptoms between the study group and the control group[n(%)]
2.4 PD-1/PD-L1抑制剂治疗肿瘤后腹泻的单因素分析

续表5Continuation table 5
为了分析对照组与研究组间发生腹泻的单因素分析,将结果变量设为:是否发生结直肠炎;是否发生恶心、腹泻持续时间、结肠炎持续时间、恶心持续时间。暴露变量设为:年龄、分组、性别、抑制剂类型。是否使用柴胡桂枝汤加减治疗是影响PD-1/PD-L1抑制剂治疗肿瘤后腹泻影响因素。同时,研究组在使用柴胡桂枝汤加减治疗后,其腹泻持续时间减少2.26 d(95%CI:3.38~1.15,P<0.001),结直肠炎的持续时间减少了2.24 d(95%CI:3.64~0.84,P>0.001)。从效应值方面分析,>60岁的人群,其发生结直肠炎的危险比例与<60岁的人群相比上升了72%;在是否发生结直肠炎方面,使用柴胡桂枝汤加减治疗会降低结直肠炎28%的发生率。见表5。
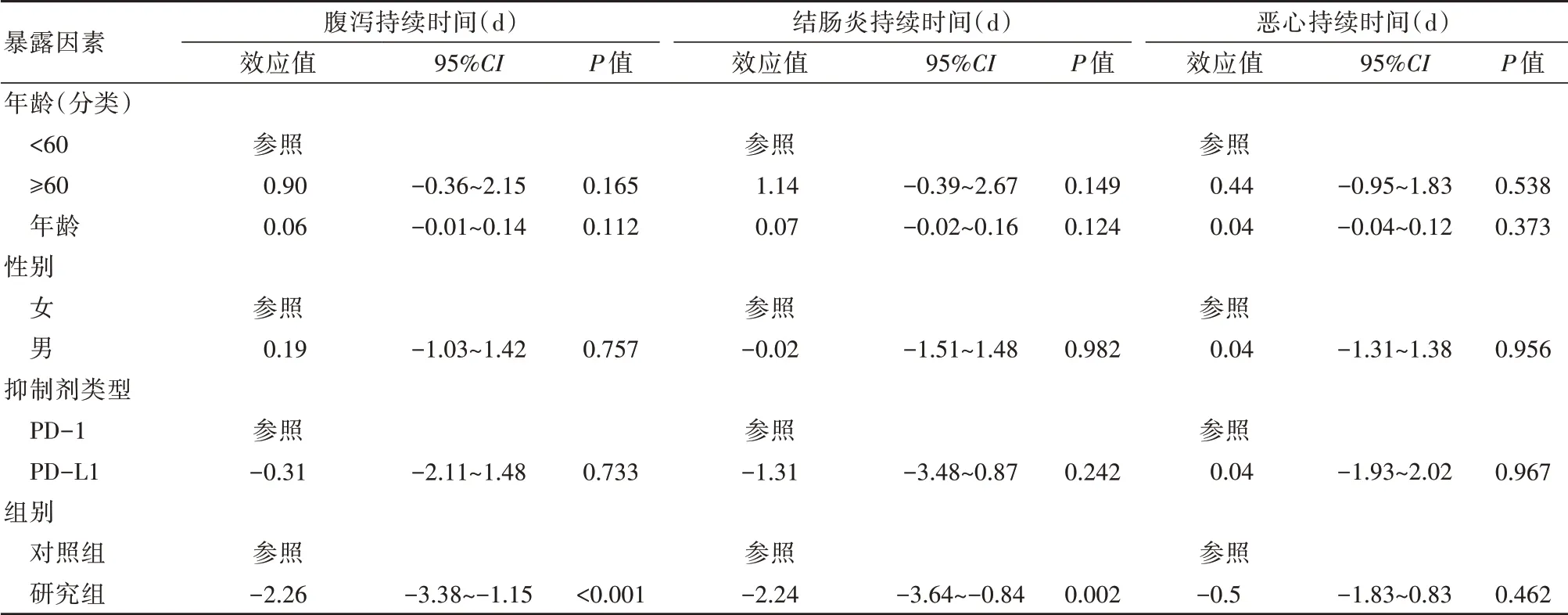
表5 单因素分析结果Table 5 Univariate analysis results
2.5 柴胡桂枝汤加减治疗PD-1/PD-L1抑制剂治疗肿瘤后腹泻的多元回归分析
为了进一步验证柴胡桂枝汤加减治疗是否是影响PD-1/PD-L1抑制剂治疗肿瘤后腹泻的独立影响因素,对柴胡桂枝汤加减治疗PD-1/PD-L1抑制剂治疗肿瘤后腹泻进行了多元回归分析。根据上面单因素分析的结果,将结果变量设为:腹泻持续时间、结肠炎持续时间、恶心持续时间。暴露变量为是否使用柴胡桂枝汤加减治疗。调整模型分别对年龄;性别(女、男);肿瘤类型(胃癌、头颈部肿瘤、食管癌、肾癌、膀胱癌、结直肠癌、肝癌、肺癌、胆囊癌);抑制剂类型(PD-1,PD-L1)进行了调整。见表6。在未调整时,是否使用柴胡桂枝汤加减治疗对腹泻持续时间、结直肠炎持续时间以及恶心持续时间的结果与单因素分析结果相同。在调整了基线资料后,结果发了部分变化,但是对治疗腹泻的作用并未发生变化。因此,是否使用柴胡桂枝汤加减治疗是影响PD-1/PD-L1抑制剂治疗肿瘤后腹泻的独立影响因素,可以显著降低腹泻和结直肠炎的持续时间。

表6 多因素回归分析结果Table 6 Results of multivariate regression analysis
3 讨论
目前,PD-1/PD-L1免疫抑制剂因为其对肿瘤的治疗效果显著,且作用持久,与普通化疗相比具有较高的安全性,已经广泛地应用于肿瘤的临床中。尽管PD-1/PD-L1免疫抑制剂的疗效显著,但是因为其作用机制的原因,必然会导致人体内免疫环境的平衡被破坏,进而发生iRAEs[6]。主要原因是由于PD-1/PD-L1免疫抑制剂在阻断体内PD-1/PD-L1通路的同时会非特异性的激活人体自身的免疫系统并作用于全身器官。而这些不良反应中胃肠道的不良反应通常发生在治疗后的5~10周,症状包括腹泻、食欲减退、恶心和肠炎等。研究表明,患者接受PD-1/PD-L1免疫抑制剂治疗的时间越长,发生消化道不良反应的概率就越大[7]。一般轻度腹泻的患者不用停药。但是,如果患者出现结肠炎等症状则无法再继续肿瘤免疫治疗[8]。
柴胡桂枝汤源于张仲景的《伤寒杂病论》,其兼具了桂枝和小柴胡的功效,即保留了桂枝汤和解表里的功效,还可以调和营卫气血阴阳之功[9-10]。此外,又能够疏肝解郁利枢。因此,其不仅仅能够应用于单一疾病,还可以广泛地应用于其他疾病。神农本草经中记载,柴胡,味苦,平。可去肠胃中的结气,主心腹。而半夏性温,味辛,可降逆止呕,消痞散结,开胃健脾,止呕吐,下肺气,去胸中痰满。此外,黄芪,气寒,味苦,可清泄胆经郁热,入足少阴胆、足厥阴肝经。据现代药理研究发现,黄芪和柴胡共用具有疏肝利胆和护肝的作用。甘草加芍药可以甘酸化阴,平肝缓急,同时还有较好的抗炎、止痛以及解痉等作用[11-12]。柴胡桂枝汤将各味中药集于一身,一方面可以使经络和气血通畅,另一方面还可以调和脾胃,使其阴阳平衡,土木协调,肝气舒畅[13-15]。
目前,将柴胡桂枝汤加减应用于预防PD-1免疫抑制剂治疗肿瘤后腹泻的研究还未见报道。但是,既往报道表明,柴胡桂枝汤对慢性胃炎、消化性溃疡、功能性消化不良及慢性胆囊炎等消化系统疾病具有极佳的疗效。例如马致洁等[16]对柴胡桂枝汤对泛耐药鲍曼不动杆菌侵袭的人肺癌A549细胞的保护作用。邓一聪等[17]对功能性消化不良应用柴胡桂枝汤加减治疗的临床疗效观察,与对照组相比,研究组总疗效达到92.00%,显著高于对照组。汪秀芳[18]在柴胡桂枝汤治疗小儿肠胃炎的55例病例的回顾中发现,治疗组患儿的腹泻持续时间为(4.251±1.76)d,对照组的腹泻持续时间为(6.93±3.16)d,柴胡桂枝汤在治疗肠胃炎方面有着显著的临床效果。本研究选取柴胡桂枝汤加减的治疗手段观察了其在预防PD-1免疫抑制剂治疗肿瘤后腹泻的疗效。结果表明,研究组腹泻持续时间(6.39±2.82)d显 著 低 于 对 照 组(8.65±2.63)d(P<0.001);研究组结肠炎持续时间(4.94±2.32)d显著低于对照组(7.46±2.37)d(P<0.001);研究组恶心持续时间(4.90±2.88)d显著低于对照组(6.05±2.35)d(P<0.05)。同时,单因素与多因素回归分析表明,是否使用柴胡桂枝汤加减治疗是影响PD-1/PD-L1抑制剂治疗肿瘤后腹泻的独立影响因素,可以显著降低腹泻和结直肠炎的持续时间。此外,本研究根据每位患者发生腹泻时的具体情况,采取了加减的治疗方案,针对性较强,同时也显著提升了治疗效果。
综上所述,柴胡桂枝汤加减能够预防并缓解PD-1免疫抑制剂治疗肿瘤后的腹泻情况,且使用安全,值得进一步推广。
